天然海水高盐条件对海绵相关细菌抗菌活性及次级代谢产物的影响
2014-11-01甄心巩婷崔美子王瑞杉朱平
甄心,巩婷,崔美子,王瑞杉,朱平
天然海水高盐条件对海绵相关细菌抗菌活性及次级代谢产物的影响
甄心,巩婷,崔美子,王瑞杉,朱平
100050 北京,中国医学科学院北京协和医学院药物研究所天然药物活性物质与功能国家重点实验室/国家卫生和计划生育委员会天然药物生物合成重点实验室
海洋微生物生活在高盐、高压、低温、低光照、寡营养、弱碱性的海洋环境中,因而形成了独特的生理特征和代谢机制,可产生与陆生微生物结构与活性迥然不同的次级代谢产物,如生物碱、萜类、环肽类和聚酮类等[1-2],成为海洋药物的重要来源之一。从海洋放线菌中分离得到的 salinisporamide A 已经完成了I期临床研究,用于治疗多发性骨髓瘤[3]。以从海洋真菌sp. CNC-139 中获得的化合物为模板合成的 plinabulin(NPI-2358)已经进入II期临床研究,用于治疗非小细胞肺癌[4]。来自于卡纳里水域深海沉积物中的链霉菌 NTK937 产生的 caboxamycin是一种新型的苯并噁唑抗生素,显示出较强的抗菌活性,对革兰阳性菌枯草芽孢杆菌()IC50仅为8 μmol/L[5]。海洋是一个特殊的生态系统,据文献报道,通过模拟海洋环境的拟生态培养,可以诱导海洋真菌产生新的活性代谢产物[6-9]。同时有研究表明,高盐条件造成的极端环境(如高渗透压和营养剥夺等)可以激活生物体内的沉默基因或次级代谢产物合成酶,进而使海洋等来源的耐盐真菌产生新的活性化合物[10-11]。另据文献报道,培养基盐度对海洋真菌的活性物质具有显著影响,其生物活性和活性物质的种类和产量可能有较大的差别[12-13]。但是,应用天然海水培养基探讨海洋来源细菌的抗菌活性、次级代谢产物的 HPLC 化学指纹的报道较少,本实验室曾研究报道天然海水对海绵相关细菌的抗菌活性有影响[14]。另有文献对细菌 HPLC 化学指纹研究进行了报道[15-17],此外,有文献报道天然海水可影响细菌的生长[18-19]。本文以海绵相关细菌为主要研究对象,初步开展了相关探索,以期获得具有良好抗菌活性且次级代谢产物丰富的菌株。
1 材料与方法
1.1 材料
1.1.1 供试菌株 本实验所涉及的海绵相关细菌分离自相似蜂海绵()或丰肉结海绵(),两株海绵均采集自我国南海陵水县新村港附近海域[14,20],均为本实验室保存。用于抗菌活性筛选的指示菌为枯草芽孢杆菌CMCC(B)63501,购自中国医学微生物菌种保藏管理中心。
1.1.2 培养基
⑴LB 培养基:胰蛋白胨 10 g/L、酵母提取物5 g/L、NaCl 10 g/L,pH 7.0,固体培养基加入 1.5% 的琼脂。121 ℃高压蒸汽灭菌 20 min。
⑵生物检定培养基:胰蛋白胨 5 g/L、牛肉膏 3 g/L、酵母提取物 1.5 g/L,pH 7.2 ~ 8.0,上层加入 0.8% 琼脂,下层加 1.5% 琼脂。121 ℃高压蒸汽灭菌 20 min。
1.1.3 仪器 Agilent 1200 分析型液相色谱仪、色谱柱 ZORBAX Eclipse XDB-C18(4.6 mm × 150 mm,5 μm)均为美国 Agilent 公司产品;HZQ-Q 恒温振荡摇床由哈尔滨东联科学仪器有限公司生产。
1.1.4 试剂 乙酸乙酯购自北京化学试剂厂;色谱纯甲醇购自北京宏达欣宇科技有限公司;酵母提取物和胰蛋白胨购自英国 Oxoid 公司;琼脂购自北京拜尔迪生物科技有限公司;牛肉膏购自北京双旋微生物培养基制品厂。天然海水于 2013 年 9 – 10 月取自河北省秦皇岛市北戴河;淡水采用蒸馏水。
1.2 方法
1.2.1 天然海水的高盐条件对海绵相关细菌抗菌活性的影响 将待测菌株以灭菌牙签分别点种于天然海水和淡水(对照)LB 固体培养基上,37 ℃培养 24 ~ 36 h,长出菌落。将指示菌枯草芽孢杆菌 63501 菌悬液加入冷却至 50 ℃的上层生物检定培养基中(浓度为 3%),迅速摇匀,以灭菌移液管吸取适量添加到已经接种的下层培养基平板上,使其均匀分布,37 ℃培养过夜,测量抑菌圈直径,并观察清晰程度以评价其抗菌活性[14,21-22]。
1.2.2 天然海水的高盐条件对海绵相关细菌次级代谢产物 HPLC 指纹的影响 将活化好的菌株分别接种到天然海水和淡水(对照)LB 液体培养基中,于 37 ℃,200 r/min 恒温摇床培养 2 d,采用 3 倍乙酸乙酯对不同的发酵产物进行提取,粗提物用甲醇充分溶解至 10 mg/ml,进行 HPLC 检测,流速:1 ml/min;检测波长:200 ~ 400 nm 全波长扫描;梯度洗脱条件:0 → 50 min 从 10% 甲醇水溶液线性提高到 100% 甲醇。通过液相色谱图上色谱峰的数量及峰面积对比次级代谢产物成分及含量。
2 结果
2.1 天然海水的高盐条件对海绵相关细菌抗菌活性的影响
在 120 株海绵相关细菌中,共有 46 株(38.3%)细菌在天然海水和(或)淡水 LB 固体培养基上显示出了抗菌活性,我们将这 46 株细菌在两种培养基上的抗菌活性进行对比,结果总结归纳为表 1。46 株活性菌株可分为 4 组:第I组的 11 株菌株在天然海水培养基上表现出了抗菌活性,而在淡水培养基上无抗菌活性,其中有 3 株菌株(HLSB303、HLSB3、HLSB228)在天然海水培养基上抑菌圈直径较大且清晰,显示出了较强的抗菌活性。第II组共有 25 株细菌,占活性菌株的半数以上,其在天然海水培养基上的抗菌活性均大于各自在淡水培养基上的活性,其中除了 HLSB264、HLSB25 和 LS56 的活性相对较弱,其余 22 株细菌在海水培养基上的活性较为明显,抑菌圈大且清晰;有些菌落直径虽小于其在淡水培养基上的菌落直径,但其抑菌圈却明显大于其在淡水培养基上的抑菌圈。第III组的 7 株细菌在两种培养基上的抗菌活性相似,但除了 LS52 以外,其余菌株的抗菌活性均不够强。第IV组的3 株细菌中,LS26 和 LS7 在淡水培养基上表现出微弱抗菌活性而在海水培养基上无活性;LS165 在淡水培养基上具有一定抗菌活性而在海水培养基上表现出微弱的抗菌活性,总的说来该组的抗菌活性均不够强。另外,由于菌落大小有差异,菌株之间在相同培养基上的抑菌圈大小不具有可比性,但同一菌株在两种培养基上的抑菌圈大小则可进行比较;有些菌株在海水培养基上的菌落甚至小于其在淡水培养基上的菌落,但在海水培养基上的抑菌圈直径却大于其在淡水培养基上的抑菌圈直径。
2.2 天然海水的高盐条件对海绵相关细菌中小极性次级代谢产物 HPLC 指纹的影响
从上述 46 株细菌中选取了 16 株具有一定代表性的菌株,对其在天然海水和淡水 LB 液体培养基中所产生的中小极性次级代谢产物的 HPLC 指纹图谱进行了对比,观察两种培养基上的代谢产物是否存在差异,部分结果见图 1(以波长 254 nm 处为例)。
首先,仅在天然海水固体培养基上才表现出抗菌活性的细菌在天然海水液体培养基中的次级代谢产物也更为丰富,如第I组的菌株 HLSB3(FJ999554)。说明在天然海水高盐条件的刺激下,这些细菌的某些合成代谢途径被激活,产生了不同于淡水培养基的次级代谢产物,包括抗菌活性物质。
其次,与淡水固体培养基相比较,在天然海水固体培养基上的抗菌活性更高的细菌在次级代谢产物的 HPLC 指纹图谱对比上表现出两种结果:一种结果是,在两种液体培养基中的次级代谢产物的种类大体相似,但含量有所不同,提示我们含量有所增加的成分极有可能是主要的抗菌活性成分,有必要进行进一步的研究和验证,此类菌株如图 1B。另一种是与淡水(对照)液体培养基相比,其在天然海水液体培养基中的次级代谢产物种类更为丰富,含量也高,如菌株 HLSB4,这些只在天然海水培养基中出现和(或)含量增加的成分极有可能包含着抗菌活性物质。

表 1 天然海水高盐条件对海绵相关细菌抗菌活性影响
注:+ 表示有一定的抗菌活性;± 表示有微弱抗菌活性;–表示无抗菌活性。
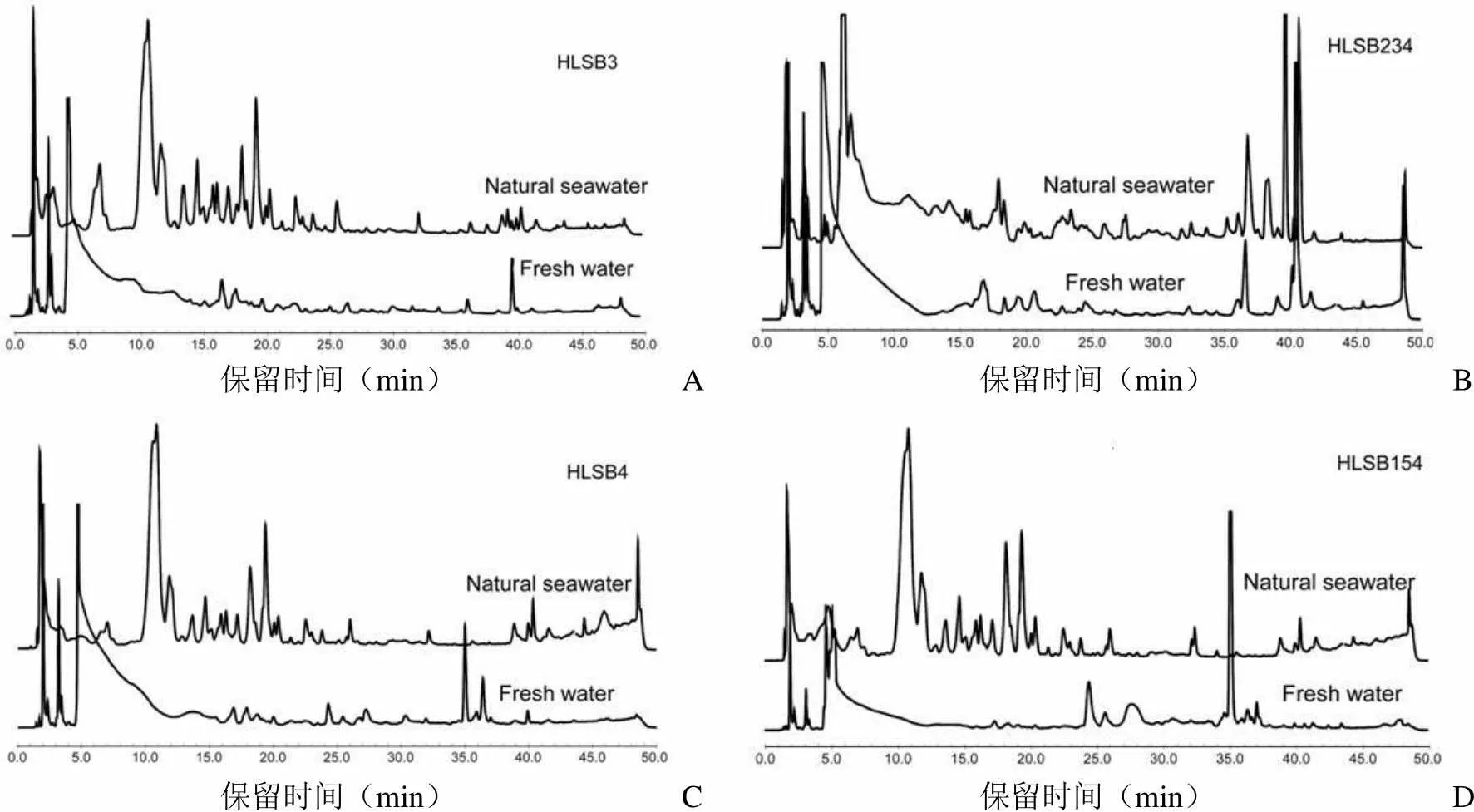
保留时间(min)A保留时间(min)B 保留时间(min)C保留时间(min)D
最后,有些菌株如 HLSB154 虽然在天然海水培养基上的次级代谢产物更为丰富,抗菌活性却没有明显提高,说明海水高盐条件刺激了其他物质的生成。
3 讨论
海洋微生物由于受到海洋环境高盐、寡营养等非生物因子的胁迫,产生独特的代谢机制,因而代谢类型比较复杂,表现在次级代谢产物方面,可能刺激某些次级代谢产物的产生,也有可能会抑制另一些次级代谢产物的形成[23-24],使它们在不同的生长条件下分泌不同类型的化合物[25-26],表现出不同的药理活性。本文研究了天然海水的高盐条件对相似蜂海绵和丰肉结海绵相关细菌的抗菌活性、中小极性次级代谢产物 HPLC 指纹图谱的影响,发现天然海水的高盐条件可以诱导一些海洋来源的细菌产生抗菌活性、或明显提高其抗菌活性,增加其次级代谢产物的多样性。与淡水相比较,在海水高盐条件下存在差异的组分中有一些可能是关键的抗菌活性物质,在寻找新抗生素等生理活性物质的过程中应给予重点关注。我们推测:在天然海水高盐条件的刺激下,恢复了抗菌活性的菌株可能是由于其体内参与抗生素生物合成的沉默基因被激活;而那些抗菌活性得到增强的菌株,可能是因为其沉默基因被激活而产生了原先未曾产生的抗菌活性物质,亦有可能其活性产物谱未发生变化但相关酶表达水平的提高促进了某些抗菌活性产物的合成。海水高盐条件还有可能刺激其他次级代谢产物的形成。当然,海水高盐条件也可能对另外一些抗菌活性物质的合成酶系无作用,或者有抑制作用,表现为在两种培养基上的活性相当或在天然海水培养基上抗菌活性降低。本研究结果提示我们,海洋微生物存在着合成某些次级代谢产物的潜能,如果设法让这些潜能得以发挥,极有可能发现新的活性代谢产物。海洋微生物已成为创新药物研究的重要源泉之一,具有广阔的开发前景。
[1] Hill RT, Fenical W. Pharmaceuticals from marine natural products: surge or ebb? Curr Opini Biotechnol, 2010, 21(6):777-779.
[2] Proksh P, Putz A, Ortlepp S, et al. Bioactive natural products from marine sponges and fungal endophytes. Phytochem Rev, 2010, 9(4): 475-489.
[3] Feling RH, Buahanan GO, Mincer TJ, et al. Salinosporamide A: a highly cytotoxic proteasome inhibitor from a novel microbial source, a marine bacterium of the new genus salinospora. Angew Chem Int Ed Engl, 2003, 42(3):355-357.
[4] Mayer AM, Glaser KB, Cuevas C, et al. The odyssey of marine pharmaceuticals: a current pipeline perspective. Trends Pharmacol Sci, 2010, 31(6):255-265.
[5] Hohmann C, Schneider K, Bruntner C, et al. Caboxamycin, a new antibiotic of the benzoxazole family produced by the deep-sea strain Streptomyces sp. NTK 937. J Antibiot (Tokyo), 2009, 62(2):99-104.
[6] Zhou YL, Wang Y, Liu PP, et al. Effects of environmental stress on secondary metabolites of Aspergillus ochraceus LCJ11-102 associated with the coral Dichotella gemmacea. Acta Microbiologica Sinica, 2010, 50(8):1023-1029. (in Chinese)
周雅琳, 王乂, 刘培培, 等. 环境胁迫对珊瑚共附生真菌Aspergillus ochraceus LCJ11-102次生代谢产物的影响. 微生物学报, 2010, 50(8):1023-1029.
[7] Liu W, Gu Q, Zhu W, et al. Dihydrotrichodimerol and tetratrichodimerol, two new bisorbicillinoids, from a marine-derived Penicillium terrestre. J Antibiot (Tokyo), 2005, 58(10):621-624.
[8] Liu WZ, Gu QQ, Zhu WM, et al. Penicillones A and B, two novel polyketides with tricyclo [5.3.1.03,8] undecane skeleton, from a marine-derived fungus Penicillium terrestre. Tetrahedron Lett, 2005,46(30):4993-4996.
[9] Chen L, Fang Y, Zhu T, et al. Gentisyl alcohol derivatives from the marine-derived fungus Penicillium terrestre. J Nat Prod, 2008, 71(1): 66-70.
[10] Zheng J, Zhu H, Hong K, et al. Novel cyclic hexapeptides from marine-derived fungus, Aspergillus sclerotiorum PT06-1. Org Lett, 2009, 11(22):5262-5265.
[11] Zheng J, Xu Z, Wang Y, et al. Cyclic tripeptides from the halotolerant fungus Aspergillus sclerotiorum PT06-1. J Nat Prod, 2010, 73(6): 1133-1137.
[12] Zhu H, Hua XX, Gong T, et al. Hypocreaterpenes A and B, cadinane-type sesquiterpenes from a marine-derived fungus, Hypocreales sp. Phyto Lett, 2013, 6:392-396.
[13] Wang ZW, Dou YY, Zhu XW, et al. Effects of salinity and pH on the growth and active products-secreting of Aspergillus sp.F3 from the mangrove rhizosphere. Microbiology, 2008, 35(12):1873-1878. (in Chinese)
王治维, 窦莹颖, 祝兴伟, 等. 盐度和pH对红树根际土壤来源的曲霉属真菌F3的生长及分泌活性物质的影响. 微生物学通报, 2008, 35(12):1873-1878.
[14] Li CQ, Liu WC, Zhu P, et al. Phylogenetic diversity of bacteria associated with the marine sponge Gelliodes carnosa collected from the Hainan Island coastal waters of the South China Sea. Microb Ecol, 2010, 62(4):800-812.
[15] Djinni I, Defant A, Kecha M, et al. Metabolite profile of marine-derived endophytic Streptomyces sundarbansensis WR1L1S8 by liquid chromatography-mass spectrometry and evaluation of culture conditions on antibacterial activity and mycelial growth.J Appl Microbiol, 2014, 116(1):39-50.
[16] Dash S, Jin CL, Lee OO, et al. Antibacterial and antilarval-settlement potential and metabolite profiles of novel sponge-associated marine bacteria. J Ind Microbiol Biotechnol, 2009, 36(8):1047-1056.
[17] Rateb ME, Houssen WE, Harrison WT, et al. Diverse metabolic profiles of a Streptomyces strain isolated from a hyper-arid environment. J Nat Prod, 2011, 74(9):1965-1971.
[18] Hu XJ, Shen B, Zhang WB. Effects of pH value and salinity on growth of Vibrio parahaemol yticus and Vibrio cholerae. Chin J Nosocomiol, 2011, 21(22):4855-4857. (in Chinese)
胡兴娟, 沈飚, 张文斌. pH值及盐度对副溶血弧菌与霍乱弧菌生长影响的研究. 中华医院感染学杂志, 2011, 21(22):4855-4857.
[19] Lin XZ, Shen JH, He PQ. Effects of salt on the growth of bacteria isolated from arctic ice. Chin J Polar Res, 2005, 17(2):121-126. (in Chinese)
林学政, 沈继红, 何培青. 盐度对北极海冰细菌生长的影响. 极地研究, 2005, 17(2):121-126.
[20] Liu WC, Li CQ, Zhu P, et al. Phylogenetic diversity of culturable fungi associated with two marine sponges: Haliclona simulans and Gelliodes carnosa, collected from the Hainan Island coastal waters of the South China Sea. Fungal Diversity, 2010, 42(1):1-15.
[21] Kennedy J, Baker P, Piper C, et al. Isolation and analysis of bacteria with antimicrobial activities from the marine sponge Haliclona simulans collected from Irish waters. Mar Biotechnol (NY), 2009, 11(3):384-396.
[22] Nicolas GG, Frenette M, Lavoie MC. Streptococcus salivarius mutants defective in mannose phosphotransferase systems show reduced sensitivity to mutacins I-T9 and R-3B. Can J Microbiol, 2010, 56(8):692-696.
[23] Clement DJ, Stanley MS, O’nell J, et al. Complementation cloning of salt tolerance determinants from the marine hyphomycete Dendryphiella salina in Aspergillus nidulans. Mycol Res, 1999, 103(10):1252-1258.
[24] Redkar RJ, Locy RD, Singh NK. Biosynthetic pathways of glycerol accumulation under salt stress in Aspergillus nidulans. Exp Mycol, 1995, 19(4):241-246.
[25] Kerzaon I, Grovel O, Robiou Du Pont T, et al. Effects of seawater on growth and gliotoxin excretion of marine strains of Aspergillus fumigatus Fres. Toxicon, 2008, 51(3):398-405.
[26] Cantrell SA, Casillas-Martínez L, Molina M. Characterization of fungi from hypersaline environments of solar salterns using morphological and molecular techniques. Mycol Res, 2006, 110(Pt 8):962-970.
“十二五”国家科技重大专项“综合性新药研究开发技术大平台”(2012ZX09301002-001-005);中央高校基本科研业务费(2012N06)
朱平,Email:zhuping@imm.ac.cn
2014-03-17
10.3969/cmba.j.issn.1673-713X.2014.06.013
