以蛋白激酶A为靶点的抗结核药物高通量筛选模型的建立和应用
2014-11-01罗睿徐建魏玉珍李海龙刘红宇苏静赵莉莉张玉琴余利岩
罗睿,徐建,魏玉珍,李海龙,刘红宇,苏静,赵莉莉,张玉琴,余利岩
以蛋白激酶A为靶点的抗结核药物高通量筛选模型的建立和应用
罗睿,徐建,魏玉珍,李海龙,刘红宇,苏静,赵莉莉,张玉琴,余利岩
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所药用微生物菌种保藏管理中心
建立以蛋白激酶 A 为靶点的抗结核药物高通量筛选模型,应用该模型筛选具有特异性酶活抑制活性的微生物发酵液粗提物样品。
以结核分枝杆菌 H37Rv 基因组 DNA 为模板,扩增目的基因片段,构建表达载体 pET43.1a-,在大肠杆菌中克隆表达了重组 MTB PknA 蛋白;采用三步级联的反应方法,利用还原型烟酰胺腺嘌呤二核苷酸到氧化型烟酰胺腺嘌呤二核苷酸这一反应最大吸光值波长的变化,建立和优化蛋白激酶A 抑制剂高通量药物筛选模型。
成功构建了表达载体 pET43.1a-;建立了稳定灵敏,可用于靶向结核分枝杆菌蛋白激酶A 的抗结核药物高通量筛选模型;利用该模型对 4000 个微生物发酵液粗提物样品进行筛选,最终得到 21 个抑制蛋白激酶A 活性的阳性样品,阳性率 0.53%;以耻垢分枝杆菌和海分枝杆菌为检定菌,平板纸片法检测阳性样品的抗分枝杆菌活性,然后对阳性样品的细胞毒性和酶活抑制特异性进行评价后,最终得到 8 个阳性样品,其中 I10AA-02916、I09AA-02717、I09AB-02729、I08AB-00801 这 4 个阳性样品酶活抑制特异性、抗菌活性均较好,且细胞毒性较低。
建立了高稳定性的以蛋白激酶A 为靶点的抗结核药物高通量筛选模型,应用该模型所得到的发酵液阳性样品值得进一步研究。
环AMP依赖性蛋白激酶类; 药物评价,临床前; 抗结核药; 高通量筛选
结核病(tuberculosis,TB)是由结核分枝杆菌引起的严重危害人类健康、流行最广的感染性疾病之一[1]。20 世纪初,人们曾一度乐观地估计,将在全球范围内消灭结核病。然而,结核病不仅没有被消灭,反而在 20 世纪中后期卷土重来,并陆续产生多重耐药、广泛耐药和超级耐药结核分枝杆菌等变种[2-5]。据 WHO 统计,2012 年全球新发 860 万结核患者,并有 130 万人死于结核病。结核病合并艾滋病的流行趋势也是未来需要面对的挑战[6-7]。因此,寻找能有效治疗多重耐药结核、广泛耐药结核等新型有效的抗结核药物显得尤为迫切。
蛋白激酶 A(protein kinase A,PknA)是结核分枝杆菌产生的 11 种丝氨酸/苏氨酸蛋白激酶(serine/threonine protein kinases,STPKs)之一,是结核分枝杆菌生长所必需的[8]。不仅影响结核分枝杆菌细胞分裂和细胞壁合成,还可能干扰宿主细胞的信号传导。基因在指数生长期显著表达,过表达 PknA 会降低生长速度并改变细胞形态,而敲除基因的结核分枝杆菌菌体则变得细长[9-11]。PknA 对结核分枝杆菌的生长分裂和细胞形态的维持具有重要作用,同时,与人同源蛋白激酶(CK1)基因系列差异较大,相似性低于 30%[12]。因此,可作为理想的新型抗结核药物筛选靶点,期望获得选择性较好的蛋白激酶抑制剂。
微生物的次级代谢产物有结构新颖、多样和低毒等特点,是新药开发的重要资源之一,当前天然产物来源的病原菌蛋白激酶抑制剂报道较少[13-14]。本研究通过建立以 PknA 为靶点的高通量筛选模型,期望在微生物次级代谢产物中开发新型酶活抑制活性特异和抗菌活性均较好的抑制剂,为开发有效的抗耐药结核分枝杆菌先导化合物奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与载体 大肠杆菌菌株 DH5α、BL21(λDE3)、耻垢分枝杆菌(mc2155,CPCC 203649)和海分枝杆菌(ATCC 927,CPCC 100246)以及用于微生物发酵液样品制备的 2000 株药物筛选菌株均保藏于国家科技基础条件平台国家微生物资源平台的药用微生物资源子平台;人巨噬细胞 THP-1、鼠巨噬细胞 Raw264.7 及原核表达载体pET43.1a(+) 为本所免疫室惠赠;pMD™19-T 载体购自日本 Takara 公司。
1.1.2 仪器和试剂 Pyrobest DNA 聚合酶、限制性内切酶、T4 DNA 连接酶均购自宝生物工程(大连)有限公司;丙酮酸激酶、乳酸脱氢酶均购自美国 Sigma 公司;ÄKTA 层析系统为美国 GE Healthcare 公司产品;PolarFluostar 多功能荧光检测仪为德国 BMG 公司产品。
1.2 方法
1.2.1 结核分枝杆菌基因重组质粒的构建及其表达
1.2.1.1基因的体外扩增 利用NCBI 数据库中结核分枝杆菌 H37Rv 的基因组序列信息,获取蛋白激酶 A 的序列,对该序列设计适当的引物,上游:5' CG(R I)ATGAGCCCCCG AGT 3';下游:5' CCAA(d III)CGCTA TCTCGTATC 3'。以结核分枝杆菌 H37Rv 基因组 DNA 为模板,PCR 反应扩增出目的基因片段。琼脂糖凝胶电泳鉴定PCR 产物,进行胶回收纯化,然后将目的片段进行末端加 A 反应。使用T4 DNA 连接酶将加尾的 PCR 产物与 pMD™19-T 载体在 16 ℃ 进行连接,连接后的重组质粒命名为 T-。连接产物转化大肠杆菌 DH5α,蓝白斑筛选阳性克隆提取质粒双酶切鉴定插入的片段,再测序验证序列的正确性。
1.2.1.2 原核表达载体的构建 分别用R I和d III对 T-和 pET43.1a 进行双酶切,获得目的基因片段和线性化的 pET43.1a。用 T4 连接酶在 16 ℃连接6 ~ 8 h。将该质粒转化大肠杆菌 DH5α,然后涂布于含有 100 mg/L 氨苄西林的 LB 平板上。37 ℃培养 16 h 筛选重组子,提取质粒,双酶切鉴定载体的正确性,并测序验证片段及插入方向的正确性。将构建的重组质粒命名为 pET43.1a-。
1.2.2 重组质粒在大肠杆菌中的诱导表达及纯化 用构建好测序正确的 pET43.1a-质粒转化大肠杆菌 BL21(λDE3),挑取转化子在 100 mg/L 氨苄西林的 LB 液体培养基中 37 ℃、200 r/min 振荡培养至600= 0.6 ~ 0.8,加入终浓度1 mmol/L 的 IPTG,20 ℃、200 r/min 培养过夜诱导表达。12 h 后离心收获菌体,称量菌体湿重并裂解菌体细胞,通过 SDS-PAGE 蛋白电泳检测目的蛋白在 BL21 中的表达。采用压力破碎对菌体进行破壁,裂解液于 4 ℃、12 000 r/min 离心40 min,取上清用 0.22 μm 滤膜过滤。采用 ÄKTA 系统对过滤后的裂解液进行蛋白的分离纯化,以 5 ml HisTrapTMHP 镍离子亲和层析柱上样,20 ~ 300 mmol/L 的洗脱缓冲液梯度洗脱目的蛋白,收集洗脱峰,对纯化蛋白脱盐和蛋白定量。加入蛋白保存液,检测蛋白浓度后,分装后于–80 ℃冻存。
1.2.3 结核分枝杆菌 PknA 活性的测定 由于还原型烟酰胺腺嘌呤二核苷酸(NADH)在 340 nm波长处有最大光吸收,而氧化型烟酰胺腺嘌呤二核苷酸(NAD+)的最大光吸收在 260 nm 处。伴随着 NADH 到 NAD+这一反应的进行,反应体系在 340 nm 波长下的光吸收值会大大降低,其数值可通过酶标仪测得。因此本实验通过检测反应体系在340 nm 波长下的光吸收值变化来反映体系中 ADP的生成量,进而反映出 PknA 的催化活性大小。酶活测定体系终浓度为:Hepes 100 mmol/L、MgCl210 mmol/L、MnCl22 mmol/L、ATP 2 mmol/L、PEP 1 mmol/L、NADH 1 mmol/L、PknA 9.5 μg/100 μl、丙酮酸激酶 1.8 U/100 μl、乳酸脱氢酶 1.8 U/100 μl。
1.2.4 结核分枝杆菌 PknA 抑制剂酶水平筛选模型的建立、优化和应用
1.2.4.1 筛选模型相关指标的测定 考察筛选模型反应体系中各组分对酶活性影响,确定最佳反应条件,对模型进行优化,以及对孔板的稳定性、均一性进行评价。
模型评价指标计算公式:

S=正常酶反应体系荧光值 N其他成分荧光值平均值
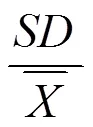
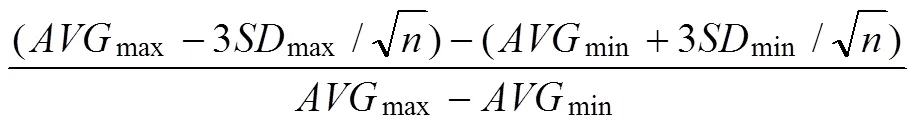
其中 S/N:信噪比;max:最大平均值;min:最小平均值;max:最大标准差;min:最小标准差;n:孔数。
1.2.4.2 待测样品的前处理 每个菌株均采用两种培养基 A1 和 A2 进行发酵[15]。从斜面上挑取生长状态良好的菌种转接入25 ml 发酵培养基中,28 ℃、190 r/min 旋转摇床培养 4 d。微生物发酵液用等体积的丙酮抽提,离心后取 10 ml 的上清真空浓缩挥干,用1 ml DMSO 溶解得到粗提物。筛选时用等体积的DMSO 倍比稀释,取 1 μl 加入至 100 μl 反应体系。
1.2.4.3 待测样品对 PknA 抑制作用的测定 依照前文所述配制酶活测定反应体系,并在每 100 µl 反应体系中加入 1 μl 待测发酵液样品。阳性对照为不加 PknA(相当于酶活性被完全抑制)的体系,阴性对照为以等体积的发酵培养基抽提液代替待测样品(相当于未加抑制剂)。
酶抑制率IR(%)=
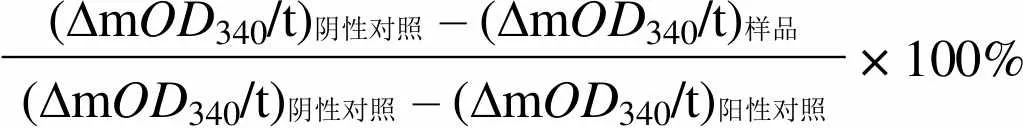
(∆mOD340/t)阴性对照– (∆mOD340/t)样品× 100% (∆mOD340/t)阴性对照– (∆mOD340/t)阳性对照
1.2.4.4 假阳性结果的排除 假阳性排除体系:100 mmol/L Hepes、10 mmol/L MgCl2、2 mmol/L MnCl2、2 mmol/L ADP、1 mmol/L 磷酸烯醇式丙酮酸、1 mmol/L NADH、1.8 U 丙酮酸激酶、1.8 U 乳酸脱氢酶,并加入待测样品。酶标仪 37 ℃下监测上述反应体系 5 min 内340值的变化。若反应体系的340值迅速降低,则表明模型筛得的阳性样品确实是 PknA 的抑制剂而非丙酮酸激酶和乳酸脱氢酶的抑制剂,否则即为假阳性。
1.2.4.5 平板纸片法测定酶水平阳性样品的抗菌活性 分别采用耻垢分枝杆菌和海分枝杆菌作为检定菌,建立简便、快速、有效的细胞水平筛选模型。将检定菌按 1.0% 分别接种于7H11 培养基中,倒平板。将加有 20 μl 发酵液样品的 6 mm 的纸片贴于平板上,分别培养 12 h 和 48 h 后测量抑菌圈的大小。采用异烟肼作为阳性对照,浓度 100 μg/纸片。
1.2.4.6 MTT 比色法检测阳性样品的细胞毒性 采用 MTT 法检测筛选所得的阳性样品对人巨噬细胞 THP-1 和鼠巨噬细胞 Raw264.7 存活的影响情况[16]。加入的发酵液终浓度为 1%。细胞存活率计算式为:

细胞存活率(%)=OD加药组– OD本底× 100% OD空白对照组– OD本底
1.2.4.7 NADH 比色法检测阳性样品的酶活特异性 检测阳性样品对其他两个丝氨酸/苏氨酸蛋白激酶 MTB 蛋白激酶 B(PknB)和 MTB 蛋白激酶 G(PknG),非丝氨酸/苏氨酸蛋白激酶 MTB 肽脱甲酰基酶(PDF)和 MTB 苯丙氨酰-tRNA 合成酶(PheRS)以及人蛋白激酶 B(AKT1)的酶活抑制率。初步验证阳性样品的酶活特异性。PknB、PknG、PDF、PheRS 酶活检测步骤详见参考文献[17-20]。AKT1 酶活测定方法与 PknA 的酶活测定方法类似,体系浓度为:AKT1 2 μg/100 μl、ATP 1 mmol/L、NADH 1 mmol/L。
2 结果
2.1 原核表达载体的构建及表达
2.1.1 重组质粒 pET43.1a-的构建 以结核杆菌 H37Rv 基因组 DNA 为模板进行 PCR 扩增得到的 DNA 片段与A(1296 bp)基因片段大小相符。构建A 基因的克隆载体并命名为 T-A。通过将基因片段和线性化的 pET43.1a 同时连接,获得重组质粒 pET43.1a-A。DNA 测序结果表明,基因序列和插入载体的方向正确(图 1)。
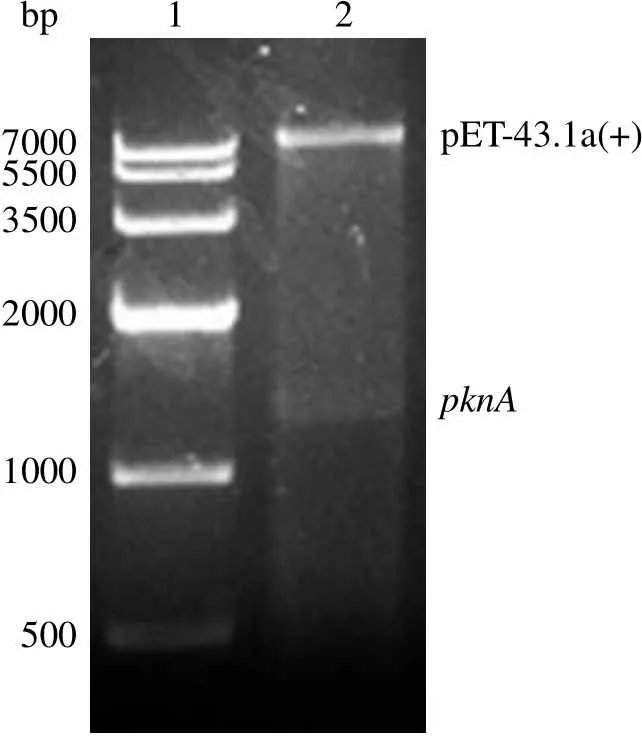
bp 1 2 700055003500 2000 1000 500 pET-43.1a(+) pknA
Figure 1 Digestion analysis of pET 43.1a-by restriction enzymes
2.1.2 结核分枝杆菌重组 PknA 的表达和纯化 将重组表达质粒 pET43.1a-A 转化BL21(λDE3) 感受态细胞,经 IPTG 诱导后,通过 4% ~ 12% 的梯度胶 SDS-PAGE 电泳检测总蛋白,结果显示结核分枝杆菌 Nus-PknA 融合蛋白得到了很好地表达,大小约 115 kD(图 2)。SDS-PAGE 检测结果表明纯化后的蛋白具有较高的纯度,达95.60%。
2.2 结核分枝杆菌 PknA 的酶学性质测定
2.2.1 重组 PknA 蛋白比活力的测定 本研究把 37 ℃下,每分钟催化 1 μmol/L 底物 ATP 生成产物 ADP 所需的 PknA 量定义为一个活力单位(U)。结果显示实验组Δm340/t 值为 21.73,空白对照组 Δm340/t 值为 4.95(图 3),每分钟反应的NADH 量为 9.58 μmol/L,即每分钟反应的 ATP 量为 9.58 μmol/L。反应体系中加入的酶量为 9.5 μg,由此计算得到每 mg 重组 PknA 的比活力是 1008.4 U。

kD 1 2 3 4 5 210 105 785545 34 17 Nus-PknA
Figure 2 The purification of PknA expressed in
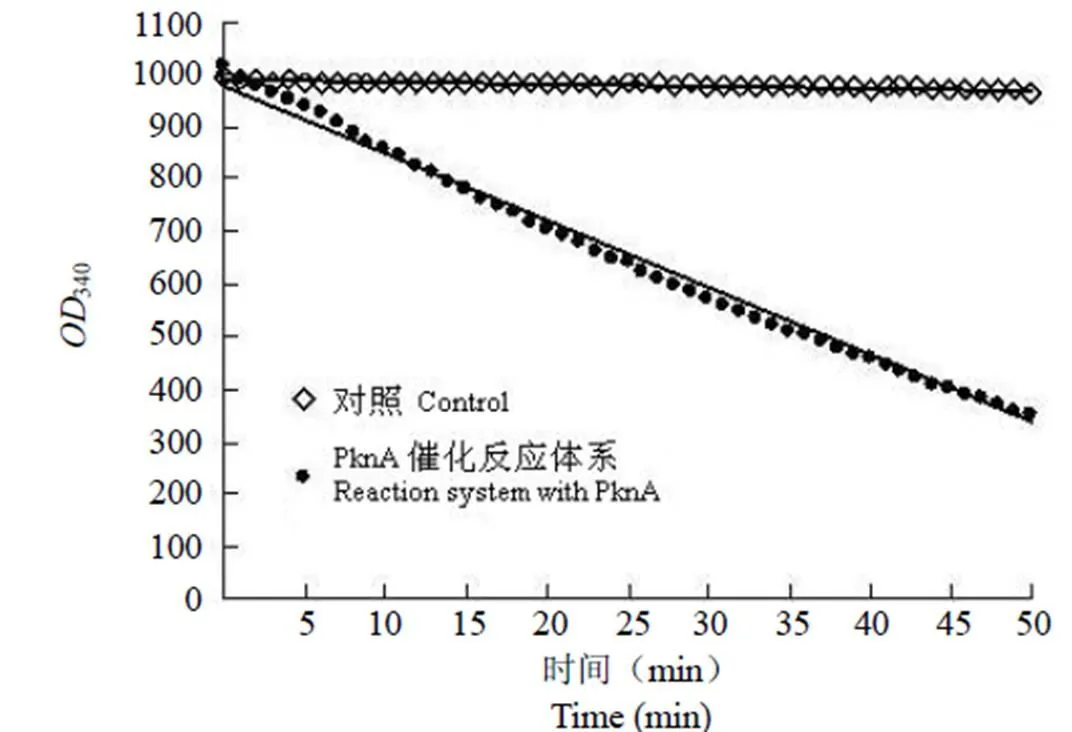
图 3 PknA 催化反应体系光吸收变化曲线
Figure 3 Experimental determination of the reaction rate
2.2.2 反应速率与酶浓度的关系 本研究保持反应体系中其他反应物的浓度不变,分别测定PknA 在不同浓度下的反应速率。结果表明,反应速率随着酶浓度的增加而逐渐加快,两者呈良好的线性关系(图4)。
2.2.3 重组 PknA 蛋白反应动力学研究 本研究中,PknA 催化反应的底物为ATP。在固定其他底物浓度的条件下,分别设置一系列ATP 浓度,研究其酶反应动力学。研究结果表明重组 PknA 对底物 ATP 的米氏常数 Km 值为 0.174(图 5),最大反应速率 Vmax值为 20.70(Δm340/t)(图 6)。

反应速率(ΔmOD340/t)Reaction rate (ΔmOD340/t)60 50 40 30 20 10 0 2 4 6 8 10 12 14 16 18 20 22 24 酶浓度(μg/100 μl)Enzyme concenration (μg/100 μl)
Figure 4 Correlation of reaction rate with the concentration of PknA
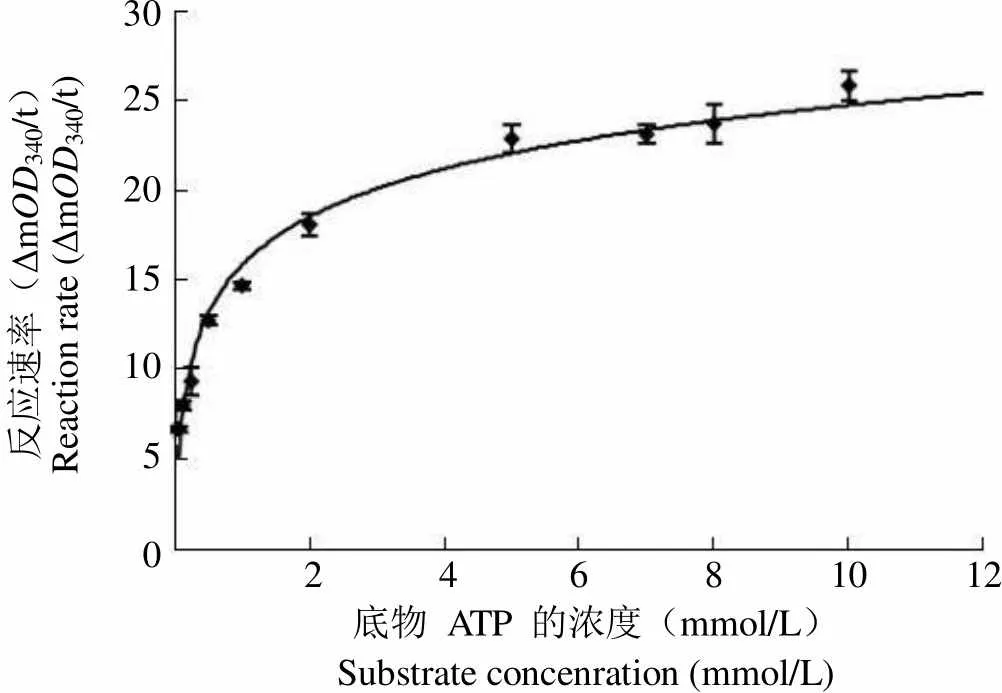
反应速率(ΔmOD340/t)Reaction rate (ΔmOD340/t)30 25 20 15 10 5 0 2 4 6 8 10 12 底物 ATP 的浓度(mmol/L)Substrate concenration (mmol/L)
Figure 5 Correlation of reaction rate with the substrate concentration
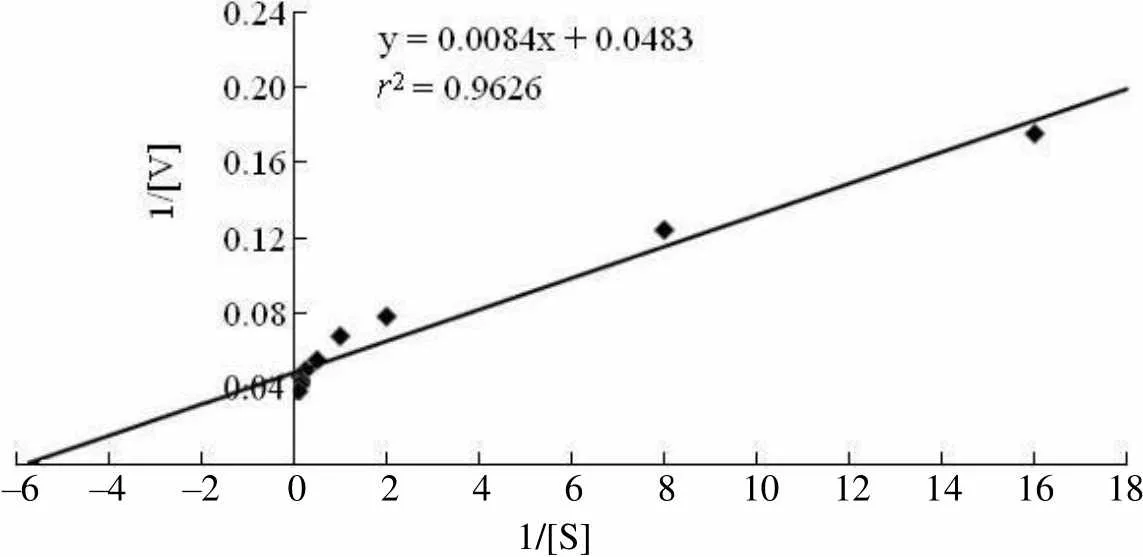
–6 –4 –2 0 2 4 6 8 10 12 14 16 18 1/[S]
Figure 6 The curve of Michaelis-Menten equation
2.2.4 温度对重组 PknA 酶活性的影响 本研究测定了不同温度对 PknA 酶活性的影响。结果表明:在 28 ~ 45 ℃范围内,反应速率在 37 ℃时达到最大,因此选择 37 ℃为最佳反应温度(图 7)。
2.2.5 反应时间对吸光值的影响 本研究测定了不同反应时间对反应体系的影响。结果表明在一定的时间范围内,反应体系的Δm340值与反应时间具有良好线性关系(图 8)。反应时间超过 50 min后,反应基本结束,吸光度不再随反应时间降低。因此反应时间应控制在 50 min 之内较好。
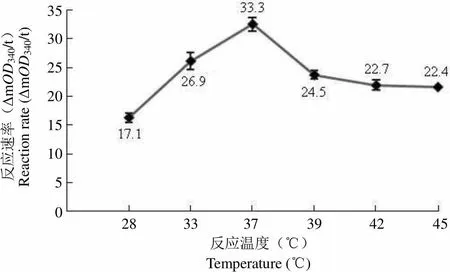
反应速率(ΔmOD340/t)Reaction rate (ΔmOD340/t)35302520151050 28 33 37 39 42 45 反应温度(℃)Temperature (℃)
Figure 7 Effect of the temperature on absorption
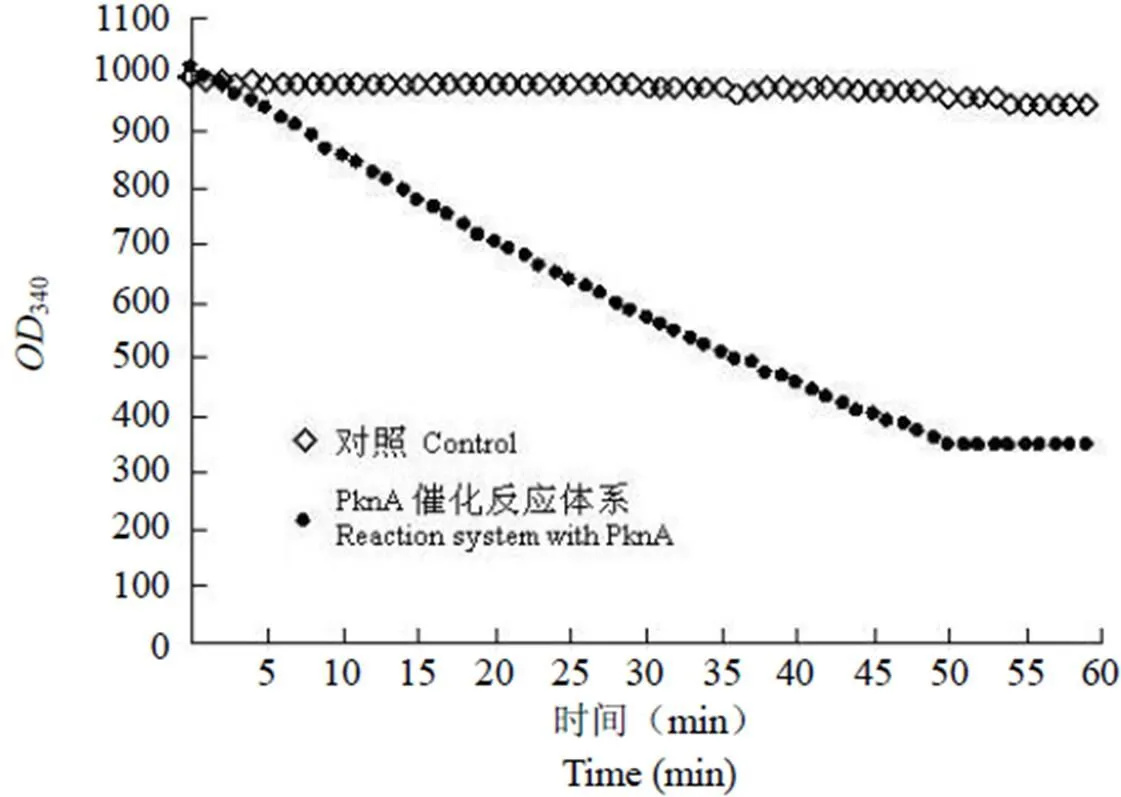
图 8 反应时间对吸光值的影响
Figure 8 Effect of reaction time on absorption
综上所述,经优化后的酶反应条件为:反应温度 37 ℃;反应时间 50 min;酶浓度 9.5 μg/100 μl;底物 ATP 终浓度为 2 mmol/L。在此条件下,酶催化活性得到充分发挥,但又不致反应速率过快,反应速率处于良好的线性范围内。
2.3 药物筛选模型的评价
2.3.1 DMSO 浓度对酶活性的影响 反应体系中分别加入 0% ~ 7% 的 DMSO,观察不同浓度的DMSO对反应体系中酶活性的影响。结果表明,DMSO 浓度高于 2% 时340读数明显下降(图 9)。因此确定体系中最高 DMSO 浓度不超过 2% 为宜。
2.3.2 反应体系中各成分的影响 本研究对反应体系中各成分:ATP、酶、Nus 蛋白、DMSO、A1 培养基抽提物、A2 培养基抽提物等在 340 nm 处吸收值的影响进行了考察,计算该模型的信噪比 = 29.11/5.17 = 5.63,符合筛选模型信噪比大于 3 的要求(图 10)。
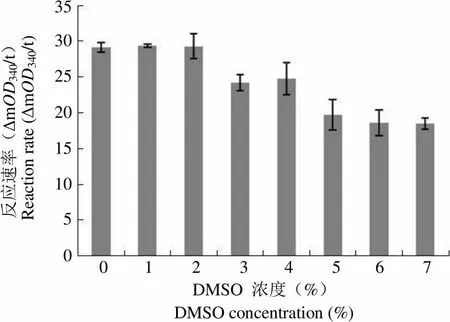
反应速率(ΔmOD340/t)Reaction rate (ΔmOD340/t)35302520151050 0 1 2 3 4 5 6 7 DMSO 浓度(%)DMSO concentration (%)
Figure 9 Effect of the DMSO concentration on enzyme activity
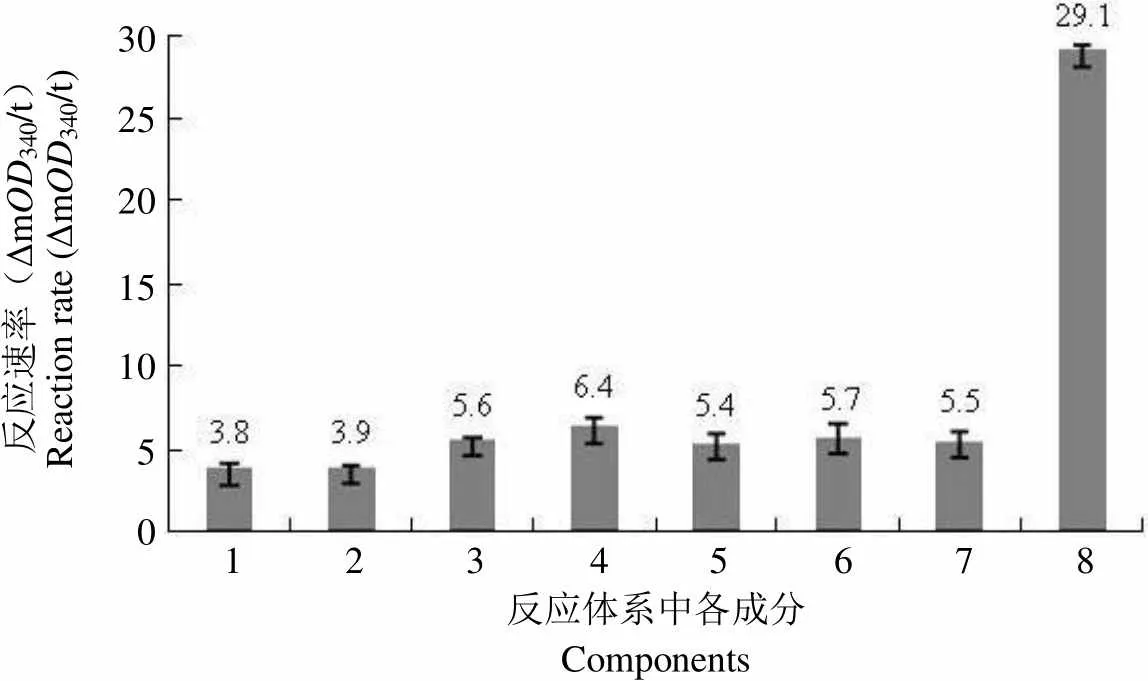
反应速率(ΔmOD340/t)Reaction rate (ΔmOD340/t)302520151050 1 2 3 4 5 6 7 8 反应体系中各成分Components
Figure 10 Effect of single component on the assay
2.3.3 孔板均一性和稳定性评价 本研究根据酶反应体系中阳性对照组和阴性对照组的数据来计算变异系数(CV)以及Z'因子对模型进行可行性分析,经优化的体系在 96 孔板中反应,分别设阴性对照板(正常酶反应体系)和阳性对照板,实验重复 3 次,每次反应所需的试剂都需重新配制。实验结果表明所测得数据不存在明显趋势,无明显边缘效应。CV阴性对照= 6.54% < 20%;CV阳性对照= 3.56% < 20%;Z' = 0.77 > 0.4。各项指标均符合模型筛选的要求。

表 1 阳性样品的抑酶活性及抗菌活性
2.4 微生物发酵液样品的筛选结果
本研究一共筛选来自微生物发酵液库样品 4000 个。酶活抑制率大于 30% 的样品认定为阳性,经过 3 次生物学重复和假阳性结果的排除,最终获得 21 个具有抑制 PknA 活性的发酵液阳性样品,阳性率为 0.53%。由于耻垢分枝杆菌和海分枝杆菌 PknA 与结核分枝杆菌 PknA 在基因序列上有较高的相似性(经 NCBI 的 BLAST 序列比对,分别为 83% 和 87%),且我们前期实验表明,抗耻垢和海分枝杆菌活性与抗结核分枝杆菌活性具有一定的一致性。本研究采用平板法以这两种分枝杆菌测定发酵液阳性样品的抗菌活性,结果表明 9 个发酵液阳性样品在酶水平和细胞水平均具有较好的生物学活性,结果见表 1。
2.5 微生物发酵液样品的细胞存活率结果
本研究采用 MTT 试验,检测了上述发酵液阳性样品对人单核-巨噬细胞 THP-1 和鼠单核-巨噬细胞 Raw264.7 的细胞存活率影响。9 个发酵液阳性样品中,仅有 1 个样品 I09AA-02703 的细胞毒性较大,其余样品细胞毒性较小,结果见表2。
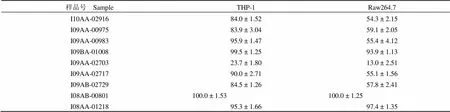
表 2 阳性样品的细胞存活率(%)
2.6 微生物发酵液样品的酶活特异性结果
本研究利用结核分枝杆菌PknB、PknG、PDF、PheRS 和人的 AKT1 酶活测定方法,初步考察了发酵液阳性样品的酶活抑制特异性,结果表明I10AA-02916、I09AA-02717、I09AB-02729、I08AB-00801 这4 个发酵液阳性样品对 PknA 酶活抑制的特异性较好,并且对人蛋白激酶 AKT1 几乎无抑制作用,靶向选择性较好(表 3),值得进一步深入研究。
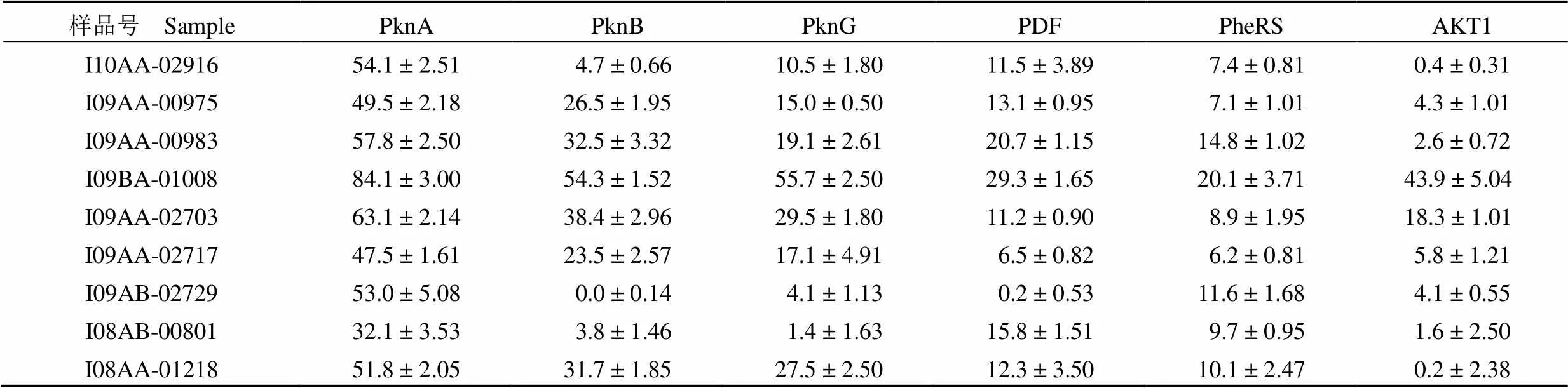
表 3 阳性样品的酶活特异性(%)
3 讨论
STPKs 已被研究证实是病原微生物重要的毒力因子。STPKs 在蛋白质可逆磷酸化调控中发挥着关键作用,例如应激反应、细胞周期的调控以及生长存活等。这种调控形式在所有生命进化的过程中都是保守的。PknA 是结核分枝杆菌 STPKs 中最重要的分子之一,是结核分枝杆菌生长分裂和细胞形态调节的关键分子,在蛋白磷酸化的信号传导过程中发挥重要作用[21]。其作为潜在药物靶点的地位已被广泛认同。本研究对结核分枝杆菌 PknA 进行了克隆表达。由于其为跨膜蛋白,可溶性较差,表达时容易聚合成三种形式[22]。我们采用含有 Nus(约60 kD)标签的pET43.1a 构建重组质粒,相比使用pET28a 等表达质粒,所得的目的蛋白可溶性有很大提高,并且获得了纯度较高的 Nus-PknA 融合蛋白,100 ml 培养基培养的菌体纯化可得到 4.46 mg 目的蛋白,可以满足大量筛选的要求。实验证实,Nus 蛋白并不影响酶活体系的测定与评价,保证了模型的可靠性。利用该模型筛选了库存发酵液样品 4000 个,对初筛阳性菌株进行重复发酵和筛选,选取对 PknA 酶和mc2155、ATCC 927 均有活性的菌株作为复筛阳性菌株。随后对阳性样品的真核细胞毒性进行评价,最终得到了8 个发酵液阳性样品在酶水平和抗分枝杆菌方面均具有良好的活性且毒性较低。
目前研究已证明 PknA、PknB 和 PknG 是结核分枝杆菌 STPKs 中最重要的 3 个蛋白激酶。本研究选择结核分枝杆菌另外两个 STPKs:PknB、PknG 和非 STPKs 的 PDF、PheRS,以及人蛋白激酶 AKT1 对阳性样品酶活特异性进行了初步研究。结果发现 9 个阳性样品对PDF、PheRS 和 AKT1 抑酶活性均较弱。部分阳性样品对结核分枝杆菌同一家族的PknB 和 PknG 也具有抑酶活性,但对 PknB 的抑制活性具有一定的优势。推测原因可能为:①在结核分枝杆菌中,和基因序列相似性只有 14.0%,但它们的催化活性区域 PknA(residues 1-338)和 PknB(residues1-331)蛋白的二级结构相似性达 36.8%,激酶活化域中的两个苏氨酸残基催化位点(Thr-172 和 Thr-174)位点相同,活性中心金属离子均为 Mn2+[23];②尽管 PknA 和 PknB 磷酸化的底物不同,如 PknA 能磷酸化细胞分裂蛋白 FtsZ 及GlmU、KasA、Wag31 等底物[24-25],而 PknB 作用于 GarA、N-乙酰葡糖胺-1-磷酸尿苷酰转移酶、叉头结构域相关蛋白 Rv0019c、PapA5 等,但 PknA 和 PknB 位于同一操纵子下,均为跨膜蛋白,具有相似生物生理作用,且都能被跨膜的 Mstp 蛋白去磷酸化[22];③PknG 是可溶性蛋白,对于结核分枝杆菌在巨噬细胞内以“持留”状态长期存活有着重要作用。PknA 和 PknG 在N 端激酶活化域也存在保守的氨基酸残基,可能与个别阳性样品对其产生抑制作用相关。近来研究发现,PknB 通过N 端激酶活化域即能够发挥磷酸化作用,但PknA 必须通过激酶活化域和近膜结构域两部分协同才能产生磷酸化作用[23]。金属离子 Zn2+等对于它们的磷酸化速率也有不同程度的影响。PknA 和 PknB 两个靶点的这些异同对我们的后续研究有着重要的意义。
本实验室前期的研究发现,抗耻垢分枝杆菌、海分枝杆菌的活性与抗结核分枝杆菌活性有着较好的一致性,但为了防止漏筛的发生,在后续的研究中,除评价上述 9 个阳性样品抗结核分枝杆菌活性外,也进一步评价了其他酶水平阳性样品的抗结核分枝杆菌活性。对于具有较好抗结核分枝杆菌活性的样品,因微生物发酵液成分复杂,即使是出现粗提品酶活抑制特异性不强或细胞毒性较大的情况,我们都将通过初步的分离纯化工作,进一步考察活性成分和毒性成分是否可以分开,以及会不会是不同的组分造成的酶活抑制选择性不强等问题。后期将针对具有抗结核分枝杆菌活性的阳性样品进行活性次级代谢产物的分离纯化和结构鉴定工作,为发现新型微生物来源的抗耐药结核分枝杆菌先导化合物打下基础。
[1] O'Brien RJ, Nunn PP. The need for new drugs against tuberculosis. Obstacles, opportunities, and next steps. Am J Respir Crit Care Med, 2001, 163(5):1055-1058.
[2] Young DB, Cole ST. Leprosy, tuberculosis, and the new genetics.J Bacteriol, 1993, 175(1):1-6.
[3] Chen MS, Huber AB, van der Haar ME, et al. Nogo-A is a myelin-associated neurite outgrowth inhibitor and an antigen for monoclonal antibody IN-1. Nature, 2000, 403(6768):434-439.
[4] Zwolska Z, Augustynowicz-Kopeć E. Drug resistant tuberculosis. Pol Merkur Lekarski, 2011, 30(179):362-366.
[5] Banerjee R, Schecter GF, Flood J, et al. Extensively drug-resistant tuberculosis: new strains, new challenges. Expert Rev Anti Infect Ther, 2008, 6(5):713-724.
[6] Reniero A, Beltrán M, de Kantor IN, et al. AIDS pacient's long-term battle with multiply recurrent tuberculosis: reinfection or reactivation? Rev Argent Microbiol, 2010, 42(4):271-273.
[7] Cohn DL, Bustreo F, Raviglione MC. Drug-resistant tuberculosis:review of the worldwide situation and the WHO/IUATLD Global Surveillance Project. International Union Against Tuberculosis and Lung Disease. Clin Infect Dis, 1997, 24(1):121-130.
[8] Av-Gay Y, Everett M. The eukaryotic-like Ser/Thr protein kinases of Mycobacterium tuberculosis. Trends Microbiol, 2000, 8(5):238-244.
[9] Kang CM, Abbott DW, Park ST, et al. The Mycobacterium tuberculosis serine/threonine kinases PknA and PknB: substrate identification and regulation of cell shape. Genes Dev, 2005, 19(14): 1692-1704.
[10] Del Sol R, Mullins JG, Grantcharova N, et al. Influence of CrgA on assembly of the cell division protein FtsZ during development of Streptomyces coelicolor. J Bacteriol, 2006, 188(4):1540-1550.
[11] Matsuhashi M. Utilization of lipid-linked precursors and the formation of peptidoglycan in the process of cell growth and division. San Diego: Elsevier Science Publisher B, 1994:55-71.
[12] Manning G, Whyte DB, Martinez R, et al. The protein kinase complement of the human genome. Science, 2002, 298(5600):1912- 1934.
[13] Capdeville R, Buchdunger E, Zimmermann J, et al. Glivec (STI571, imatinib), a rationally developed, targeted anticancer drug. Nat Rev Drug Discov, 2002, 1(7):493-502.
[14] Fabbro D, Parkinson D, Matter A. Protein tyrosine kinase inhibitors: new treatment modalities? Curr Opin Pharmacol, 2002, 2(4):374-381.
[15] Wei YZ, Zhang YQ, Zhao LL, et al. Isolation, screening and preliminary identification of endophytic actinobacteria from mangroves at Shankou of Guangxi Province. Microbiol China, 2010, 37(6):823-828. (in Chinese)
魏玉珍, 张玉琴, 赵莉莉, 等. 广西山口红树林内生放线菌的分离、筛选及初步鉴定. 微生物学通报, 2010, 37(6):823-828.
[16] Zou WJ, Liu ZG, Jiang AH, et al. Doxycycline induces apoptosis in THP-1 cells. Chin J Pathophysiology, 2007, 23(6):1195-1198. (in Chinese)
邹文进, 刘祖国, 蒋爱华, 等. 多西环素诱导单核细胞系THP-1凋亡的实验研究. 中国病理生理杂志, 2007, 23(6):1195-1198.
[17] Xing Y, Huang B, Xu J, et al. The establishment and application of a high throughput screening assay for inhibitors of Mycobacterium tuberculosis protein kinase B. Microbiol China, 2014, 41(4):646-653. (in Chinese)
邢韵, 黄彬, 徐建, 等. 以蛋白激酶B为靶点的新型抗结核药物高通量筛选模型的建立和应用. 微生物学通报, 2014, 41(4):646-653.
[18] Shao TS, Wei YZ, Li QP, et al. The establishment and application of anti-tuberculosis drugs screening model targeting to PknG. Microbiol China, 2010, 37(2):312-318. (in Chinese)
邵天舒, 魏玉珍, 李秋萍, 等. 以蛋白激酶G为靶点的抗结核药物筛选模型的建立和初步应用. 微生物学通报, 2010, 37(2):312-318.
[19] Zhang LR, Zhao LL, Wei YZ, et al. The establishment and application of high throughput screening model targeting to Mycobacterium tuberculosis peptide deformylase. Chin Med Biotechnol, 2012, 7(2):110-115. (in Chinese)
张丽蓉, 赵莉莉, 魏玉珍, 等. 以肽脱甲酰基酶为靶点的抗结核药物高通量筛选模型的建立和应用. 中国医药生物技术, 2012, 7(2): 110-115.
[20] Zhang ZM, Sun Y, Zhao LL, et al. The establishment and application of a high throughput screening assay for inhibitors of Mycobacterium tuberculosis Phenylalanyl-tRNA synthetase. Microbiol China, 2012, 39(10):1437-1446. (in Chinese)
张志明, 孙莹, 赵莉莉, 等. 以苯丙氨酰-tRNA合成酶为靶点的新型抗结核药物高通量筛选模型的建立和应用. 微生物学通报, 2012, 39(10):1437-1446.
[21] Schreiber M, Res I, Matter A. Protein kinases as antibacterial targets. Curr Opin Cell Biol, 2009, 21(2):325-330.
[22] Chopra P, Singh B, Singh R, et al. Phosphoprotein phosphatase of Mycobacterium tuberculosis dephosphorylates serine-threonine kinases PknA and PknB. Biochem Biophys Res Commun, 2003, 311(1):112-120.
[23] Thakur M, Chaba R, Mondal AK, et al. Interdomain interaction reconstitutes the functionality of PknA, a eukaryotic type Ser/Thr kinase from Mycobacterium tuberculosis. J Biol Chem, 2008, 283(12): 8023-8033.
[24] Thakur M,Chakraborti PK. GTPase activity of mycobacterial FtsZ is impaired due to its transphosphorylation by the eukaryotic-type Ser/Thr kinase, PknA. J Biol Chem, 2006, 281(52):40107-40113.
[25] Thakur M, Chakraborti PK. Ability of PknA, a mycobacterial eukaryotic-type serine/threonine kinase, to transphosphorylate MurD, a ligase involoved in the process of peptidoglycan biosynthesis. Biochem J, 2008, 415(1):27-33.
[26] Chaba R, Raje M, Chakraborti PK. Evidence that a eukaryotic-type serine/threonine protein kinase from Mycobacterium tuberculosis regulates morphological changes associated with cell division. Eur J Biochem, 2002, 269(4):1078-1085.
Establishment and application of a high throughput screening assay for inhibitors ofPknA
LUO Rui, XU Jian, WEI Yu-zhen, LI Hai-long, LIU Hong-yu, SU Jing, ZHAO Li-li, ZHANG Yu-qin, YU Li-yan
To establish and validate a high throughput assay for screening the inhibitors ofPknA.
Agene from the genome DNA ofH37Rv was amplified and recombinant plasmid pET43.1a-was constructed to express the PknA protein in. Using purified PknA, a high throughput screening model was established and optimized to screen for PknA inhibitors. The microbial fermentation extracts were screened using the screening assay, and the anti-bacterial activity, cytotoxicity and specific inhibitory effect of positive samples were further assessed.
21 out of 4000 microbial fermentation extracts were identified with inhibitory effect on activity of PknA, among which 4 samples showed antibacterial activity, lower cytotoxicity and better specificity of inhibitory effect.
The establishment of high throughput screening method and these 8 positive microbial fermentation extracts will facilitate the development of novel antitubercular agents.
Cyclic AMP-dependent protein kinases; Drug evaluation, preclinical; Antitubercular agents; High throuphput screening
YU Li-yan, Email: yly@cpcc.ac.cn
10.3969/cmba.j.issn.1673-713X.2014.06.002
国家自然科学基金(30970038、81373452);国家微生物资源平台(NIMR-2013-3);国家科技重大专项(2014ZX09201001-011)
余利岩,Email:yly@cpcc.ac.cn
2014-05-04
Author Affiliation: Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
