低氧对肌腱细胞基因表达谱的影响
2014-11-01刘丽丽杨柠泽张延洁王志军
刘丽丽, 杨柠泽, 张延洁, 王志军
实验研究
低氧对肌腱细胞基因表达谱的影响
刘丽丽, 杨柠泽, 张延洁, 王志军
目的探讨低氧对肌腱细胞基因表达谱的影响。方法酶消化法分离得到的肌腱细胞分别在低氧(2%O2)和常规氧浓度(21%O2)下进行培养,第1代肌腱细胞进行表达谱检测,并用RT-PCR对其中4个差异表达基因进行验证。结果低氧培养组与常规氧浓度组相比,有40个基因表达差异,且全部在低氧组表达上调。选取的4个差异表达基因的RT-PCR的验证结果与芯片结果一致。结论低氧促进肌腱细胞增殖涉及多个基因参与。
低氧; 肌腱细胞; cDNA芯片; 基因表达谱
肌腱细胞是最早用于构建组织工程肌腱的种子细胞;它来源于肌腱,构建出的组织在形态、结构和功能方面,与正常肌腱更加相似。但是由于取材面积较小分离得到的肌腱细胞数量有限,且作为终末分化细胞,肌腱细胞体外培养增殖相对缓慢,随着传代次数的增加,细胞表型逐渐消失,分泌细胞外基质能力下降,所以如何促进肌腱细胞增殖和维持其表型、功能,是肌腱组织工程的一个重要研究内容。目前,除了常用的添加生长因子(IGF-Ⅰ、BMPs、bFGF、PDGF等)、施加力学刺激或应用富含血小板的血浆(platelet rich plasma-clot release, PRCR)等方法外[1-3],低氧培养也越来越受到重视。目前的研究表明,低氧培养可以明显促进肌腱(干)细胞增殖[4-5〗,但对其促增殖的机制尚缺乏充分的认识。考虑到细胞增殖是一个涉及多基因、多水平调控的过程,因此,自2012年始,笔者研究采用表达谱芯片这一常用的高通量检测技术,对低氧培养的肌腱细胞进行检测分析。
1 材料与方法
1.1 实验动物与主要试剂
新生1周左右的小猪3只,购自上海市甲干实验动物中心。 DMEM培养液(美国HYCLONE公司);青霉素-链霉素溶液和胰蛋白酶(美国GIBCO公司);胶原酶(德国SERVA公司);胎牛血清(BioWest,BioSun); CO2培养箱(美国THERMO FORMA公司);低氧培养箱(德国BINDER公司)。
1.2 方法
1.2.1 肌腱细胞的分离和体外培养 无菌条件下取新生小猪后足趾深屈肌腱,修除腱周组织后将肌腱剪碎,置于0.2%胶原酶NB4中37 ℃振荡消化,接种于培养皿(此即原代P0),置于低氧培养箱(2%O2,实验组)或常规的CO2培养箱(21% O2,对照组)培养并传代;P1用于芯片分析和RT-PCR检测。
1.2.2 总RNA提取、纯化和芯片检测 所用芯片为NimbleGen猪表达谱芯片(美国ROCHE NIMBLEGEN公司),由北京博奥生物有限公司进行芯片检测,大致流程如下:Trizol提取细胞总RNA,逆转录成双链cDNA并进行纯化Cy3标记,与芯片42 ℃杂交过夜。NimbleGen MS 200 Microarray Scanner扫描获取荧光信号强度值,NimbleScan 2.6软件进行图像分析。芯片显著性分析(significance analysis of microarrays, SAM)R程序包进行差异表达基因的筛选。差异倍数>2,且q≤ 5%(q值表示该基因被判断为差异基因时的错误发现率,类似于P值。差异越显著,q值越小)的基因认为是差异表达基因。
1.2.3 RT-PCR验证 按总RNA提取试剂盒操作步骤,提取实验组和对照组P1的总RNA,逆转录成cDNA后,进行以下基因的扩增验证:IGF2(insulin-like growth factor 2)、IGFBP3(insulin-like growth factor binding protein 3)、TN-X(tenascin-X)、RERG(ras-like, estrogen-regulated, growth inhibitor)和β-actin(内参)。各基因引物序列、退火温度及产物大小见表1。
表1 RT-PCR引物序列、退火温度和产物大小
Tab1 RT-PCR primer sequences, annealing temperature and product size
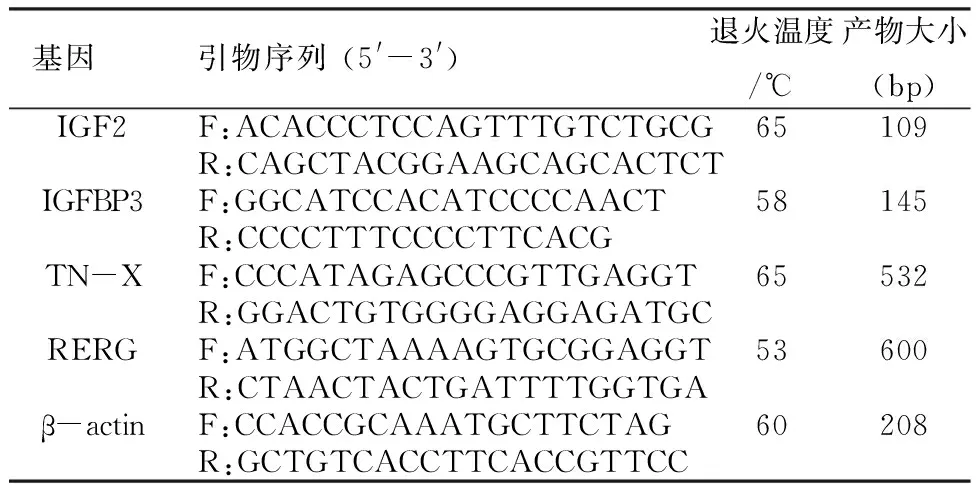
基因引物序列(5'-3')退火温度/℃产物大小(bp)IGF2F:ACACCCTCCAGTTTGTCTGCG65109R:CAGCTACGGAAGCAGCACTCTIGFBP3F:GGCATCCACATCCCCAACT58145R:CCCCTTTCCCCTTCACGTN-XF:CCCATAGAGCCCGTTGAGGT65532R:GGACTGTGGGGAGGAGATGCRERGF:ATGGCTAAAAGTGCGGAGGT53600R:CTAACTACTGATTTTGGTGAβ-actinF:CCACCGCAAATGCTTCTAG60208R:GCTGTCACCTTCACCGTTCC
注:F表示Forward(正向引物),R表示Reverse(反向引物)
2 结果
2.1 RNA抽提质量检测
6个样本的RNA A260/280为1.80~2.05;经甲醛变性胶电泳检测,RNA样品电泳条带清晰,28S∶18S rRNA条带亮度大于或接近2∶1。RNA纯度、总量及完整性均符合表达谱芯片实验要求。
2.2 芯片杂交质量判定
芯片杂交信号均一;Alignment Oligo的杂交信号值正常,表明杂交反应成功;STC结果表明,样品杂交过程不存在交叉污染。
2.3 差异表达基因
芯片检测结果显示,低氧条件下培养的P1与常规氧浓度组相比,有40个基因表达差异,且全部在低氧组表达上调(表2)。
2.4 RT-PCR验证
凝胶电泳结果显示,低氧组IGF-2、IGFBP-3、TN-X和RERG的表达,均不同程度地高于常规氧浓度组(图1),与基因芯片检测结果相符。
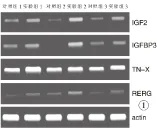
图1 RT-PCR检测IGF-2、IGFBP-3、TN-X和RERG的表达
Fig1 RT-PCR detection of the expression of IGF-2, IGFBP-3, TN-X and the RERG.
3 讨论
迅速扩增肌腱细胞并维持其表型,一直是肌腱组织工程研究的内容之一。考虑到肌腱是一种少血管的致密结缔组织,我们推测,其生理环境应该是低氧状态,因此,我们的前期研究使用了2%O2培养肌腱细胞,结果表明,低氧可以明显促进肌腱细胞增殖和维持其表型功能。近年来,越来越多的研究均使用低氧培养各种类型的细胞,多数研究结果显示,低氧可以促进细胞增殖[6],但关于促增殖的机制研究相对较少,且多为短期培养细胞(3~72 h)增殖的机制研究[7]。由于构建组织需要大量的种子细胞,所以培养时间至少要1周以上,因此,我们对培养时间至少1周的第1代肌腱细胞,进行了表达谱芯片的检测,以寻找较长时间低氧浓度促进肌腱细胞增殖的有关基因,以便为深入研究机制打下基础。
芯片检测结果显示,有40个基因表达发生改变,与其他研究结果相比,本研究检测到的差异表达基因数目较少。我们推测,其主要原因可能在于低氧持续时间的不同。如上所述,低氧培养细胞基因表达谱的研究,多为短期培养的细胞,处于低氧早期的细胞应该有大量的基因表达改变,以适应低氧环境。而随着低氧时间的延长,细胞已进入适应期,因此表达改变的基因数目会下降。此外,细胞类型和低氧浓度的不同,也可能是研究结果差异的原因。
生物信息学分析发现,40个差异表达基因中,部分基因与细胞增殖凋亡有关,我们选取的4个RT-PCR验证基因IGF-2、IGFBP-3、TN-X和RERG,也涉及影响细胞的增殖或凋亡。
IGFBP-3是IGFBPs蛋白家族的成员。它可以结合体内90%以上的IGF-1,也可以结合IGF-2,通过形成复合物而延长IGFs的半衰期。IGFs具有促进细胞增殖的作用,但IGFBP-3在不同的细胞微环境中,具有不同的功能,即促进细胞增殖或促进细胞凋亡;在同样的细胞内,也可以作为抑制因子或刺激因子发挥不同的作用[8]。本研究的芯片检测结果显示,IGF-1表达无明显改变,而低氧组IGF-2和IGFBP3表达上调。因此,该3种因子在低氧促进肌腱细胞增殖过程中的作用机制,需要深入研究。

表2 40个差异表达基因(低氧培养组表达上调)
注:根据差异倍数从大到小排序
Tenascin-X(TN-X)属于tenascin蛋白家族,除了TN-X以外,还有TN-C, TN-R和TN-W,均是细胞外基质成分。TN-X在肌腱、韧带和周围神经高表达。研究发现,TN-X与骨骼肌、心脏等多种组织发育有关,其缺失可导致胶原密度下降[9]。另外有研究结果显示,TN-X可以与VEGF结合并协同作用,促进血管内皮细胞增殖[10]。低氧可以促进血管生成,我们的芯片检测结果显示,低氧组TN-X表达上调,可能与促血管生成有关。但TN-X是否还与肌腱细胞增殖直接相关,尚需深入研究。
RERG是一个在乳腺癌中发现的基因,该基因与ras相关且受雌激素调节,主要起抑制细胞增殖和分化的作用。从RERG抑制细胞增殖的角度看,与本研究低氧组RERG表达上调而低氧又促进肌腱细胞增殖的结果相矛盾,因此,该基因在低氧促进肌腱细胞增殖过程中究竟有何作用,需要进一步研究。
综上所述,本研究通过表达谱芯片的检测和RT-PCR的验证发现,与常规氧浓度培养组相比,低氧条件下培养的肌腱细胞部分基因表达上调,其中一些基因和细胞增殖凋亡有关。
[1] Costa MA, Wu C, Pham BV, et al. Tissue engineering of flexor tendons: optimization of tenocyte proliferation using growth factor supplementation[J]. Tissue Eng, 2006,12(7):1937-1943.
[2] Yang G, Crawford RC, Wang JH. Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions[J]. J Biomech, 2004,37(10):1543-1550.
[3] Wang X, Qiu Y, Triffitt J, et al. Proliferation and differentiation of human tenocytes in response to platelet rich plasma: an in vitro and in vivo study [J]. J Orthop Res, 2012,30(6):982-990.
[4] Zhang Y, Wang B, Zhang WJ, et al. Enhanced proliferation capacity of porcine tenocytes in low O2tension culture[J]. Biotechnol Lett, 2010,32(2):181-187.
[5] Lee WY, Lui PP, Rui YF. Hypoxia-mediated efficient expansion of human tendon-derived stem cells in vitro[J]. Tissue Eng, 2012,18(5-6):484-498.
[6] Yoshida Y, Takahashi K, Okita K, et al. Hypoxia enhances the generation of induced pluripotent stem cells[J]. Cell Stem Cell, 2009,5(3):237.
[7] Zhu LL, Zhao T, huang X, et al. Gene expression profiles and metabolic changes in embryonic neural progenitor cells under low oxygen[J]. Cell Reprogram, 2011,13(2):113-120.
[8] Leibowitz BJ, Cohick WS. Endogenous IGFBP-3 is required for both growth factor-stimulated cell proliferation and cytokine-induced apoptosis in mammary epithelial cells[J]. J Cell Physiol, 2009,220(1):182-188.
[9] Voermans NC, Verrijp K, Eshuis L, et al. Mild muscular features in tenascin-X knockout mice, a model of Ehlers-danlos syndrome[J]. Connect Tissue Res, 2011,52(5):422-432.
[10] Ikuta T, Ariga H, Matsumoto K. Extracellular matrix tenascin-X in combination with vascular endothelial growth factor B enhances endothelial cell proliferation[J]. Genes Cells, 2000,5(11):913-927.
Effectofhypoxiaonthegeneexpressionprofilingoftenocytes
LIULi-li,YANGNing-ze,ZHANGYan-jie,etal.
(DepartmentofPlasticandReconstructiveSurgery,XinhuaHospital,DalianUniversity,Dalian116021,China)
ObjectiveTo investigate the effects of hypoxia on the gene expression profiling of tenocytes.MethodsTenocytes were isolated by enzymatic digestion and cultured in hypoxic (2%O2) or normoxic (21%O2) condition. Tenocytes gene expression profiling of Passage 1 were analyzed by cDNA microarray, and the selected four differentially expressed genes expressions were verified by RT-PCR.ResultsThere were 40 differences on gene expression between hypoxic and normoxic tenocytes, and all of which were up-regulated in hypoxic group. RT-PCR validation was consistent with microarray results.ConclusionMultiple genes were involved in tenocytes proliferation under hypoxia.
Hypoxia; Tenocytes; cDNA microarray; Gene expression profiling
国家自然科学基金资助项目(81101447)
116021 辽宁 大连,大连大学附属新华医院 整形外科(刘丽丽,杨柠泽,王志军);昆明医科大学基础医学院 细胞生物学与医学遗传学系(张延洁)
刘丽丽(1985-),女,黑龙江牡丹江人,硕士研究生.
王志军,116021,大连大学附属新华医院 整形外科,电子信箱:wzy618@tom.com
10.3969/j.issn.1673-7040.2014.08.018
R318
A
1673-7040(2014)08-0499-04
2014-04-21)
