铁氰化钴修饰电极测定对乙酰氨基酚
2014-10-28徐雯
徐 雯
铁氰化钴修饰电极测定对乙酰氨基酚
徐 雯
(黄山学院化学化工学院,安徽,黄山 245041)
利用循环伏安法通过电聚合在碳糊电极上制备了铁氰化钴薄膜,得到了铁氰化钴修饰碳糊电极,并研究了对乙酰氨基酚在铁氰化钴修饰电极上的电化学行为。结果表明,该修饰电极对对乙酰氨基酚显示出良好的电催化效果,不仅使氧化峰电位负移100 mV,而且峰电流明显增加。实验考察了底液与底液的pH、扫描速率等的影响。在优化的条件下,对乙酰氨基酚浓度在3.4×10-6~1.0×10-3mol/L范围内呈良好的线性关系;检测下限为1.6×10-6mol/L。该法可用于对乙酰氨基酚片中对乙酰氨基酚含量的测定,回收率为102.4%~103.0%,测定结果良好。
铁氰化钴;修饰电极;对乙酰氨基酚;电催化
对乙酰氨基酚(ACOP)是一种常见的乙酰苯胺类解热镇痛药,适用于感冒发烧、头痛、关节痛、神经痛、偏头痛以及手术后止痛等症[1]。其对人体有一定的毒副作用,过多服用会出现诸如恶心、呕吐、厌食、出汗、腹痛等症状,严重时还会抑制呼吸中枢甚至可致肝坏死[2],故其药用片剂含量应控制严格,因而准确测定对乙酰氨基酚的含量具有十分重要的意义。目前,ACOP的检测方法主要有分光光度法[3]、高效液相色谱法[4-5]、毛细管电泳法[6]、电化学方法[7-9]。在电化学方法中,多采用修饰电极进行研究,如高渐龙[10]等研究了ACOP在石墨烯和离子液体复合修饰电极上的电化学行为并对其进行测定,检出限为1×10-7mol/L,王正国[11]等制备了纳米金/十二烷基苯磺酸钠修饰玻碳电极,并用该电极测定ACOP,检出限为8×10-7mol/L,而用铁氰化钴(CoHCF)修饰电极测定ACOP未见报道。
本研究采用循环伏安法制备了铁氰化钴修饰电极,研究了ACOP在该修饰电极上的电化学行为,为样品中ACOP含量的测定提供了一个快速、可靠的方法。
1 实验部分
1.1 仪器与试剂
Lk2006电化学工作站(天津兰力科),AUY120型电子分析天平(日本岛津),pHS-3C(上海雷磁),KQ2200型超声波清洗器(昆山市超声仪器有限公司),JB-2型恒温磁力搅拌器(上海雷磁)。
对乙酰氨基酚(ACOP),用无水乙醇配成1×10-2mol/L储备液备用;对乙酰氨基酚片(汕头金石制药总厂,标示量为每片含对乙酰氨基酚0.5 g);磷酸二氢钾、磷酸氢二钠、六氰合铁(Ⅲ)酸钾、氯化钴、氯化钾、氯化钠均为分析纯,实验用水为二次去离子水。
1.2 样品的处理
准确称取200 mg研细的对乙酰氨基酚样品,用无水乙醇溶解,定容至100 mL容量瓶中。充分振摇后,静置一段时间,取一定量上层清液,再经适当稀释至实验中的pH后进行测定。
1.3 铁氰化钴修饰电极的制备
1.3.1 碳糊电极的制备
将石墨粉和粘合剂石蜡油按质量比为3:1的比例充分混匀至糊状,将该糊状物压入内径2 mm的玻璃管内,另一端与铜丝相连,紧密填实,使用前将电极在称量纸上打磨平滑。将打磨光滑后的电极在背景溶液中,在-1.2~1.0 V间以50 mV/S循环扫描一段时间至电极稳定,取出,用二次蒸馏水洗净备用。
1.3.2 铁氰化钴修饰电极的制作
将活化后的电极放入5.0×10-4mol/L K3Fe(CN)6+ 1.0×10-3mol/L CoCl2+ 0.05 mol/L KCl的聚合液中,在电化学分析系统上接通三电极,在-1.2~1.0 V 电位范围下,以50 mV/s 的扫速循环伏安扫描电化学聚合20 圈,即可制得铁氰化钴(CoHCF) 修饰电极。取出电极用二次蒸馏水洗净,待用。
1.4 实验方法
以铁氰化钴(CoHCF)修饰电极为工作电极,铂丝电极为辅助电极,饱和甘汞电极(SCE) 为参比电极。将电极浸入标准液或待测液中,用线性扫描伏安法研究对乙酰氨基酚的电化学行为。采用计时电流法进行定量测定,电位为0.7 V(vs. SCE)。
2 结果与讨论
2.1 CoHCF对ACOP的电催化作用
图1为CoHCF修饰电极在pH为7.0的磷酸缓冲溶液(曲线a)和1×10-4mol/L ACOP的磷酸盐缓冲溶液(曲线b)的循环伏安曲线,图2给出了裸电极(曲线a)和CoHCF修饰电极(曲线b)在1×10-4mol/L ACOP的磷酸盐缓冲溶液(pH = 7.0)的循环伏安曲线。从图中可以看出,CoHCF修饰电极自身在0.4~0.6 V范围内出现氧化还原峰,而ACOP在裸电极上只有一个不可逆的氧化峰,峰电位在0.65 V,在修饰电极上ACOP氧化峰的峰电位为0.55 V,负移100 mV,同时与裸电极相比,峰电流增大,说明CoHCF修饰电极对ACOP产生了催化作用。
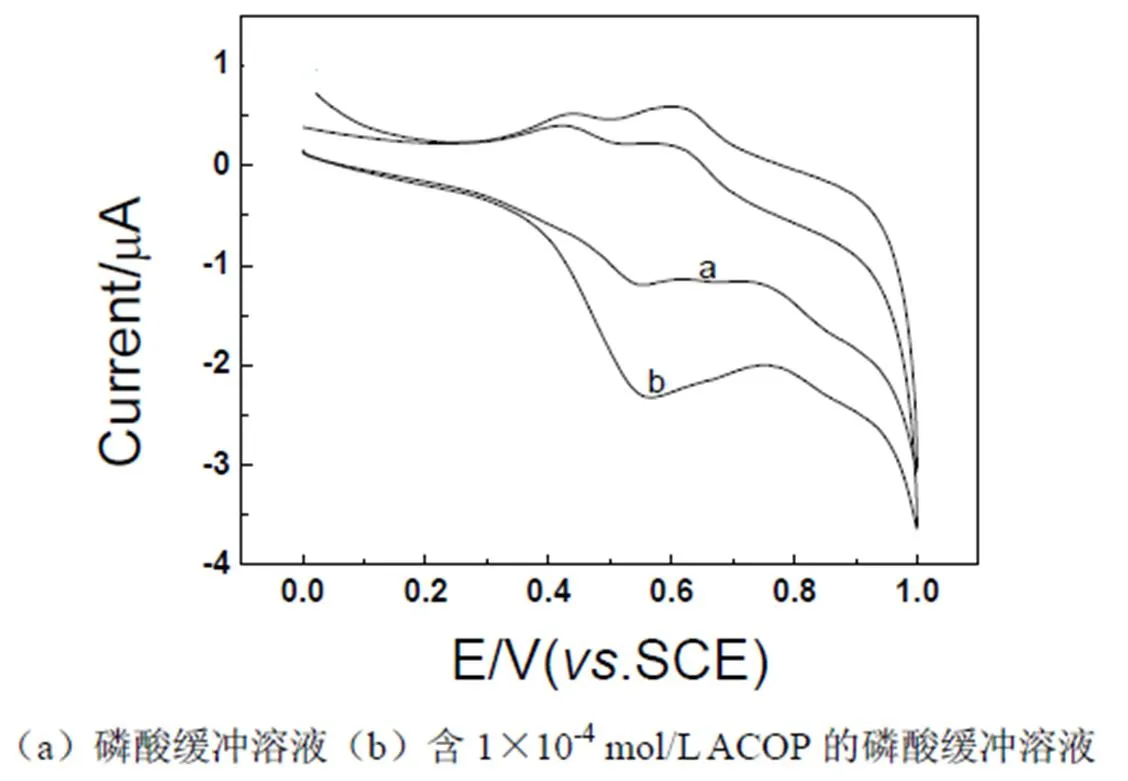
图1 CoHCF修饰电极在不同溶液中的循环伏安曲线

图2 ACOP在不同电极上的循环伏安曲线
2.2 底液及pH值的影响
ACOP在碱性条件下不稳定,所以选取Na2HPO4-KH2PO4、HAc-NaAc、NaCl以及KCl等溶液作为底液,研究ACOP的循环伏安行为,结果表明ACOP在磷酸缓冲溶液中峰形最好,峰电流最大。以磷酸盐缓冲溶液为底液,分别配制pH为4.0、4.6、5.1、6.0、7.0、7.5 的1.0×10-4mol/L ACOP溶液,考察pH值对ACOP测定的影响,如图3所示。由Ipa~pH的关系图可以得知,在pH为4.0~7.0范围内,峰电流随pH的增加而增大,但随着pH的继续增加,峰电流则会下降,故选择最佳pH值为7。

图3 ACOP在CoHCF修饰电极上氧化峰电流与pH值关系
2.3 扫描速率的影响
将修饰电极在1×10-4mol/L ACOP的磷酸缓冲溶液(pH = 7.0)进行循环伏安扫描,考察扫速为10、20、30、40、50、60、70、80、90、100、150 mV/s时的电化学行为。随着扫描速率的增加,ACOP的峰电流逐渐增大,而峰电位正移。以v1/2为横坐标对相对应的氧化峰电流值作图见图4。从图中可以看出,氧化峰电流与v1/2呈较好的线性关系,线性方程为: Ipa=-0.0692 + 0.2082 v1/2(R = 0.9923),说明ACOP在CoHCF修饰电极上的氧化反应过程是扩散控制的。

图4 ACOP在CoHCF修饰电极上的Ipa~v1/2图
2.4 ACOP在修饰电极上的线性范围、检出限及重复性
在优化实验条件下,每隔40 s添加一系列5 μL 0.6 mmol/L ACOP标准溶液到10 mL磷酸盐缓冲溶液(pH = 7.0)中,利用计时电流法对ACOP进行分析,得到电流—时间曲线(图5)。响应电流与其浓度在3.4×10-6~1.0×10-3mol/L范围内成线性关系,如图6所示,回归线性方程为Ip(μA)= 1.1147C(μmol/L) + 0.0191(R = 0.9978),检出限为1.6×10-6mol/L。用同一根修饰电极对1.0×10-4mol/LACOP溶液平行测定5次的相对标准偏差(RSD)为3.37%,说明该电极重复性较好。
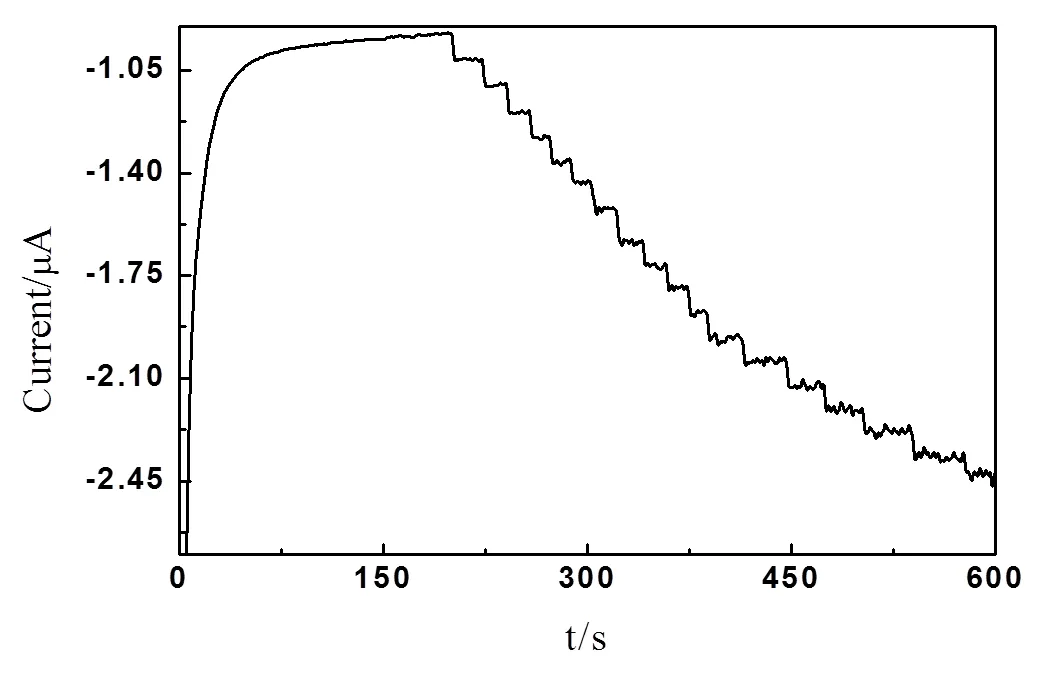
图5 ACOP的氧化峰电流—时间曲线

图6 ACOP的氧化峰电流与浓度关系
2.5 样品的测定及加标回收率实验
本实验测定的样品是对乙酰氨基酚片。其处理方法如1.2。在实验前,移取25 mL上层清液于50 mL容量瓶中,并用磷酸盐缓冲液(含KCl)稀释至刻度。实验时,采用CoHCF修饰碳糊电极,在0.70 V用计时电流法对样品溶液进行测定,向底液中加入100 μL稀释后的待测液,得到待测溶液的平均浓度为5.4×10-5mol/L,得到每片药片中ACOP的平均质量为0.473 g,为标示量的95.0 %。中国药典2005年版第二部要求,本品含ACOP应为标示量的95.0 %~105.0 %。由此可知,此药品符合药典规定要求。在测定的样品溶液中加入100 μL 1.0×10-2mol/L的ACOP溶液进行回收实验,分析结果见表1,ACOP的加标回收率为102.4%~103% ,说明该方法准确可靠。

表1 样品中ACOP含量的测定
3 结论
本研究采用了循环伏安法制备了铁氰化钴修饰电极,将制备出的修饰电极用循环伏安法研究了ACOP在该修饰电极上的电化学行为。该修饰电极对ACOP氧化显示出较好的电催化效果,不仅使峰电流增加,并且使ACOP的氧化峰电位负移100 mV。ACOP浓度在3.4 × 10-6~1.0 × 10-3mol/L范围内成呈良好的线性关系,检测下限为1.6 × 10-6mol/L。对1.0 × 10-4mol/L ACOP平行测定5次的相对标准偏差(RSD)为3.37%。该方法可用于对乙酰氨基酚片中ACOP含量的检测,取得较满意的结果。
[1] 陈新谦,金有像.新编药物学[M].14版.北京:人民卫生出版社,2000:154.
[2] 金慧萍,李中东,焦正.对乙酰氨基酚的不良反应与合理使用[J].药物不良反应杂志,2004, 6(1) : 27-31.
[3] 张金磊,李海龙.分光光度法测定药品中对乙酰氨基酚含量[J].广州化工,2012,40(18):89-91.
[4] 潘自红,胡小明,刘巧茹,等. 铁氰化钾反应体系分光光度法测定对乙酰氨基酚含量[J].理化检验(化学分册), 2012(8):985-986 ,988.
[5] 王巍,余翔,周祥敏.反相高效液相色谱法测定复方小儿退热栓中对乙酰氨基酚含量[J].中国药业,2012,21(20): 37-38.
[6] 朱晓燕,王增寿,陈帆,等. 高效毛细管电泳法测定泰诺林滴剂中对乙酰氨基酚的含量[J].中国现代应用药学, 2004,21(1) : 57-59.
[7] Song Jin-chun , Yang Ji , Zeng Jun-fen, et al. Graphite oxide film-modified electrode as an electrochemical sensor for acetaminophen[J]. Sensors and Actuators. B: Chemical, 2011, 155(1):220-225.
[8] Revanasiddappa Manjunatha, Dodahalli Hanumanthara- yudu Nagaraju, Gurukar Shivappa Suresh, et al. Electrochemical detection of acetaminophen on the functionalized MWCNTs modified electrode using layer-by-layer technique[J]. Electrochimica Acta, 2011,56 (19):6619-6627.
[9] 赵庆侠,马伟,孙登明.银掺杂聚L-苏氨酸修饰电极的制备及对多巴胺的测定[J].井冈山大学学报:自然科学版, 2011,32(6): 27-32.
[10] 高渐龙,何晓英,李明齐,等.对乙酰氨基酚在石墨烯和离子液体复合修饰电极上的电化学行为及其测定[J].分析科学学报,2012,28(5):677-680.
[11] 王正国,邓勤,郑韵英,等. 对乙酰氨基酚在纳米金/十二烷基苯磺酸钠修饰电极上的电化学行为研究[J].化学研究与应用,2012,24(2):175-180.
DETERMINATION OF ACETAMINOPHEN BY COBAL HEXACYANOFERRATE MODIFIED ELECTRODE
XU Wen
(College of Chemistry & Chemical Engineering, Huangshan University, Huangshan, Anhui, 245041, China)
A stableelectroactive thin film of cobalt hexacyanoferrate (CoHCF) was deposited on the surface of carbon paste electrode using cyclic voltammetry, and the electrochemical behavior of acetaminophen (ACOP) in the modified electrode was investigated. The modified electrode exhibited excellent electrocatalytic effect for acetaminophen with the negative oxidation peak shift of 100 mV and the markedly enhanced peak currents. The experimental parameters, such as the supporting electrolyte and pH of the supporting electrolyte, scan rate were optimized. The oxidation peak current is well proportional to the concentration of acetaminophen over the range of 3.4×10-6~1.0×10-3mol/L with the detection limit of 1.6×10-6mol/L. The established method could be applied in determining ACOP in acetaminophen tablet with the recovery of 102.4%~103.0%.
cobalt hexacyanoferrate; modified electrode; acetaminophen; electrocatalysis
O646.54
A
10.3969/j.issn.1674-8085.2014.06.007
1674-8085(2014)06-0033-04
2014-08-15;
2014-10-21
黄山学院校级教研项目(2010JXYJ03)
徐 雯(1978–),女,安徽休宁人,讲师,硕士,主要从事电化学研究(E-mail:xuwen1112@163.com).
