干燥方法对控制释放LGG的影响
2014-10-27张宇峰
李 冉,张宇峰
(天津工业大学中空纤维膜材料与膜过程省部共建国家重点实验室培育基地,天津 300387)
随着人们对生活质量和健康的日益重视,益生菌对人类疾病的预防和改善正在逐渐被人们所认识和接受.其中鼠李糖乳杆菌GG(LGG)是从健康的人类肠道中分离出来的一种革兰氏阳性菌,并且是首批被证实能够在人体肠道存活并定植的益生菌之一[1-3].LGG具有预防或改善腹泻、缓解不耐乳糖症状、预防生殖系统感染、增强机体防御功能、调节肠道消化系统健康、降低血清胆固醇、促进吸收营养成分、预防癌症和抑制肿瘤生长等作用[4].Yan等[5-6]证明LGG还可以预防和治疗细胞因子诱导的肠道上皮损伤、细胞凋亡、慢性和急性结肠炎.目前,国外已开发出大量的益生菌保健产品,如酸牛奶、口服液、片剂、胶囊、粉末剂、抑菌喷剂等,国内也将其应用在食品、医药保健和饲料等领域.但是要使益生菌得到进一步应用,仍面临一系列技术难题,即如何提高它的存活率,如何使其安然无恙地通过人类胃肠道到达结肠等.因此,目前亟待解决的问题就是探究一种可以携带益生菌、并可以提高益生菌存活率的载体,帮助其通过胃肠道到达结肠并释放.天然多糖果胶由于具有可以安全通过胃肠道并可被肠道微生物群降解等优点得到广泛关注[7-10],且微囊包封技术可以在很大程度上提高益生菌产品的耐储藏、耐加工性能,是目前国内外研究的热点.微囊包封益生菌主要应用物理屏障包裹活细胞,理想状态是微囊在所有的不利外部条件下保护益生菌不受伤害,如生产过程、储存和通过消化道等,并且本身不能对益生菌有伤害作用.目前应用于微囊技术的材料主要有海藻酸钠、玉米醇溶蛋白、壳聚糖等.其中玉米醇溶蛋白需用乙醇溶解[11],壳聚糖需用醋酸溶解[10],都不利于活细胞的生存,但果胶是一种完全无毒无害的天然食品添加剂和耐酸的乳凝剂,加入少量果胶就可改善口感和风味,显著提高食品质量.果胶对高血压等慢性病有一定治疗作用,并可降低血糖、血脂,减少胆固醇,解除铅中毒,还有防癌、抗癌等作用.果胶广泛存在于果皮中,尤其是柑橘类果皮,果皮是数量最多的废弃物之一,因此,如能变废为宝,充分利用果胶于食品中具有重要的研究意义[7].本文首次采用果胶钙交联微球包埋LGG,并考察了不同干燥方法对微球的释放性能和储藏存活率的影响.
1 实验部分
1.1 实验试剂与材料
柑橘果胶LC950,酯化度为32%,由Danisco USA Inc提供;卵磷脂,Zenobia Company提供;氯化钠,氢氧化钠,盐酸,氯化钾,磷酸二氢钾,磷酸氢二钠,氯化钙,均为分析纯,由Mallinckrodt Specialty Chemicals Co提供;牛磺胆酸钠,马来酸,由Sigma–Aldrich Chemical Co提供;鼠李糖乳酸杆菌GG(LGG),由American TypeCultureCollection53103提供;乳酸杆菌MRS琼脂,乳酸杆菌MRS肉汤,由Becton,Dickinson and Company提供.由Sigma-Aldrich Chemical Co提供的来自黑曲霉的果胶酶在使用前用0.45 μm的过滤器进行过滤.
1.2 制备包埋LGG的载体微球
将LGG放在乳酸杆菌MRS肉汤中,在37℃培养箱中培养16 h后,用胨水离心洗涤2次,然后用质量分数为0.9%氯化钠溶解稀释至含菌量远到109CFU/mL.
在室温下,采用Eppendorf公司的epMotion 5070仪器将含有一定浓度LGG和不同浓度葡萄糖的果胶(质量分数为3.0%)溶液滴入氯化钙(5%)溶液中并搅拌,微球迅速形成,搅拌反应15 min后用去离子水反复冲洗,直到洗液中不再含有氯化钙.将洗涤后的小球分为3组:第1组放入密封袋中保存;第2组放在室温下空气干燥;第3组先放入含有干冰的乙醇浴里预冻,再放入Labconco公司的FreeZone冻干机中冷冻干燥.
1.3 冷冻干燥
制得含有不同浓度的葡萄糖载体微球后,将其放在冻干机上冷冻干燥不同时间后,每组任意取10个小球称重,重复至少3组,再任意取10个小球放入含有果胶酶(63 FDU/mL)的磷酸盐缓冲溶液(PBS)中,用Interscience公司的拍打式匀浆器加快溶解小球从而释放LGG,然后按10倍递增稀释含有LGG的PBS溶剂直到所需稀释度.在乳酸杆菌MRS琼脂中进行平板培养,在37℃培养箱中培养48 h,然后用平板测数的方法计算经冷冻干燥后微球中所剩LGG的活菌数.
1.4 体外释放
将室温空气干燥和冷冻干燥的2组微球依次放入模拟人类胃肠道的溶剂中,溶剂组分和条件如表1所示.在37℃培养摇床(New Brunswick Scientific公司的innova TM4430)中培养,在模拟结肠环境的溶剂中加入果胶酶(63 FDU/mL)帮助溶解果胶释放LGG.在相应的时间,每一组随机取出5个微球,用Nikon公司的SMZ1500体视显微镜拍照,并用ImageJ2x软件计算出微球的横截面面积.

表1 模拟人类胃肠道的溶剂组分和条件Tab.1 Compositions and conditions of simulated human gastrointestinal solution
1.5 LGG在载体微球中的存活率
为了考察储存时间对载体微球中LGG活性的影响,将3组不同储存方式的微球保存在室温下不同时间后,每次取10个小球放入含有果胶酶(63 FDU/mL)的PBS溶液中,用拍打式匀浆器加快溶解小球从而释放LGG,然后按10倍递增稀释含有LGG的PBS溶剂直到所需稀释度,平板培养在乳酸杆菌MRS琼脂中,在37℃培养箱中培养48 h,然后用平板测数的方法计算经冷冻干燥后微球中所剩LGG的活菌数.
1.6 数据分析
采用SPSS17.0软件对数据进行双因素方差分析.
2 结果与讨论
2.1 冷冻干燥时间及微球含糖量对LGG存活率的影响
图1所示为LGG微球质量随冷冻干燥时间的变化情况.
由图1可见,冷冻干燥时间为0~4 h时,微球的质量呈直线下降,当冷冻干燥4 h后,微球的质量保持不变,此时可知,微球已经完全干燥.而且微球内含糖量对质量变化没有影响.

图1 LGG微球质量随冷冻干燥时间的变化Fig.1 Weight change of LGG and freeze dried time
图2所示为冷冻干燥时间及微球含糖量对LGG存活率的影响.
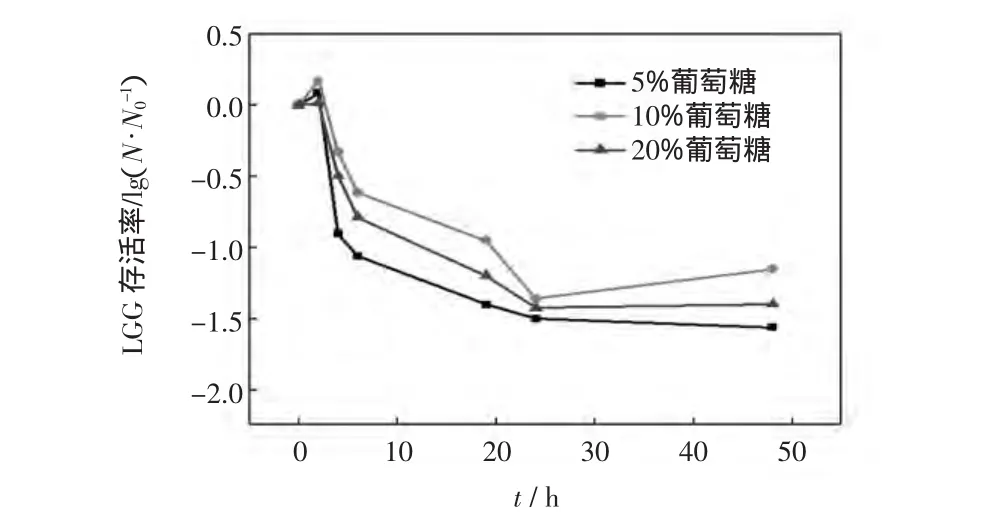
图2 冷冻干燥时间及微球含糖量对LGG存活率的影响Fig.2 Effect of freeze dry time and concentration of glucose on survivability of LGG in freeze dried pectin/Ca2+beads
由图2可见,在冷冻干燥2 h时,LGG量有所增加,此时可能由于微球还未完全干燥,LGG处于可以满足其生长的环境下,因此LGG量略有增加,当冷冻干燥2 h后,LGG存活率迅速下降,5~24 h趋于平缓,在24 h后,LGG的存活率达到平衡,这表明微球内LGG的量基本保持不变;另外,当冷冻干燥4 h,含糖质量分数为10%时,LGG的存活率显著高于含糖质量分数为5%和20%时(p<0.05).综合两者可知,当冷冻干燥时间为4 h,含糖质量分数为10%时,微球完全干燥,并且微球干燥后的含菌量达到最大值.
2.2 体外模拟释放过程中微球的形态变化
图3所示为体外释放过程中冷冻干燥和空气干燥的微球的形态变化.
由图3可见,干燥后的微球呈球型,其中空气干燥后的微球表面光滑并且没有可见的裂痕或瑕疵,而冷冻干燥后的微球表面有孔洞,这可能是由于在果胶和氯化钙交联形成网状结构的过程中,果胶也会与水分子形成氢键,在冷冻干燥时,结合水的氢键断裂导致微球形成孔洞.微球经过胃肠模拟溶液后仍保持完整,无可见裂痕,这表明果胶钙微球不会在胃肠上部降解.当微球进入结肠模拟溶剂初期,微球变小但仍保持完整,此时可能已经释放少量LGG,7 h后,微球碎裂呈小块,这表明果胶钙微球可以被降解并释放LGG.

图3 体外模拟释放过程中冷冻干燥和空气干燥的微球的形态变化Fig.3 Morphological change of air dried(left)or freeze dried(right)pectin/Ca2+beads in vitro release process
2.3 体外模拟释放过程中微球的溶胀度
体外模拟释放过程中冷冻干燥和空气干燥微球的横截面积变化如图4所示.

图4 体外模拟释放过程中冷冻干燥和空气干燥微球的横截面积变化Fig.4 Area change of freeze dried or air dried pectin/Ca2+beads in vitro release process
由图4可见,空气干燥后的微球体积小于冷冻干燥后的微球.在胃部和小肠模拟溶剂中,2种干燥方法干燥后的果胶钙微球的横截面积增长缓慢,当微球到达结肠模拟溶剂后,横截面积显著增大.由于微球的横截面积和溶胀度呈正比,因此微球在结肠模拟溶剂中的溶胀度显著增加,其中冷冻干燥微球的溶胀度小于空气干燥微球.微球体积逐渐增大,可能导致微球胀破从而释放LGG.
2.4 体外模拟释放过程中微球的释放性能
当结肠模拟溶剂中加入果胶酶后,微球的横截面积变化如图5所示.

图5 体外模拟释放过程中冷冻干燥和空气干燥微球的释放性能Fig.5 Release properties of freeze dried or air dried pectin/Ca2+beads in vitro release process
由图5可见,2种干燥方法干燥后的果胶钙微球都可以被快速降解.这表明人类食用果胶钙微球后,体内肠道中的微生物可以降解果胶钙微球释放LGG.
2.5 LGG在载体微球中的存活率
干燥过程中水分的丧失不可避免地会造成部分菌体细胞的损伤甚至死亡,但冷冻干燥过程仍使微生物细胞内的酶保有活性,且微球的骨架结构保持不变,具有多孔结构.为了提高微生物真空冷冻干燥后细胞的存活率,常在冷冻干燥时加入各种保护剂,这些保护剂在复水过程中可以作为支持物和受体,并且保护活细胞.本实验采用添加葡萄糖作为真空冷冻干燥保护剂,它在冷冻干燥过程中保留少量水分使微生物适应超低温、干燥、低pH等能抑制或致死微生物的不良环境,LGG在载体微球中的存活率如图6所示.

图6 LGG在载体微球中的存活率Fig.6 Survivability of LGG in pectin/Ca2+beads
由图6可见,经过6 d的常温贮藏,未干燥和空气干燥的微球中LGG含量大概降低3个数量级,而冷冻干燥需14 d左右才降低相同的量.这表明冷冻干燥法是长期保存含有LGG微球的较好方法.
3 结论
(1)冷冻干燥最佳条件为:冷冻干燥时间4 h,微球含糖质量分数为10%.此时,微球基本完全干燥,且干燥后微球内含菌量达到最大值.
(2)体外模拟释放结果表明果胶钙微球在胃肠上部未降解,在结肠被降解并释放LGG.
(3)本实验采用的2种干燥方法和未干燥方法相比,冷冻干燥法是长期保存含有LGG微球的最好方法.
[1]YAN F,POLK D B.Probiotics:Progress toward novel therapies for intestinal diseases[J].Curr Opin Gastroenterol,2010,26(2):95-101.
[2]YAN F,POLK D B.Probiotics as functional food in the treatment of diarrhea[J].Curr Opin Clin Nutr Metab Care,2006,9(6):717-721.
[3]钱程,霍贵成,马微.鼠李糖乳杆菌(LGG)的功能特性及其应用前景[J].食品科技,2005,30(9):94-98.
[4]宋士良.益生菌在食品中应用状况及安全性评估[J].食品科技,2009,34(7):22-26.
[5]YAN F,POLK D B.Probiotic bacterium prevents cytokine-induced apoptosis in intestinal epithelial cells[J].J Biol Chem,2002,277(52):50959-50965.
[6]YAN F,CAO H,COVER T L,et al.Colon-specific delivery of a probiotic-derived soluble protein ameliorates intestinal inflammation in mice through an EGFR-dependent mechanism[J].J Clin Invest,2011,121:2242-2253.
[7]LIU L S,FISHMAN M L,KOST J,et al.Pectin-based systems for colon-specific drug delivery via oral route[J].Biomaterials,2003,24(19):3333-3343.
[8]LIU L S,FISHMAN M L,HICKS K B,et al.Interaction of various pectin formulations with porcine colonic tissues[J].Biomaterials,2005,26:5907-5916.
[9]LIU L S,CHEN G,FISHMAN M L,et al.Pectin gel vehicles for controlled fragrance delivery[J].Drug Delivery,2005,12:149-157.
[10]SINHA V R,KUMIRA R.Polysaccharides in colon-specific drug delivery[J].Int J Pharm,2001,224:19-38.
[11]LIU L S,KENDE M,RUTHEL G,et al.Pectin/Zein beads for potential colon-specific drug delivery:synthesis and in vitro evaluation[J].Drug Delivery,2006,13(6):417-423.
