多不饱和脂肪酸合成途径研究进展
2014-10-26廖灵旋黄建忠
廖灵旋,于 昊,黄建忠
(福建师范大学工业微生物教育部工程研究中心生命科学学院福建省现代发酵技术工程研究中心,福建 福州 350108)
多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)是指含有2个或者2个以上双键的长链脂肪酸,碳原子数目一般为18~22个。主要包括α-亚麻酸(ALA)、二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)、亚油酸(LA)、二高-γ-亚麻酸(DHGLA)、花生四烯酸(ARA)等[1-2]。其中,根据距离甲基端第1个双键位置不同可以将多不饱和脂肪酸分为 ω-3、ω-6、ω-7、ω-9 等系列(也可以用n表示)[3]。主要的多不饱和脂肪酸如表1所示,这些多不饱和脂肪酸对于维持和调节人类健康起着至关重要的作用,是人类必需的脂肪酸(EFA)[4]。本文主要对多不饱和脂肪酸的微生物来源、作用机理、生物合成及新发现的聚酮合酶途径等方面做一简述。
1 多不饱和脂肪酸的微生物来源
多不饱和脂肪酸对于维护人体健康是非常重要的,但由于哺乳动物缺少合成长链PUFAs关键酶基因,因此,只能通过外在的饮食来获取。目前,在饮食方面PUFAs主要来自海洋鱼类和植物种子油。由于市场对PUFAs的需求,从各种微生物中寻找PUFAs的来源成为研究热点,主要的微生物有细菌、真菌、和藻类。
经过研究发现,真菌和藻类产不饱和脂肪酸明显高于细菌。对于真菌,产不饱和脂肪酸主要有高山被孢霉、长被孢霉、水霉、轮枝霉、樟疫霉、毛霉、小克银汉霉等[5-6]。在海洋鱼类中虽然有多不饱和脂肪酸,但其真正来源是食物,而非自产,海洋中的微生物才是多不饱和脂肪酸真正的生产者[7]。目前已经从海洋中分离到一些富含DHA和EPA的微生物,其中,藻类中的金藻纲、黄藻纲、绿藻纲和隐藻纲富含EPA,而DHA主要集中在甲藻、金藻和硅藻中。现在用于商业生产DHA的海洋微生物主要是裂殖壶菌[8-9]和隐甲藻[10]。

表1 主要的多不饱和脂肪酸Table 1 Typical PUFAs
2 多不饱和脂肪酸的作用机理
多不饱和脂肪酸是人类必不可少的营养物质,必须通过食物获得。对这些多不饱和脂肪酸的深入研究发现,它们具有很多重要的生理功能,如降低心血管疾病风险、提高免疫、抗癌等。因其对人体健康的有利影响,从而引起人们很大的关注[11-12]。
2.1 细胞膜的组成部分
多不饱和脂肪酸是大多数真核生物细胞膜磷脂的关键组成成分,在细胞表面信号传递上起到至关重要的作用[13]。其中,ω-3多不饱和脂肪酸中的DHA在大脑和视网膜组织的细胞膜上含量非常丰富。在大脑的组织细胞中,DHA的含量可达到细胞总脂的10%;在视网膜的细胞中,DHA的含量可达到细胞总脂的60%以上[14]。所以,多不饱和脂肪酸对于人体脑神经及视觉有重要作用。
2.2 影响细胞膜流动性
细胞膜的流动性是由于构成膜之间的磷脂双分子和蛋白质分子不断处于横向或纵向的运动状态。对于细胞代谢来说,有着非常重要的作用,如物质运输、细胞识别、细胞分化、细胞融合与信号转导等都与细胞膜的流动性有密切关系。研究发现,多不饱和脂肪酸对细胞膜流动性的影响,是由于其插入膜脂质双分子层中,最终来影响膜的结构[15]。
在一些研究过程中,发现用多不饱和脂肪酸(DHA、EPA)来培养Caco-2细胞,能够增加膜的流动性,并呈剂量反应,是由于显著地改变了细胞膜磷脂构成,从而提高了细胞膜的流动性[16]。另外,在对乳腺癌细胞膜研究中,发现多不饱和脂肪酸的不同构成比例对其也有影响[17],这也是由于相关膜蛋白活性跟膜功能受到影响而导致的[18-19]。
2.3 调节膜离子通道
早在20世纪80年代,人们发现格陵兰爱斯基摩人由于食用富含多不饱和脂肪酸的鱼类食物,患心血管疾病的人较少[20-21],从而使多不饱和脂肪酸受到高度重视。经过众多的研究发现,多不饱和脂肪酸是通过调节膜上离子通道来降低心律失常。研究显示,不饱和脂肪酸能够抑制心肌细胞膜上的钠离子通道,通过抑制钠离子电流,使动作电位缩短,减少异常兴奋的产生,降低心率[22]。另外,多不饱和脂肪酸还能够稳定细胞膜上钙离子通道,通过阻断电压门控钙离子流,从而使钙离子浓度降低[23]。
2.4 免疫调节作用
多不饱和脂肪酸对于人体的免疫细胞也具有调节作用,由于多不饱和脂肪酸不仅是人体必需的脂肪酸,也是细胞膜成分磷脂的组成部分。多不饱和脂肪酸的摄入,可以明显改变免疫细胞T淋巴细胞、B淋巴细胞、K淋巴细胞和NK淋巴细胞的细胞膜组成,从而影响这些细胞受体的空间构象、功能以及与外在因子的结合能力,最终起到对细胞免疫作用的影响[24]。一些研究表明,通过给小鼠饲喂适量多不饱和脂肪酸DHA、EPA,可以改变第二信使的产生,从而影响淋巴细胞的功能,明显抑制了T细胞分泌IL-2[25-26]。
2.5 影响基因表达
多不饱和脂肪酸除了是人体必需的营养物质,还对机体的某些基因起着调控作用。近年来经过研究表明[27],多不饱和脂肪酸参与一些基因的表达调控主要是通过与核受体和转录因子结合来发挥其功能,特别是对脂肪代谢中酶和蛋白基因的调控[28]。研究中还发现,不同种类的脂肪酸对这些代谢基因都具有调节作用[29-30],其中以多不饱和脂肪酸最为显著[31]。
3 微生物产多不饱和脂肪酸的生物合成途径
在真核微生物如真菌和藻类中,已知的多数多不饱和脂肪酸是通过脂肪酸延长酶和去饱和酶在线粒体或者内质网上经过一系列反应而获得的[32-33]。在生物体内形成多不饱和脂肪酸是一个复杂的过程,它是以饱和脂肪酸硬脂酸(18∶0)为底物,通过脂肪酸延长酶与去饱和酶作用完成的。其中碳链的延长与去饱和作用是交替进行的,最终经过一系列的脱氢和碳链延长而形成。如,已知DHA的生物合成是从乙酰辅酶A和丙二酸单酰辅酶A开始经过缩合、还原、脱水、还原等,接近30个不同的酶反应和70个包括4个重复的脂肪酸循环反应最终形成。其中在合成途径中,去饱和酶是关键酶,它控制着不饱和脂肪酸的不饱和程度,合成途径如图1所示[34]。

图1 多不饱和脂肪酸在生物体的合成途径Fig.1 biosynthetic pathway of PUFAs
然而,近几年的研究发现,在某些深海中的一些海洋微生物不需要通过脂肪酸延长酶和脂肪酸去饱和酶来形成PUFAs,其合成PUFAs的途径是通过聚酮合酶(polyketide synthase,PKS)来催化的,这一条新颖代谢途径的发现,为转基因生产新的不饱和脂肪酸提供了希望[35]。近年来,一些研究小组在海洋中发现一些富含不饱和长链DHA和EPA的微生物,如产DHA的海产弧菌(Vibrio marinus MP-1)、产 EPA的希瓦氏菌(Shewanella sp.)等[36]。最早报道能产 PUFAs的是腐败希瓦氏菌(Shewanella putrefaciens SCRC2378),通过构建该菌株的基因组文库,研究设计从中获得1段38 kb DNA,对其所包含的序列进行分析,发现有5个开放阅读框 (Open reading frame,ORF)与脂肪酸合成酶具有同源性[37]。对这些ORF进行序列比对分析并导入大肠埃希菌进行异源表达,在不依赖大肠脂肪酸合酶 (Fatty acid synthase,FAS)和任何长链中间物质的情况下,发现能够获得二十二碳五烯酸 (22∶5)从而也证实了这5个ORF能够完全独立的催化形成PUFAs。另外,通过构建pEPA质粒,将其转化到不具合成多不饱和脂肪酸能力的大肠埃希菌中,在厌氧条件下培养发现仍能合成EPA,说明该EPA的合成与之前的合成途径不同,不涉及有氧脱氢机制。此外,在陆续发现的一些产多不饱和脂肪酸的海洋细菌中,也有与产EPA类似的基因簇,所以通过这些研究可以表明这些海洋细菌合成多不饱和脂肪酸不涉及脂肪酸的脱氢和延长,而是由聚酮合酶来催化产生的。

图2 假设希瓦氏菌聚酮合酶合成多不饱和脂肪酸代谢途径Fig.2 Hypothetical pathway for PUFAs synthesis by the Shewanella polyketide synthase
虽然确切的催化机制尚未阐明,但 Jim Metz[35]等经过对基因簇的比对分析,提出了PUFA在腐败希瓦氏菌的合成途径,如图2所示[38]。它是在PKS合成酶的作用下,以乙酰辅酶A和丙二酸单酰辅酶A为底物,经过缩合、还原、脱水、还原/异构化循环反应,最终形成多不饱和脂肪酸。在这个合成途径中,PKS合成酶与脂肪酸合酶执行了一些相同的反应,用了相同的小蛋白,酰基载体蛋白(ACP)[39],作为一个共价结合位点延长碳链。不同的是PKS途径过程不像传统的途径需要氧去饱和引入双键,因为在PKS合成酶中存在脱水酶和异构酶,可以直接形成双键,因此也称为厌氧聚酮合酶途径。对于聚酮合酶合成不饱和脂肪酸,尽管确切的生物合成机制还有待进一步阐明,但其关键步骤主要有缩合和异构化。其中,参与反应的酶有3-酮基合成酶、3-酮脂酰还原酶、烯醇还原酶、脱水酶及异构酶等,在合成途径中酮基合成酶起着关键酶的作用,催化很多底物的缩合反应。
4 聚酮合酶合成不饱和脂肪酸中的关键基因及功能
4.1 PKS途径中关键基因的克隆
1996 年,Yazawa[37]从海洋细菌腐败希瓦氏菌(S.putrefaciens SCRC2378)中克隆到合成EPA的基因簇,片段大小为38 kb,将该目的片段导入大肠埃希菌中做异源表达[40],在发酵液中能够检测到EPA。因此,对克隆到的基因簇进行分析发现其共包含了8个ORF,但其中合成EPA所必需的只有5个 ORF,总长约 20 kb,分别被命名为pfaA、pfaB、pfaC、pfaD 和 pfaE[41]。另外,通过进一步研究发现,这5个DRF共包含11个酶,其中8个与PKS基因相关,另外3个与细菌脂肪酸合成酶蛋白具有同源性[35]。
1999年,Tanaka等在 DHA生产菌株 V.strain MP-1克隆到一段40 kb的目的片段,包括pfaA、pfaB、pfaC、pfaD。发现这 4 个 ORF 与 EPA生物合成基因簇有很高的同源性[42-43]。另外,Gentile等在1株嗜冷菌希瓦氏菌(Shewanella sp.GA-22)中发现能够产亚油酸、花生四烯酸和EPA三种不同的多不饱和脂肪酸,通过设计简并性引物,只克隆到2个片段pfaA和pfaC[36],并没有克隆到已报道的5个pfa,可能是由于其他3个基因与已经报道的基因同源性不高而致。
4.2 PKS途径中关键基因的功能
近来,越来越多的海洋微生物基因组被测序,通过研究发现能够产多不饱和脂肪酸的细菌都含有类似pfa基因序列,可以确定PKS途径形成多不饱和脂肪酸是由于pfa基因簇作用而产生的。对已经克隆报道过的pfa基因簇进行序列比对,发现有8个结构域跟PKS相关。而另外3个与细菌FAS蛋白同源,其中1个同肺炎双球菌烯醇还原酶(ER)同源,2个与大肠埃希菌中编码反式-癸烯酰-ACP 和其异构化顺式-3-癸烯酰-ACP[44]合成的FabA 脱水酶(DH)同源,如表2 所示[35]。
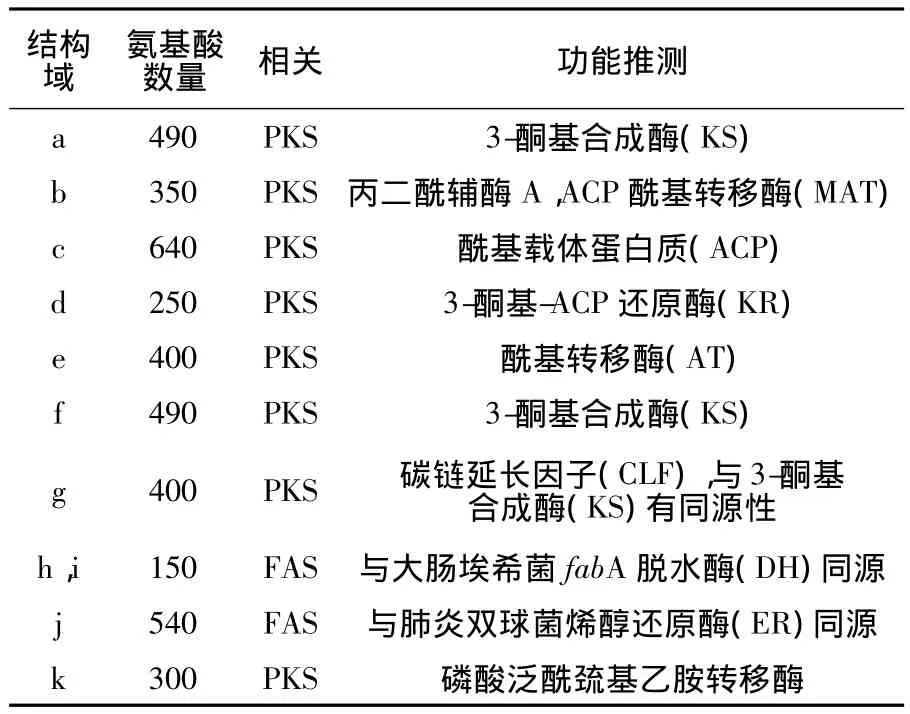
表2 pfa基因序列功能推测Table 2 The sequence of pfa gene function prediction
通过对聚酮合酶合成多不饱和脂肪酸中关键基因的克隆,发现这些产PUFAs的海洋细菌都含有类似pfa基因序列,且具有不同的排列方式,大致可分为3种类型,第1种是菌中含有完整的pfaA、pfaB、pfaC、pfaD 和 pfaE 五个关键基因,并且这些基因在同一个基因簇上;第2种,也含有完整的pfa基因序列,但是其中的pfaE基因与其他基因不在同一基因簇上;第3种,只包含pfaA、pfaB、pfaC、pfaD四个基因,pfaE基因则被整合到pfaC中。虽然这3种排列方式大致相同,但某些结构域仍有不同之处,执行不同的功能,最终导致生成不同的多不饱和脂肪酸。此外,对这些新基因的克隆及功能分析推测有利于科学家对聚酮合酶合成多不饱和脂肪酸路线有一个清晰的了解,对今后生物改造海洋细菌来解决PUFAs供应问题具有深远的意义。
5 小结和展望
近年来随着一些研究机构对PUFAs的深入研究,发现其具有预防心血管疾病、高血压及抗癌作用,导致市场上对于PUFAs的需求大幅度增加,因此需要不断提高PUFAs的产量及质量来满足需求。对海洋微生物聚酮合酶合成多不饱和脂肪酸的研究,有利于从海洋微生物中生产获得PUFAs,以此来解决市场需求问题。目前,主要通过研究培养条件和发酵条件的优化以及高产菌株的选育来提高PUFAs的产量,但效果并不明显。因此,研究通过其他途径提高PUFAs的产量有重要的理论意义。随着研究的不断深入,通过基因工程手段生产PUFAs成为可能,且具有潜在的重要商业价值。目前发现的这些产多不饱和脂肪酸的菌大多来自深海,生存温度很低,不适合工业化生产。因此,构建适合工业应用的基因工程菌株生产PUFAs成为研发的热点[45-46],这需要对生物合成基因簇的克隆,研究PUFAs途径中的关键酶基因,在分子水平上进行调控和表达,从而实现不饱和脂肪酸的高表达。目前对于新发现的聚酮合酶合成多不饱和脂肪酸这一新颖途径的具体分子合成机制和调控机制还没有完全阐明,有待于以后的深入研究。
[1]李殿鑫,陈银基,周光宏,等.n-3多不饱和脂肪酸分类、来源与疾病防治功能[J].中国食物与营养,2006,6:52-54.
[2]张艳荣,单玉玲,李玉.姬松茸ω-6多不饱和脂肪酸对高血脂鼠的降血脂作用[J].吉林大学学报(医学版),2006,32(6):960-963.
[3]马立红,王晓梅.多不饱和脂肪酸药理作用研究[J].吉林中医药,2006,26(12):69-70.
[4]Bergé J-P,Barnathan G .Fatty acids from lipids of marine organisms:molecular biodiversity,roles as biomarkers,biologically active compounds,and economical aspects[J].In Marine biotechnology I,2005,96:49-125.
[5]戴传超,袁生,窦洁,等.单细胞油──一类有待开发的微生物产品[J].生物技术,1995,5(6):44-46.
[6]戴传超,袁生,刘吉华,等.产二十二碳六烯酸等多不饱和脂肪酸真菌的筛选[J].菌物系统,2000,19(2):261-267.
[7]Ackman RG,Jangaard P,Hoyle R,et al.Origin of marine fatty acids.I.Analyses of the fatty acids produced by the diatom Skeletonema costatum[J].Journal of the Fisheries Board of Canada,1964,21(4):747-756.
[8]Fan K,Chen F,Jones EB,et al.Eicosapentaenoic and docosahexaenoic acids production by and okara-utilizing potential of thraustochytrids[J].Journal of Industrial Microbiology and Biotechnology,2001,27(4):199-202.
[9]Wu S-T,Yu S-T,Lin L-P.Effect of culture conditions on docosahexaenoic acid production by Schizochytrium sp.S31[J].Process Biochemistry,2005,40(9):3103-3108.
[10]Mendes A,Reis A,Vasconcelos R,et al.Crypthecodinium cohnii with emphasis on DHA production:a review[J].Journal of Applied Phycology,2009,21(2):199-214.
[11]Patterson E,Wall R,Fitzgerald G,et al.Health implications of high dietary omega-6 polyunsaturated fatty acids[J].Journal of nutrition and metabolism,2012,2012.
[12]Dewey A,Baughan C,Dean T,et al.Eicosapentaenoic acid(EPA,an omega-3 fatty acid from fish oils)for the treatment of cancer cachexia[J].Cochrane database of systematic reviews,2007,(1):CD004597.
[13]Lauritzen L,Hansen HS,J rgensen M,et al.The essentiality of long chain n-3 fatty acids in relation to development and function of the brain and retina[J].Progress in lipid research,2001,40(1-2):1-94.
[14]Giusto N,Pasquare S,Salvador G,et al.Lipid metabolism in vertebrate retinal rod outer segments[J].Progress in lipid research,2000,39(4):315-391.
[15]李喜艳,王加启,卜登攀,等.多不饱和脂肪酸对细胞膜功能影响的研究进展[J].生物技术通报,2009,12:22-26.
[16]Nano J-L,Nobili C,Girard-Pipau F,et al.Effects of fatty acids on the growth of Caco-2 cells[J].Prostaglandins,leukotrienes and essential fatty acids,2003,69(4):207-215.
[17]邱小文,韦娜,蒋薇,等.Effects of different ratios of n-6/n-3 polyunsaturated fatty acid on membrane lipid composition and membrane function in human breast cancer cell lines[J].实用医学杂志,2012,28(15):2493-2495.
[18]Wassall SR,Stillwell W.Docosahexaenoic acid domains:the ultimate non-raft membrane domain[J].Chemistry and physics of lipids,2008,153(1):57-63.
[19]Chapkin RS,Wang N,Fan Y-Y,et al.Docosahexaenoic acid alters the size and distribution of cell surface microdomains[J].Biochimica et Biophysica Acta(BBA)-Biomembranes,2008,1778(2):466-471.
[20]Torrejon C,Jung U,Deckelbaum R.n-3 Fatty acids and cardiovascular disease:actions and molecular mechanisms[J].Prostaglandins,Leukotrienes and Essential Fatty Acids,2007,77(5):319-326.
[21]Dyerberg J,Bang H .Observations on populations in Greeland and Denmark,in nutritional evaluation of long-chain fatty acids,1981,New York:Academic Press.
[22]Den Ruijter HM,Berecki G,Opthof T,et al.Pro-and antiarrhythmic properties of a diet rich in fish oil[J].Cardiovascular research,2007,73(2):316-325.
[23]Liu JC,Conklin SM,Manuck SB,et al.Long-chain omega-3 fatty acids and blood pressure[J].American journal of hypertension,2011,24(10):1121-1126.
[24]吴晓霞,徐亮,綦晓龙.ω-3多不饱和脂肪酸的免疫调节功能研究进展[J].现代诊断与治疗,2009,20(4):227-230.
[25]Merzouk SA,Saker M,Reguig KB,et al.N-3 polyunsaturated fatty acids modulate in-vitro T cell function in type I diabetic patients[J].Lipids,2008,43(6):485-497.
[26]Jolly CA,Jiang Y-H,Chapkin RS,et al.Dietary(n-3)polyunsaturated fatty acids suppress murine lymphoproliferation,interleukin-2 secretion,and the formation of diacylglycerol and ceramide[J].The Journal of nutrition,1997,127(1):37-43.
[27]Di Nunzio M,Danesi F,Bordoni A.n-3 PUFA as regulators of cardiac gene transcription:a new link between PPAR activation and fatty acid composition[J].Lipids,2009,44(12):1073-1079.
[28]王红,石宝明.多不饱和脂肪酸对脂肪代谢酶基因表达的影响[J].中国饲料,2011,(1):5-8.
[29]Yang Z-H,Miyahara H,Takemura S,et al.Dietary saury oil reduces hyperglycemia and hyperlipidemia in diabetic KKAy mice and in diet-induced obese C57BL/6J mice by altering gene expression[J].Lipids,2011,46(5):425-434.
[30]Hiller B,Herdmann A,Nuernberg K.Dietary n-3 fatty acids significantly suppress lipogenesis in bovine muscle and adipose tissue:A functional genomics approach[J].Lipids,2011,46(7):557-567.
[31]时皎皎,糜漫天,韦娜,等.不同膳食脂肪酸构成对大鼠肝脏脂代谢相关基因表达的影响[J].重庆医学,2012,41(13):1252-1254.
[32]Aguilar PS,De Mendoza D.Control of fatty acid desaturation:a mechanism conserved from bacteria to humans[J].Molecular microbiology,2006,62(6):1507-1514.
[33]江贤章,秦丽娜,田宝玉,等.海洋破囊壶菌 Thraustochytrium sp.FJN-10 DHA 生物合成[J].微生物学报,2008,48(2):176-183.
[34]Napier JA.Plumbing the depths of PUFA biosynthesis:a novel polyketide synthase-like pathway from marine organisms[J].Trends in plant science,2002,7(2):51-54.
[35]Metz JG,Roessler P,Facciotti D,et al.Production of polyunsaturated fatty acids by polyketide synthases in both prokaryotes and eukaryotes[J].Science,2001,293(5528):290-293.
[36]Gentile G,Bonasera V,Amico C,et al.Shewanella sp.GA-22,a psychrophilic hydrocarbonoclastic antarctic bacterium producing polyunsaturated fatty acids[J].Journal of applied microbiology,2003,95(5):1124-1133.
[37]Yazawa K.Production of eicosapentaenoic acid from marine bacteria[J].Lipids,1996,31(1):S297-S300.
[38]Wallis JG,Watts JL.Polyunsaturated fatty acid synthesis:what will they think of next?[J]Trends in Biochemical Sciences,2002,27(9):467-473.
[39]李志平,江贤章,田宝玉,等.裂殖壶菌酰基载体蛋白(ACP)基因的克隆与表达[J].微生物学通报,2008,35(2):256-260.
[40]Yu R,Yamada A,Watanabe K,et al.Production of eicosapentaenoic acid by a recombinant marine cyanobacterium,Synechococcus sp.[J].Lipids,2000,35(10):1061-1064.
[41]Elrazak AA,Ward AC,Glassey J.Polyunsaturated fatty acid production by marine bacteria[J].Bioprocess and biosystems engineering,2013:1-12.
[42]Tanaka M,Ueno A,Kawasaki K,et al.Isolation of clustered genes that are notably homologous to the eicosapentaenoic acid biosynthesis gene cluster from the docosahexaenoic acid-producing bacterium Vibrio marinus strain MP-1[J].Biotechnology letters,1999,21(11):939-945.
[43]Morita N,Tanaka M,Okuyama H.Biosynthesis of fatty acids in the docosahexaenoic acid-producing bacterium Moritella marina strain MP-1[J].Biochemical Society Transactions,2000,28(6):943.
[44]Heath RJ,Rock CO.Inhibition of-ketoacyl-acyl carrier protein synthase III(FabH)by acyl-acyl carrier protein in Escherichia coli[J].Journal of Biological Chemistry,1996,271(18):10996-11000.
[45]刘艳如,江贤章,高媛媛,等.海洋破囊壶菌△~5-延长酶和△~4-脱饱和酶在酿酒酵母中的共表达[J].应用与环境生物学报,2009,15(6):851-855.
[46]江贤章,刘丽霞,黄建忠.海洋破囊壶菌Δ 4-脂肪酸脱饱和酶基因在酿酒酵母中的表达[J].微生物学通报,2007,34(6):1154-1157.
