木糖异构酶基因xylA表达载体构建
2014-10-26陈小燕许敬亮袁振宏
杨 柳,叶 菁,陈小燕,许敬亮*,袁振宏
(1.中国科学院广州能源研究所中国科学院可再生能源重点实验室,广东广州 510640;2.中国科学院大学,北京 100039;3.华中科技大学环境科学与工程学院,湖北 武汉 430074)
利用廉价、储量丰富的木质纤维素类生物质生产液体燃料,对于解决当前能源危机和环境污染具有重大意义。木质纤维原料经预处理和水解后会产生大量的葡萄糖和木糖[1-2],其中木糖比重最高可达20%,然而自然界中的微生物普遍不能以木糖作为发酵底物,这一问题已成为发展木质纤维原料生物炼制的主要瓶颈[3-4]。谷氨酸棒杆菌(Corynebacterium glutamicum)是当前氨基酸和核酸工业的主要生产菌株,在细胞生长停滞的状态下,仍能大量合成乳酸、琥珀酸等高附加值产物,且对木质纤维原料预处理过程中产生的抑制物具有良好的耐受性,但目前分离出的谷氨酸棒杆菌都由于缺失木糖异构酶的编码基因xylA而不能代谢木糖[1,5]。由此,本实验通过基因工程手段,将大肠埃希菌 MG1655的xylA基因重组到大肠埃希菌-谷氨酸棒杆菌穿梭表达载体 pECXK99E上,并通过敲除其上编码对基因转录起负调控作用的 lacIq,使得 xylA在谷氨酸棒杆菌ATCC 13032中能组成型表达[6],以期为今后微生物利用木糖代谢研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 本实验中用到的菌株、质粒及其相关特性见表1。

表1 菌株及质粒Table 1 Bacterial strains and plasmids
1.1.2 培养基 大肠埃希菌LB培养基(w/v):胰蛋白胨1%,酵母提取物0.5%,NaCl 1%;谷氨酸棒杆菌LBG培养基为添加了0.5%葡萄糖的LB培养基。谷氨酸棒杆菌感受态的制备所用培养基的配制参照文献[7-8]。固体培养基添加2.2%琼脂。
1.1.3 酶及试剂 D-木酮糖、溶菌酶、三氯乙酸X-gal、IPTG、卡那霉素、氨苄青霉素购自 SIGMA;KOD-plus Taq DNA聚合酶购自Toyobo公司;Taq DNA Polymerase高温聚合酶以及其他PCR相关试剂购自上海生工生物工程有限公司;T4 DNA Ligase、限制性内切酶购自Fermentas公司;其余试剂均为国产或者进口分析纯或生化级。
1.2 方法
1.2.1 引物设计 根据GenBank中已报道的大肠埃希菌 MG1655 xylA基因序列(Gene ID:948141),利用 Primer Premier 5.0 和 Oligo 6.0 软件设计PCR引物,并在基因片段的两端分别加上EcoRⅠ和BamHⅠ酶切位点(图中下划线部分)。
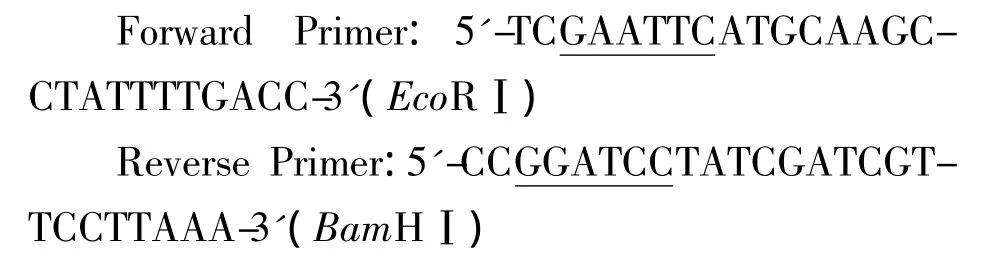
1.2.2 基因提取与PCR反应程序 本实验中基因组提取采用TIANGEN细菌基因组DNA提取试剂盒;质粒提取采用QIAprep Spin Miniprep Kit,具体操作步骤按照试剂盒说明书进行。以大肠埃希菌MG1655基因组为模板,按照Phusion Hot StarⅡDNA高保真酶的反应体系进行PCR,反应条件:98℃变性10 s,58℃退火30 s,72℃延伸1 min,循环数35次。
1.2.3 表达载体的构建 大肠埃希菌-谷氨酸棒杆菌穿梭表达载体pEC-XK99E[9-10]的质粒图谱如图1所示。先利用其上的EcoRⅤ和NdeⅠ酶切位点敲出 lacIq基因,得到改造载体 pEC-XK99E(lacI-)。再将经EcoRⅠ、BamHⅠ双酶切的xylA基因片段与用EcoRⅠ、BamHⅠ双酶切的载体pEC-XK99E(lacI-)进行连接,构建表达质粒pEC(lacI-)-xylA。

图1 表达载体的构建Fig.1 Construction of expression vector
1.2.4 质粒转化及检测 将构建好的载体pEC(lacI-)-xylA同时转化大肠埃希菌 BL21和谷氨酸棒杆菌 ATCC13032,并以空载体pEC-XK99E(lacI-)作为对照。大肠埃希菌 BL21的转化方法参考TransGen生物技术公司的操作步骤,谷氨酸棒杆菌ATCC13032感受态细胞制备与转化参考文献[7-8]。以含卡那霉素终浓度为50 μg/mL的平板为筛选条件,挑选菌株通过酶切和PCR验证是否为阳性克隆子。
1.2.5 木糖异构酶的表达与酶活测定 取过夜培养的菌液2 mL,4℃下5000×g离心5 min,收集菌体。重悬液转入1.5 mL EP管,置于冰水浴中进行超声破碎。超声处理时,将变幅杆(型号φ2)没于液面和管底中间,超声功率80 W,处理5 s间歇5 s直至重悬液变澄清,重复该过程5~10 min。将超声处理后的菌悬液4℃下20000×g离心30 min,收集上清液,转入干净离心管中,进行SDS-聚丙烯酰胺凝胶电泳。由于谷氨酸棒杆菌是革兰阳性菌,较难破壁,因此菌体用双蒸水洗涤2次后,加入1 mL溶菌酶液,37℃处理1 h后再进行超声波破碎。将上述获得的粗酶液通过半胱氨酸-咔唑法测定木糖异构酶(XI)活性[11-12]。木糖异构酶酶活单位定义:在给定的实验条件下,每10 min催化产生1 μmol D-木酮糖所需的酶量为一个酶活单位(即1 U)。
2 结果与分析
2.1 xylA基因PCR产物
以大肠埃希菌 MG1655基因组为模板,P1、P2为引物进行PCR扩增,用1.2%的琼脂糖凝胶电泳检测有特异的单一条带(图2),大小与理论值1412接近,经测序比对基因序列正确。
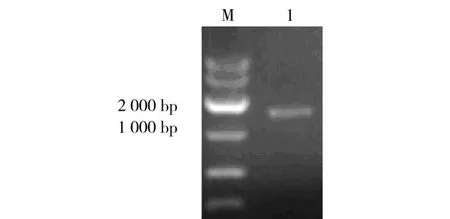
图2 xylA基因PCR产物Fig.2 Product of PCR for xylA gene
2.2 表达载体构建
2.2.1 pEC-XK99E(lacI-)构建 切除大肠埃希菌-谷氨酸棒杆菌穿梭表达载体pEC-XK99E上编码对基因转录起负调控作用的lacIq基因,使得xylA在谷氨酸棒杆菌ATCC 13032中能组成型表达,促进目的基因的表达。改造载体pEC-XK99E(lacI-)经 NcoI、HindⅢ双酶切验证,琼脂糖凝胶电泳检测大小正确,产生3个片段(图3a),位置大小与理论值相同2817、1247和1769 bp接近,表明表达载体构建成功。
2.2.2 表达质粒 pEC(lacI-)-xylA构建 表达质粒pEC(lacI-)-xylA经 EcoRⅠ、BamHⅠ双酶切验证,琼脂糖凝胶电泳检测大小正确,约为5840和1402 bp(图3b),经测序比对分析表明表达载体构建成功,所得质粒为目的载体pEC(lacI-)-xylA。
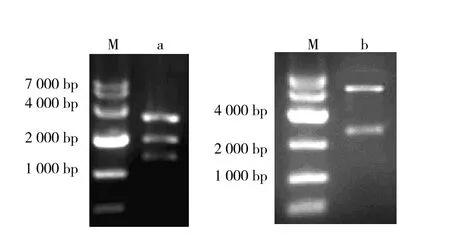
图3 质粒酶切验证结果Fig.3 The result of pamsid digested with restriction enzyme
2.3 蛋白质电泳及酶活测定结果
2.3.1 xylA基因在大肠埃希菌中表达 大肠埃希菌木糖异构酶的亚基分子量为44 ku[13]。如图4所示,在样品总蛋白含量基本一致的条件下,相较于对照组的重组菌株粗酶液,表达载体pEC(lacI-)-xylA的转化子在蛋白质Marker 44.3 ku附近的条带明显加粗,表明xylA基因在重组子中表达,随后的木糖异构酶酶活测定结果也证明了这一点(表 2)。重组菌株 BL21(pEC(lacI-)-xylA)在2种培养条件下都具有木糖异构酶酶活,且培养过程中没有添加IPTG进行诱导的转化子酶活相对较高(1.481 U/mg蛋白),这表明xylA基因在E.coli重组菌株中能组成型表达。

图4 E.coli BL21阳性转化子SDS-PAGE图谱Fig.4 SDS-PAGE of reconbinant strain E.coli BL21

表2 E.coli BL21阳性转化子XI酶活测定结果Table 2 The XI actvity of E.coli BL21 reconbinant strain
2.3.2 xylA基因在谷氨酸棒杆菌中表达 经菌落PCR证明xylA基因已成功转入谷氨酸棒杆菌(图5),但随后的蛋白质电泳和酶活测定实验发现,xylA基因并没有在谷氨酸棒杆菌 ATCC 13032中表达或表达痕量无法检测。在后面的工作中,对该载体进行了启动子改造,研究结果另文发表。

图5 C.glutamicum ATCC 13032转化子菌落PCR验证结果Fig.5 PCR identification of reconbinant strain C.glutamicum ATCC 13032
3 讨论
本实验成功构建了木糖异构酶表达载体pEC(lacI-)-xylA。但是通过诱导表达,仅在大肠埃希菌中表现活性。造成外源基因xylA在谷氨酸棒杆菌ATCC 13032和大肠埃希菌BL21中表达差异的主要原因:①启动子强度:原核基因的启动子通常具有一些特定的结构保守区,它们的碱基组成以及之间的距离会在很大程度上影响启动子的强度,从而控制目的基因转录水平的高低[14]。本文所采用的启动子Ptrc为大肠埃希菌的强启动子[15],而与目前预测的谷氨酸棒杆菌强启动子区域的序列模式[16-18]有所区别,极有可能导致外源基因在谷氨酸棒杆菌中表达痕量;②核糖体结合位点:翻译起始的效率是影响基因表达水平的另一重要因素。核糖体结合位点选用不当,会使目的基因5'端形成“茎环”结构,从而阻碍mRNA 5'端与核糖体30S亚基的结合,抑制翻译的起始[14,19];③质粒拷贝数:一般而言,质粒拷贝数与目的基因编码产物之间在一定阈值内呈非线性的正比关系,因此质粒拷贝数的增加可使目的蛋白产量提高。相比大肠埃希菌而言,穿梭载体pECXK99E在谷氨酸棒杆菌中的拷贝数较低,这对xylA基因的表达量也有一定影响[20-21]。
未来在关于木糖异构酶基因在谷氨酸棒杆菌中表达结构的研究中,可以优先考虑使用谷氨酸棒杆菌自身的强启动子序列[16-18],并结合有效的核糖体结合位点,促使外源基因在谷氨酸棒杆菌中快速有效地表达。
[1]Kawaguchi H,Vertès AA,Okino S,et al.Engineering of a xylose metabolic pathway in Corynebacterium glutamicum[J].Applied and environmental microbiology,2006,72(5):3418-3428.
[2]顾方媛,陈朝银,石家骥,等.纤维素酶的研究进展与发展趋势[J].微生物学杂志,2008,28(1):83-87.
[3]Jeffries,T.W..Utilization of xylose by bacteria,yeasts,and fungi[M].Adv Biochem Eng Biotechnol,1983,27:1-32.
[4]Görke B.,Stülke J..Carbon catabolite repression in bacteria:many ways to make the most out of nutrients[J].Nature Reviews Microbiology,2008,6(8):613-624.
[5]Yukawa H,Omumasaba CA,Nonaka H,et al.Comparative analysis of the Corynebacterium glutamicum group and complete genome sequence of strain R[J].Microbiology,2007,153(4):1042-1058.
[6]Liu Q,Ouyang SP,Kim J,Chen GQ.The impact of PHB ac-cumulation on l-glutamate production by recombinant< i>Corynebacterium glutamicum[J].Journal of biotechnology,2007,132(3):273-279.
[7]Eggeling,L.,M.Bott.Handbook of Corynebacterium glutamicum[M].CRC press,2010.
[8]余秉琦,沈微,诸葛健.适用于异源 DNA高效整合转化的谷氨酸棒杆菌电转化法[J].中国生物工程杂志,2005,25(2):78-81.
[9]Kirchner,O.,A.Tauch.Tools for genetic engineering in the amino acid-producing bacterium Corynebacterium glutamicum[J].Journal of Biotechnology,2003,104(1-3):287-299.
[10]Schröder J,Jochmann N,Rodionov DA,et al.The Zur regulon of Corynebacterium glutamicum ATCC 13032[J].BMC Genomics,2010,11(1):12.
[11]Dische,Z.Spectrophotometric method for the determination of free pentose and pentose in nucleotides[J].Journal of Biological Chemistry,1949,181(1):379-392.
[12]周世宁,黄蕾,陆勇军,等.嗜热脂肪芽孢杆菌耐热木糖异构酶的特性[J].微生物学通报,1998,25(5):271-274.
[13]G D Schellenberg,A Sarthy,A E Larson,et al.Xylose isomerase from Escherichia coli Characterization of the protein and the structural gene[J].Journal of Biological Chemistry,1984,259(11):6826-6832.
[14]李育阳.基因表达技术[M].科学出版社,2001.
[15]肖洁,郭刚,邹全明.提高大肠杆菌分泌表达重组蛋白的研究进展[J].微生物学杂志,2007,27(2):73-77.
[16]刘桂明,赵智,张英姿,等.谷氨酸棒杆菌10147基因组中启动子活性片段的克隆与分析[J].微生物学报,2009,(7):972-977.
[17]Preeti Srivastava,J.K.Deb.Gene expression systems in corynebacteria[J].Protein Expression and Purification,2005,40(2):221-229.
[18]Pátek,M..Promoters of Corynebacterium glutamicum[J].Journal of Biotechnology,2003,104(1-3):311-323.
[19]吴乃虎.基因工程原理[M].高等教育出版社,1989.
[20]孙乃恩.分子遗传学[M].南京大学出版社,1990.
[21]奥尔德.基因操作原理[M].中国科学技术翻译出版社,1985.
