预防性给予维生素D对实验性脑疟前炎症应答的影响
2014-10-26朱晓彤冯永辉曹雅明刘英杰
朱晓彤,冯永辉,曹雅明,刘英杰
(1.中国医科大学基础医学院免疫学教研室,辽宁 沈阳 110001;2.中国医科大学基础医学院病原生物学教研室,辽宁 沈阳 110001)
疟疾是严重威胁人体健康的寄生原虫感染性疾病,全球每年至少有一百万人死于疟疾感染[1]。脑疟(Cerebral Malaria,CM)是疟疾感染后最严重的并发症,是5岁以下儿童感染疟疾致死的主要原因之一[2]。因此,研发有效抗疟药物和疫苗在防治疟疾中至关重要。维生素D(Vitamin D,VD)是一种脂溶性类固醇激素,其主要作用是维持骨骼健康。但近年研究发现,VD在自身免疫性疾病[3]、心血管疾病[4]、感染性疾病和癌症[5]中亦发挥免疫调节作用。同时,VD可抑制Th1型细胞因子(IL-2和IFN-γ)、Th17细胞因子(IL-17和IL-21)的分泌,并通过刺激Th2型细胞因子(IL-4)的产生[6],间接调节初始T细胞亚群向Th1、Th2和Th17各亚群的分化过程。此外,由于活化T细胞表达VD受体(VDR),VD亦可直接抑制Th1类细胞亚群分化,并促进调节性 T细胞(Tregs)分化[7],直接影响T细胞免疫应答。虽然VD有多种免疫调节作用,但VD在疟疾中的研究尚处于空白。为此,本研究利用P.b ANKA感染C57BL/6小鼠建立的实验性脑疟(Experimental Cerebral Malaria,ECM)模型,观察预防性给予宿主 VD治疗对于疟疾感染后宿主免疫应答强度的影响,以期为脑疟治疗提供新的理论依据。
1 材料与方法
1.1 材料
1.1.1 疟原虫 6~8周龄、雌性 C57BL/6,BALB/c小鼠购自北京动物研究所;P.b ANKA由日本爱媛大学分子寄生虫学教研室惠赠。
1.1.2 主要试剂 VD、伊文思蓝及甲酰胺购自Sigma-Aldrich公司,使用前用豆油溶解;ELISA试剂盒购自R&d公司。
1.2 方法
1.2.1 ECM模型建立及VD处理 C57BL/6小鼠分别经腹腔感染1×106P.b ANKA寄生的红细胞(pRBC)建立ECM模型。于感染后每日观察生存率,在不同时间点,经小鼠尾静脉采血制备薄血膜,Giemsa染色,镜检计数红细胞感染率。在P.b ANKA感染前给予VD组小鼠口服VD 50 μg/kg,1次/d,连续7 d。对照组小鼠在相同的时间点给予同样体积的大豆油。
1.2.2 血脑屏障通透性检测 感染P.b ANKA后第8天,C57BL/6小鼠静脉注射200 μL伊文思蓝染料。1 h后,经心脏灌注生理盐水,至流出清亮的液体,取脑,放入装有1 mL甲酰胺的中号试管中,37℃温箱孵育48 h,3000 r/min离心15 min,取上清液,于紫外分光光度仪上(波长630 nm)测定染料溢出物,检测血脑屏障(BBB)的通透性。
1.2.3 脾细胞的制备和培养 感染后不同时间点杀鼠,留取血清。无菌条件下取出正常和感染小鼠的脾脏,采用200目筛网研磨后,用10 mL含10%热灭活的小牛胎血清(FCS),25 mmol/L Hepes,0.12%庆大霉素和2 mmol/L谷氨酰胺的RPMI 1640培养基制成细胞悬液。收集细胞悬浮液350 × g,室温离心 10 min,采用冷 0.17 mol/L NH4Cl裂解红细胞,RPMI 1640洗涤2次。采用含10%FCS的RPMI 1640将脾细胞终浓度调整至1×107个/mL,接于24孔培养板(FALCON)中,每孔加入500 μL细胞悬液,设3个复孔,37℃培养48 h,收集上清,-80℃保存,用于细胞因子及NO测定。
1.2.4 ELISA检测和 Griess反应 根据相应ELISA试剂盒说明书检测脾上清和血清中IFN-γ、TNF-α和IL-10的水平。同时采用Griess反应测定上清液中NO水平。
1.2.5 统计学处理 应用SPSS17.0统计软件进行数据处理,采用Kaplan-Meyer方法比较2组小鼠的生存期,通过独立样本t检验进行数据统计分析,P<0.05为差异显著。
2 结果与分析
2.1 预防性给予VD治疗对实验性脑疟模型鼠感染率和生存期的影响
如图1所示,对照组小鼠在P.b AKNA感染后9~11 d发生 ECM死亡,原虫血症水平约15%。与对照组相比,VD治疗组小鼠无脑疟症状产生,原虫血症水平随感染进程均显著上升达61%,小鼠在感染后15~17 d死于重度贫血(与NC组相比,P<0.01)。结果表明,预防性给予VD能保护C57BL/6小鼠发生ECM。
2.2 预防性给予VD治疗对实验性脑疟模型鼠血脑屏障完整性的影响
在感染后第8天,小鼠尾静脉注射2%伊文思蓝染料,通过测定伊文思蓝染料外渗量检测血脑屏障(blood brain barrier,BBB)的完整性。与对照组相比,预防性给予VD治疗组小鼠脑组织的伊文思蓝渗出显著减少(图2)。这一观察结果表明,预防性给予VD治疗可显著改善ECM小鼠的脑血管完整性。

图1 预防给予VD对实验性脑疟模型感染率(A)和生存期(B)的影响Fig.1 Effects of pre-treatment with vitamin D on the parasitemia and survival of ECM

图2 预防给予VD对实验性脑疟模型血脑屏障的影响Fig.2 Effects of pre-treatment with vitamin D on BBB of ECM mice
2.3 预防性给予VD治疗对实验性脑疟模型鼠前炎症细胞因子水平的影响
在小鼠感染后第0、3、5和8天,检测VD组和对照组脾细胞培养上清(图3A、B)和血清(图3D、E)中IFN-γ和 TNF-α 水平。研究发现,在感染后第5、8天,对照组脾上清和血清中IFN-γ及TNF-α水平显著升高。VD组TNF-α水平在感染后第5天亦显著升高。在感染后第8天,VD组脾细胞培养上清中IFN-γ和TNF-α水平显著低于对照组(P<0.05)。同时血清中的IFN-γ和TNF-α水平在感染后第5天,VD组显著低于对照组(P <0.05)。
进一步分析预防性给予VD治疗对脾细胞培养上清中NO(图3C)产生水平的影响发现,与对照组在感染后第5天和第8天NO水平显著升高相比,P.b ANKA感染后VD组NO水平无明显上升,且在感染后第5天和第8天均显著低于对照组(P<0.05)。上述研究结果表明,VD预防性给药治疗能够调节疟疾感染早期宿主前炎症免疫应答反应。
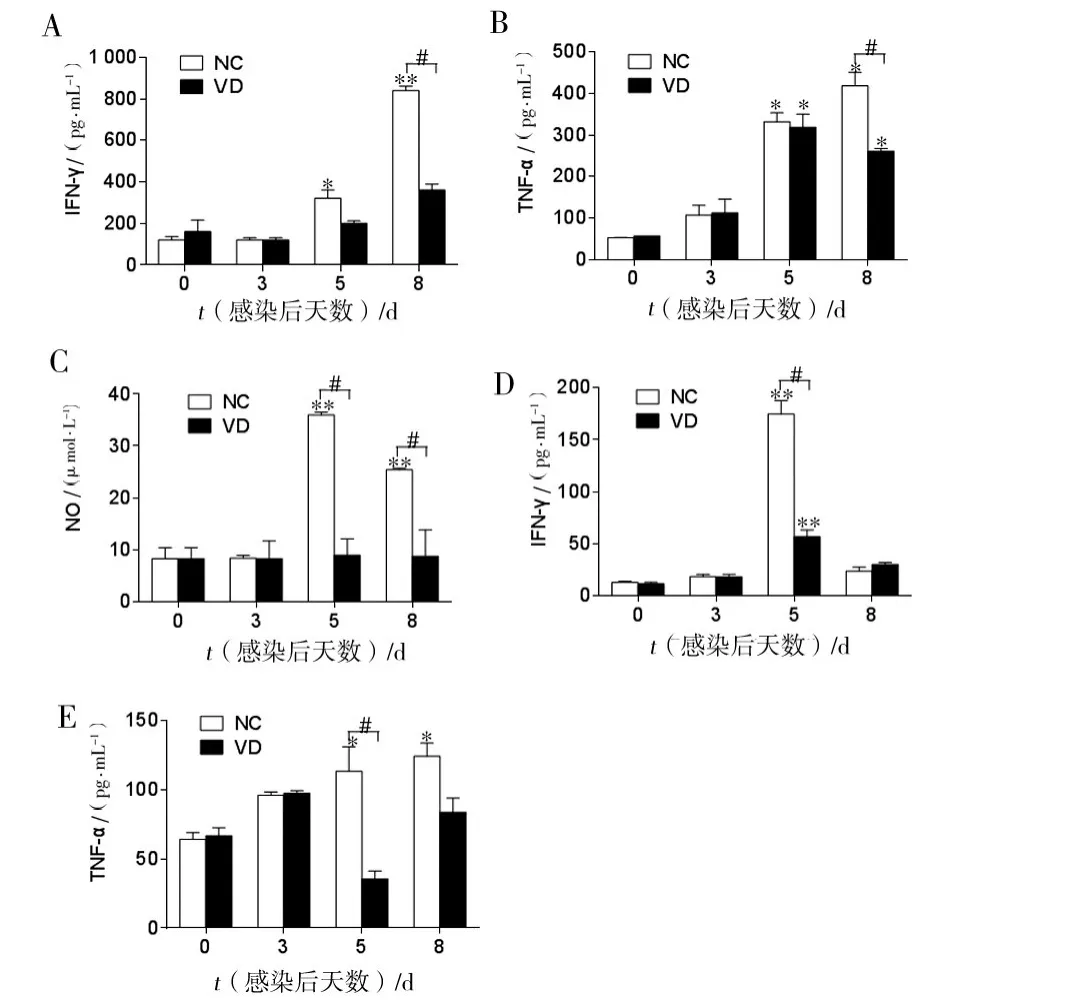
图3 预防给予VD对实验性脑疟模型前炎症细胞因子的影响Fig.3 Effects of pre-treatment with vitamin D on pro-inflammatory cytokines
2.4 预防性给予VD对抗炎性细胞因子IL-10的影响
抗炎性细胞因子IL-10对Th1型免疫应答具有抑制作用,因此本研究检测了脾上清(图4A)和血清(图4B)中IL-10水平。研究发现,在感染后第5、8天,对照组和VD组IL-10分泌水平均显著增加,但VD组感染后第5、8天IL-10的分泌明显高于对照组(P<0.05)。此研究结果表明,VD治疗可以增加IL-10分泌水平,从而抑制P.b ANKA感染后ECM的发生。

图4 预防性给予VD对抑制性细胞因子IL-10的影响Fig.4 Effects of pre-treatment with vitamin D on IL-10
3 讨论
有研究表明,高原虫血症和过强的前炎症免疫应答是导致CM发生的重要因素[8],而VD具有抑制前炎症免疫应答反应,减少自身免疫性疾病症状发生的作用[9]。本研究结果表明预防性给予VD治疗,可通过抑制ECM模型小鼠过强的前炎症应答,从而延长小鼠生存期。
疟原虫感染小鼠早期前炎症细胞因子,如IFN-γ、TNF-α 和 NO 分泌水平显著上升[10-11]。研究表明,过强的Th1免疫应答在CM病理中发挥重要作用[12],可促进脑疟发生。中和小鼠体内的IFN-γ可防止CM的发生并降低死亡率[13]。本研究发现,预防性给予VD治疗,可显著降低P.b ANKA感染小鼠体内IFN-γ和TNF-α水平。
早期研究显示,疟疾感染过程中NO分泌水平显著增加。作为固有免疫应答的重要组成部分,NO由脾脏中巨噬细胞产生[14]。高水平 NO可杀死疟原虫但也会对宿主产生不良影响。高浓度NO可能会扰乱其在中枢神经系统(CNS)的调节作用,导致意识障碍的脑型疟疾的发生[15]。本研究发现,P.b ANKA感染前,预防性给予VD可抑制感染过程中NO的分泌。由于前炎症细胞因子水平显著降低,可保护小鼠抵御脑疟发生。
VD单独或联合地塞米松可在APC体外系统诱导 Tregs产生 IL-10[16],Baeke 等报道,VD 可诱导CD4+CD25highCD127low表型的Tregs分化成熟,并选择性诱导CD4+T细胞亚群表达IL-10,在自身免疫性疾病和器官移植排斥反应中对宿主起到保护性作用[17]。本研究发现,VD预防性给药治疗可以通过提高IL-10水平抑制ECM发生。
前炎症和抗炎症免疫应答之间的平衡对控制疟疾发病至关重要。本研究表明,预防性给予VD治疗,可通过抑制宿主过强的前炎症免疫应答防止脑疟的发生,从而延长小鼠生存期。上述研究结果为疟疾防治的研究提供了有力的理论依据。
[1]Rénia L,Howland SW.Targeting the olfactory bulb during experimental cerebral malaria[J].Trends Parasitol,2014,pii:S1471-4922(14)00088-9.
[2]Kotlyar S,Nteziyaremye J,Olupot-Olupot P,et al.Spleen volume and clinical disease manifestations of severe Plasmodium falciparum malaria in African children[J].Trans R Soc Trop Med Hyg,2014,108(5):283-289.
[3]Costenbader KH,Feskanich D,Holmes M,et al.itamin D intake and risks of systemic lupus erythematosus and rheumatoid arthritis in women[J].Ann Rheum Dis,2008,67(4):530-535.
[4]Van der Schueren BJ,Verstuyf A,Mathieu C.Straight from DHeart:vitamin D status and cardiovascular disease[J].Curr Opin Lipidol,2012,23(1):17-23.
[5]Toriola AT,Nguyen N,Scheitler-Ring K,et al.Circulating 25-hydroxyvitamin D Levels and Prognosis among Cancer Patients:A Systematic Review[J].Cancer Epidemiol Biomarkers Prev,2014,23(6):917-933.
[6]Giulietti A,van Etten E,Overbergh L,et al.Monocytes from type 2 diabetic patients have a pro-inflammatory profile.1,25-Dihydroxyvitamin D(3)works as anti-inflammatory[J].Diabetes Res Clin Pract,2007,77(1):47-57.
[7]Jeffery LE,Burke F,Mura M,et al.1,25-Dihydroxyvitamin D3 and IL-2 combine to inhibit T cell production of inflammatory cytokines and promote development of regulatory T cells expressing CTLA-4 and FoxP3[J].J Immunol,2009,183(9):5458-5467.
[8]Pais TF,Chatterjee S.Brain macrophage activation in murine cerebral malaria precedes accumulation of leukocytes and CD8+T cell proliferation[J].J Neuroimmunol,2005,163(1-2):73-83.
[9]Cantorna MT,Munsick C,Bemiss C,et al.1,25-Dihydroxycholecalciferol prevents and ameliorates symptoms of experimental murine inflammatory bowel disease[J].J Nutr,2000,130(11):2648-2652.
[10]Su Z,Stevenson MM.Central role of endogenous gamma interferon in protective immunity against blood-stage Plasmodium chabaudi AS infection[J].Infect Immun,2000,68(8):4399-4406.
[11]Dascombe MJ,Nahrevanian H.Pharmacological assessment of the role of nitric oxide in mice infected with lethal and nonlethal species of malaria[J].Parasite Immunol,2003,25(3):149-159.
[12]Belnoue E,Kayibanda M,Vigario AM,et al.On the pathogenic role of brain-sequestered alphabeta CD8+T cells in experimental cerebral malaria[J].J Immunol,2002,169(11):6369-6375.
[13]Ya~nez DM,Manning DD,Cooley AJ,et al.Participation of lymphocyte subpopulations in the pathogenesis of experimental murine cerebral malaria[J].J Immunol,1996,157(4):1620-1624.
[14]Breuillard C,Belabed L,Bonhomme S,et al.Arginine availability modulates arginine metabolism and TNFα production in peritoneal macrophages from Zucker Diabetic Fatty rats[J].Clin Nutr,2012,31(3):415-421.
[15]Clark IA,Cowden WB.The pathophysiology of falciparum malaria[J].Pharmacol Ther,2003,99(2):221-260.
[16]Unger WW,Laban S,Kleijwegt FS,et al.Induction of Treg by monocyte-derived DC modulated by vitamin D3 or dexamethasone:differential role for PD-L1[J].Eur J Immunol,2009,39(11):3147-3159.
[17]Spach KM,Nashold FE,Dittel BN,et al.IL-10 signaling is essential for 1,25-dihydroxyvitamin D3-mediated inhibition of experimental autoimmune encephalomyelitis[J].J Immunol,2006,177(9):6030-6037.
