硼替佐米细菌内毒素检查方法学研究
2014-10-25吴露露汪岱迪宗卫峰
吴露露,刘 洋,刘 琦,汪岱迪,宗卫峰
(江苏省食品药品检验所,江苏南京210008)
硼替佐米是第一个应用于临床的蛋白酶体抑制剂,于2003年5月以商品名万珂(Velcade)被美国食品和药物管理局(FDA)最先批准用于临床治疗多发性骨髓瘤,在2008年6月被批准为一线治疗药物,多项临床试验显示其对多发性骨髓瘤具有良好的疗效[1],同时可克服化疗耐药性[2]。作为新一代有效治疗多发性骨髓瘤的药物,它通过全新的机制发挥其抗肿瘤作用,在恶性疾病的治疗中显示出广泛的应用前景。
硼替佐米不溶于水,且高浓度的硼替佐米溶液对鲎试剂(TAL)与细菌内毒素的凝集反应有干扰作用,而注射级的硼替佐米需要进行细菌内毒素或热原等安全性项目的控制,有关硼替佐米的细菌内毒素检查的方法学一直未见有文献报道。由于鲎试剂与内毒素的反应一般都要在水溶液中进行,只有样品完全溶解才能确保内毒素不被样品包裹而释放,为了确保结果的准确及操作简便可行,本文探索一种新的思路即将不溶于水的药物硼替佐米按制剂工艺的比例加入一定浓度的助溶剂(甘露醇)溶液使药物溶解,再用BET水稀释建立了凝胶法细菌内毒素检查并经方法学验证,以完善其质量标准,为该产品采用凝胶法进行细菌内毒素检查提供科学依据,并为水不溶性药物建立细菌内毒素检查法提供帮助。
1 实验材料
硼替佐米(某企业提供,规格:原料,批号:2618-15-25、2618-24-25、2618-33-25);鲎试剂(湛江安度斯生物有限公司,规格:0.1 mL,批号:1209052,灵敏度:0.125 EU·mL-1;规格:0.1 mL,批号:1211081,灵敏度:0.06 EU·mL-1。湛江博康海洋生物有限公司,规格:0.1 mL,批号:1209140,灵敏度:0.125 EU·mL-1;规格:0.1 mL,批号:1207131,灵敏度:0.06 EU·mL-1);细菌内毒素工作标准品(中国药品生物制品检定所,规格:1 mL,批号:150601-201174,效价:160 EU/支);细菌内毒素检查用水(BET水,中国药品生物制品检定所,规格:5 mL,批号:201208);10%的甘露醇溶液(某企业提供,规格:250 mL:50 g,批号:130107120,BET 水无菌配制)。
2 方法与结果[3,4]
2.1 供试品细菌内毒素限值的确定 硼替佐米临床用量为1.3 mg·m-2,按公式:L=K/M 计算[M为1.3 mg·m-2×1.62 m2·(60 kg·h)-1,K 为 5 EU·(kg·h)-1]本品的细菌内毒素限值L=K/M=[5 EU·(kg·h)-1]/[1.3 mg·m-2×1.62 m2·(60 kg·h)-1]=142 EU·mg-1。由于注射用硼替佐米(制剂)推荐的细菌内毒素限值为应小于25 EU·mg-1。考虑到临床用药的安全因素以及与本品制剂的细菌内毒素限值保持一致,所以也将硼替佐米(原料)的细菌内毒素限值定为应小于25 EU·mg-1。
2.2 鲎试剂灵敏度的复核 按照《中国药典》2010年版(二部)附录细菌内毒素检查法的要求复核所用鲎试剂,结果均符合规定。
2.3 干扰预试验 目前市售鲎试剂λ一般为0.5、0.25、0.125、0.06、0.03 EU·mL-1,将硼替佐米分别用10%的甘露醇溶液溶解并用BET水稀释成0.02、0.01、0.005、0.002 5 和 0.001 25 mg·mL-1,将此系列溶液记为NPC。同时在上述试验液中加入细菌内毒素标准溶液,使每一浓度的试验液中均含有2λ浓度的细菌内毒素,记此系列溶液为PPC。取灵敏度为0.125 EU·mL-1的两个不同厂家的鲎试剂,分别与上述NPC和PPC进行反应,每一浓度重复两管,并设阴性对照(NC)和阳性对照(PC),结果见表1。
预干扰试验结果显示:硼替佐米在浓度为0.02及0.01 mg·mL-1时对湛江安度斯生物有限公司鲎试剂与细菌内毒素的反应有明显干扰抑制作用,在浓度为0.02、0.01 和0.005 mg·mL-1浓度时,对湛江博康海洋生物有限公司鲎试剂与细菌内毒素的反应有明显干扰抑制作用。对两个厂家鲎试剂均无干扰的浓度为 0.002 5 mg·mL-1、0.001 25 mg·mL-1,因此,正式干扰试验的浓度选择为0.002 5 mg·mL-1。
2.4 正式干扰试验 为了最终确认是否存在抑制因素的影响,取硼替佐米分别用10%的甘露醇溶液溶解并用BET水稀释,使其最终干扰试验浓度为0.002 5 mg·mL-1,进行以下正式干扰试验。
取灵敏度为0.06 EU·mL-1的两个厂家鲎试剂,按《中国药典》2010年版(二部)附录中的供试品干扰试验项进行实验,结果见表2。

表2 硼替佐米的正式干扰试验
表2结果表明:Es在0.5~2.0 λ(包括0.5 λ 和2.0 λ)范围之内,Et则在0.5 ~2.0 Es(包括0.5 Es和2.0 Es)范围之内。供试品在0.002 5 mg·mL-1浓度下,对鲎试剂与细菌内毒素的反应均无明显干扰抑制作用。
2.5 标准的制定及供试品细菌内毒素检查 根据上述干扰试验的结果,制定的硼替佐米的细菌内毒素检查标准为:取本品细粉适量,加10%的甘露醇溶液溶解并稀释制成含硼替佐米为 5 mg·mL-1溶液后,依法检查[《中国药典》2010年版(二部)附录ⅪE),每1 mg硼替佐米中内毒素含量应小于25 EU。
根据上述检验标准,按《中国药典》2010年版(二部)附录Ⅺ E细菌内毒素检查法,取灵敏度为0.06 EU·mL-1的的两个厂家鲎试剂,分别对3批供试品进行细菌内毒素检查。并同时设立供试品阳性对照管(PPC)、NC管和PC管。
试验时,每批供试品取鲎试剂8支,分别用0.1 mL BET水溶解,其中2支加入供试品溶液(NPC),2支加入供试品阳性对照溶液(PPC),2支加入阴性对照溶液(NC),2支加入阳性对照溶液(PC),各种药液的加样量均为0.1 mL,37℃孵育60 min后观察结果,结果见表3。
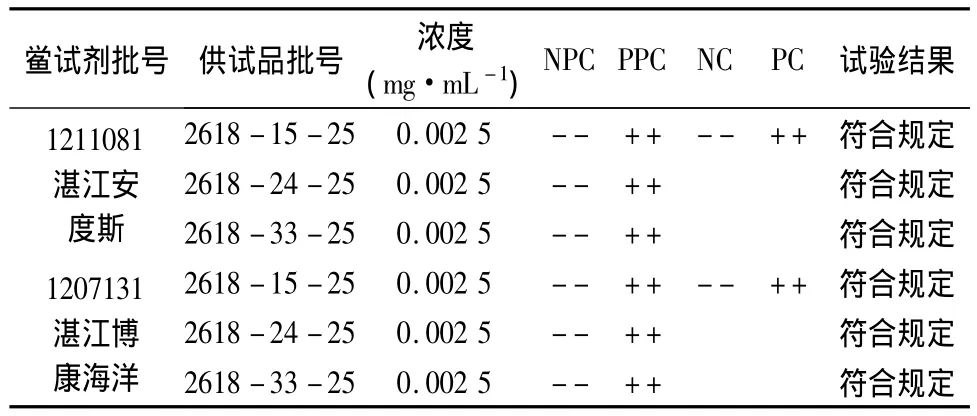
表3 硼替佐米的细菌内毒素检查结果
3批硼替佐米的细菌内毒素检查表明,供试品经两个厂家的鲎试剂检验,结果均为符合规定。
3 讨论
因鲎试剂与内毒素的反应需在水溶液体系中进行,因此凝结法细菌内毒素检查会不同程度受到水不溶性药物或物质本身或提取方法及提取溶剂等因素的影响,从而干扰测定结果,国外除了采用标准化的方法,还研究了一些替代方法以确保结果的可靠准确[5,6]。国内对不溶于水的药物或制剂常采用加水振荡萃取[7]或加入有机溶剂溶解,但前者并未提供回收率的数据,后者常出现加有机溶剂溶解后再加水稀释时样品重新析出或有机溶剂破坏内毒素的现象。为了确保结果的准确及操作简便可行,本文探索一种新的思路即将不溶于水药物硼替佐米按制剂工艺加入一定浓度的助溶剂(甘露醇)溶液(硼替佐米-甘露醇之比为1∶10)使药物溶解,再用BET水稀释,制成均一的溶液进行干扰预试验和干扰确证试验,结果均符合规定。试验使用两个不同厂家的鲎试剂,对3批样品分别进行了干扰试验,结果表明,高浓度硼替佐米对鲎试剂与细菌内毒素的凝集反应有干扰作用,在浓度稀释至0.002 5 mg·mL-1时即可排除干扰作用。综上所述,笔者认为硼替佐米原料经甘露醇溶液助溶后,可以采用细菌内毒素检查法进行质量控制。
[1]王凡,赵春亭.硼替佐米致周围神经病变机制的研究进展[J].中华临床医师杂志(电子版),2013,7(6):2641-2643.
[2]王立琳,肖若芝.蛋白酶体抑制剂—硼替佐米的临床治疗研究进展[J].国际内科学杂志,2008,35(11):657-661.
[3]国家药典委员会.中华人民共和国药典2010年版(二部)[S].北京:中国医药科技出版社,2010:附录99-102,附录212-215.
[4]中国药品生物制品检定所,中国药品检验总所.中国药品检验标准操作规范(2010版)[M].北京:中国医药科技出版社,2010:287.
[5]Smulders S,Kaiser JP,Zuin S,et al.Contamination of nanoparticles by endotoxin:evaluation of different test methods[J].Part Fibre Toxicol,2012,9:41
[6]Spaan S,Heederik DJ,Thorne PS,et al.Optimization of airborne endotoxin exposure assessment:effects of filter type,transport conditions,extraction solutions,and storage of samples and extracts[J].Appl Environ Microbiol,2007,73(19):6134-6143.
[7]胡容融.注射用油细菌内毒素检查方法的研究[J].广东药学院学报,2002,18(2):99 -101.
