几种杀菌剂对番茄青枯病菌的抑菌活性
2014-10-23尹显慧龙友华
王 英,尹显慧,2*,王 梅,龙友华,2
(1.贵州大学作物保护研究所,贵州 贵阳550025;2.贵州大学 贵州山地农业病虫害重点实验室,贵州 贵阳550025)
番茄青枯病由青枯雷尔氏菌(Ralstonia solanacearum,简称青枯菌)引起的植物细菌性维管束病害,在高温、高湿环境下容易暴发,广泛分布于热带、亚热带和温带地区,甚至在部分低温地区同样发现青枯菌的存在,给全球农作物生产带来了极大的威胁[1-3]。一般连种3~5年,番茄的产量和品质就会受到严重影响。发病初期,植株上部叶片的叶柄出现下垂,而后叶片渐次枯萎,同时茎部出现不定根,植株快速萎蔫并逐渐枯死[4],轻则减产20%~40%,严重时达60%以上甚至绝收[5]。在我国长江流域及其以南地区发生较为普遍,如江苏、广东、湖北、浙江、福建、四川、贵州等各地均有发生,给我国番茄生产造成了严重损失[6]。目前,该病的有效防治仍然是世界难题。因此,本文通过10种杀菌剂对修文地区采集的青枯病病菌进行室内毒力测定,以期了解番茄青枯病防治中已登记的杀菌剂对青枯雷尔氏菌的抑菌效果和病原菌对这些杀菌剂的抗性水平;并通过已登记杀菌剂与未登记对青枯雷尔氏菌的抑菌效果对比,筛选出新的可替代化学、生物杀菌剂,为防治番茄青枯病提供更多有效、安全的用药参考。
1 材料与方法
1.1 病原菌分离纯化
在贵州省贵阳市修文县番茄青枯病重发田采集番茄青枯病病株的地上茎秆部位,用75%的酒精擦拭病株基部的茎杆两端,迅速过火焰烧尽酒精,用消过毒的解剖刀削平茎秆两端,将其插入盛有灭菌水的三角瓶中,然后罩上无菌烧杯,放置于室温条件下。待有菌脓从端部溢出后,用接菌环蘸取少量菌脓在TTC培养基上划线,25℃培养48 h。待有单菌落长出时,用接菌环挑取单菌落接种到NA培养基上,25℃培养48 h后保存于4℃冰箱中备用。
1.2 培养基
NA培养基:牛肉浸膏3 g,蛋白胨5 g,琼脂14 g,蔗糖20 g,双蒸蒸馏水1 000 mL,pH值7.0。
TTC培养基:牛肉浸膏3 g,蛋白胨10 g,琼脂15 g,氯化钠5 g,TTC 0.01 g,双蒸蒸馏水1 000 mL,pH值7.5。
1.3 供试药剂
本试验供试药剂见表1。

表1 供试药剂Tab.1 The tested fungicides
1.4 试验方法
1.4.1 供试药剂对番茄青枯病菌EC50的测定与比较 采用改进的圆形滤纸片法[7-8],用微量加样器吸取108cfu/mL的细菌悬液1 mL至9 cm直径的培养皿上,倒人冷却溶化的9 mLNA琼脂的固体培养基混匀凝固。用打孔器将滤纸打成5 mm直径圆片,分别浸入表2所列药剂浓度的药液里,移到平板上,等距放置,每处理3皿,每皿3片,设无菌水为对照。将培养皿置于28℃恒温培养箱里培养36 h后,用十字交叉法测量抑菌圈直径,然后采用农药室内生物测定数据处理系统软件[9]计算出各种杀菌剂对番茄青枯病病菌的抑制中浓度EC50及其95%置信区间、相关系数R。通过EC50值比较供试杀菌剂对番茄青枯病菌的抑菌效果。

表2 各供试药剂配制的浓度梯度Tab.2 The concentration gradients of tested fungicides
1.4.2 番茄青枯病菌对供试杀菌剂抗性水平测定
病原菌对供试杀菌剂(活体生物杀菌剂除外)的抗性划分,参考赵晓军等[10]的方法并做一定的调整:采用Yarden标准,以药剂0.5 mg/L作为鉴别浓度,进行最低抑制浓度(MIC)测定,把菌落不能在鉴别浓度上正常生长的定为敏感药剂,菌落能在鉴别浓度上正常生长的定为抗性药剂,根据各药剂的EC50,计算抗性水平。根据抗性水平,将不同的番茄青枯病菌分为4个抗性类型(表3)。
抗性水平=抗性药剂EC50/鉴别浓度
2 结果与分析
2.1 番茄青枯病的症状
番茄青枯病一般在成株期发病。开始显示症状时,顶端叶片萎蔫下垂(图1),后下部叶片萎蔫,最后中部叶片萎蔫,有时一侧叶片先萎蔫或整株叶片同时萎蔫。发病初期,叶色变浅,病株白天萎蔫,傍晚复原。当湿度大时,病茎上出现水浸状斑块,后斑块变为褐色,剖开后可以看到病茎维管束为褐色(图2),横切该病茎,用手挤压,有白色菌液从维管束中溢出。
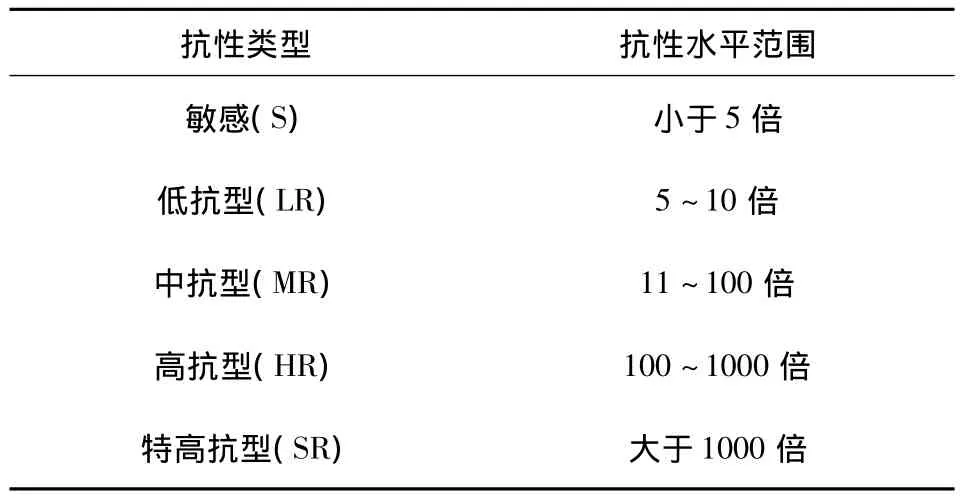
表3 抗性类型Tab.3 The type of resistance level

图1 番茄青枯病发病初期Fig.1 Initial stage of tomato bacterial wilt

图2 番茄青枯病的病茎Fig.2 Diseased stem infected by tomato bacterial wilt
2.2 番茄青枯病病原物
镜检可见菌体为短杆状单细胞,单生或双生,两端圆,极生1~2根鞭毛。在琼脂培养基上菌落为圆形或不规则,外缘为白色,中央为淡粉红色,革兰氏染色为阴性。
2.3 杀菌剂对青枯病菌的EC50比较
2.3.1 已登记杀菌剂之间的比较 已登记的3种杀菌剂中,有1种化学药剂和2种生物制剂,EC50值见表4,其中以3%中生菌素WP的EC50值最小,也是10供试药剂中对番茄青枯病菌抑菌效果最好的;其次是20%噻森铜SC;0.1亿cfu/克多粘类芽孢杆菌FG是活体细菌类微生物杀菌剂,其EC50值为0.071×108cfu/L。
2.3.2 未登记杀菌剂之间的比较 从表4可以看出,在未登记7种杀菌剂中,有2种生物制剂和5种化学药剂。2种生物制剂的抑菌活性均比化学药剂要强,其中氨基寡糖素是D-氨基葡萄糖以聚糖,可诱导植物的抗病性[11],其对番茄青枯病的抑菌活性优于生产上常用的72%农用硫酸链霉素WP,其EC50值为2.180 mg/L。5种化学杀菌剂的EC50值中,53%喹啉铜WP的最小,其次为20%叶枯唑WP、1.5%噻霉唑EW和57.6%氢氧化铜GF抑菌效果最差的为80%代森锰锌WP。
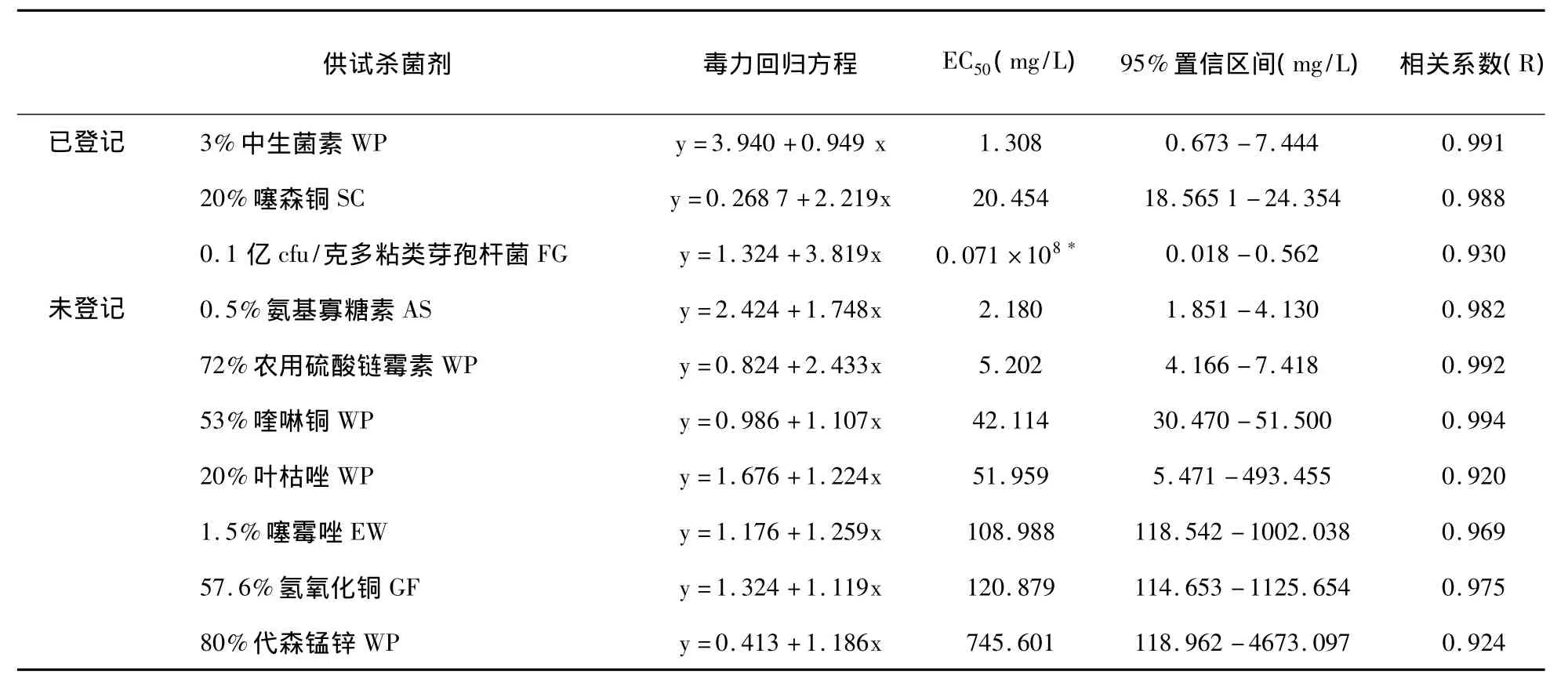
表4 不同杀菌剂对番茄青枯病菌的毒力测定结果Tab.4 Regression equation and EC50 of fungicides against Ralstonia solanacearum
2.3.3 未登记杀菌剂与已登记杀菌剂EC50值的比较 从表4可以看出,在所有供试杀菌剂(除0.1亿cfu/克多粘类芽孢杆菌FG以外)中,已登记杀菌剂的EC50值普遍比未登记杀菌剂的EC50值低,而且生物杀菌剂的抑菌效果均好于化学药剂。但未登记杀菌剂中,0.5%氨基寡糖素AS的EC50值稍高于3%中生菌素WP的EC50值,低于20%噻森铜SC的EC50值,对番茄青枯病菌的抑制作用显著;在未登记杀菌剂中,72%农用硫酸链霉素WP的抑菌效果良好,优于已登记杀菌剂20%噻森铜SC。
2.4 青枯病菌对供试杀菌剂抗性水平的比较
病原菌对3种已登记杀菌剂和7种未登记杀菌剂的抗性水平见表5。病原菌对已登记药剂中3%中生菌素WP和未登记药剂中0.5%氨基寡糖素AS表现为敏感外,对其余7种杀菌剂均表现出一定的抗药性,特别是对80%代森锰锌WP表现出特高抗水平,对57.6%氢氧化铜GF和53%喹啉铜WP达到高抗水平,而对20%叶枯唑WP表现出中抗水平,对72%农用硫酸链霉素WP产生了一定的抗药性。

表5 各种杀菌剂对番茄青枯病菌的抗性水平Tab.5 The resistance levels of the tested fungicides on Ralstonia solanacearum
3 结论与讨论
杀菌剂对病原菌的EC50值常常是衡量杀菌剂对病原菌抑制作用的重要指标,可为药剂进行田间或保护地的实际药效试验提供参考[12],EC50值越小,则说明供试药剂对番茄青枯病菌的抑制效果越好,在实际应用中对青枯病的防治效果可能就越好。
在已登记杀菌剂中,中生菌素的抑制作用最好。中生菌素是一种农用抗生素,对水稻白叶枯病、白菜软腐病、柑橘溃疡病等农作物细菌性病害具有良好的防治效果,通过抑制病原细菌蛋白质的肽键生成,最终导致细菌死亡,同时可刺激植物体内植保素及木质素的前体物质的生成,从而提高植物的抗病能力[13],使用安全,已登记在番茄青枯病防治中使用。本试验中该药剂对番茄青枯病菌的抑菌效果最好,且供试病原菌对其表现敏感,表明中生菌素为番茄青枯病防治中的优先之选;另外多粘类芽孢杆菌为修文地区细菌性活体生物制剂,其代谢产物中含有多种可利用的生物活性物质,可以通过与病原菌在生态位竞争生存空间和营养物质、对病害因素的解毒以及产生多种代谢产物达到抑制、杀死或者溶解病原的作用,已报道对细菌性土传病害——植物青枯病具有很好的防治效果[14];而病原菌对噻森铜已表现出中抗水平,应引起重视,在生产中要注意交替用药。
在未登记杀菌剂中,抑菌作用最强的是氨基寡糖素。氨基寡糖素由几丁质降解得壳聚糖后再降解制得,或由微生物发酵提取的低毒杀菌剂,通过对植物细胞的作用,诱导植物体产生酚类化合物、木质素、植保素、病程相关蛋白等抗病物质,并提高与抗病代谢相关的防御酶和活性氧清除酶系统的活性,还可以溶解真菌、细菌等病原体细胞壁,干扰病毒RNA的合成,达到防止病害的目的,能活化植物细胞,调节和促进植物生长,提高抗逆力[15]。它在环境中易于降解,完全不会对环境造成污染,兼有药效和肥效双重生物调节功能的特点,国内目前氨基寡糖素农药,经广泛的田间实验及室内验证对西瓜枯萎病、棉花黄萎病、番茄晚疫病、烟草病毒病、黄瓜白粉病、生菜立枯病、辣椒疫病等均有很好的防效[16]。孔德英和肖崇刚已报道了氨基寡糖素对番茄青枯病具有良好的防治作用[17],但还没有登记作为番茄青枯病的防治药剂。本试验中番茄青枯病菌对氨基寡糖素同样表现敏感,该杀菌剂的抑菌效果接近中生菌素,可开展更深入的研究;其次农用硫酸链霉素对番茄青枯病的抑菌效果也相对较好,而且农用硫酸链霉素为农用抗生素,其作用机制与常用化学杀菌剂不同,因此可作为青枯病防治时交替用药的选择。
近年来,生防制剂作为IPM(Integrated Pest Management)的重要组成部分,在农业生产中发挥着越来越重要的作用。中生菌素、氨基寡糖素、多粘类芽孢杆菌和农用硫酸链霉素均属于生物杀菌剂,具有人畜安全,对自然环境安全、无污染,病原菌不易产生抗药性等优点,在本试验中,4种生物杀菌剂均对番茄青枯病菌表现出良好的抑菌效果,因此今后在修文地区防治番茄青枯病时,建议选用4种药剂交替施用,以保证番茄的绿色安全生产。
[1]SALANOUBAT M,GENIN S,ARTIGUENAVE F,et al.Genome sequence of the plant pathogen Ralstonia solanacearum[J].Nature,2002,415:497-502.
[2]ALLEN C,PRIOR P,HAYWARD A C.Bacterial wilt disease and the Ralstonia solanacearum species complex[M].Saint Paul:American Phytopathological Society,2005,9-28.
[3]CARUSO P,PMOMO J L,BERTOLINI E,et al.Seasonal variation of Ralstonia solanacearum biovar 2 populations in a Spanish liver:recovery of stressed cells at low temperatures[J].Applied and Environment Microbiology,2005,71(1):140-148.
[4]王 羽.无致病力青枯病病菌对番茄青枯病的控制研究[D].重庆:西南农业大学,2004.
[5]刘肖肖,董元华,李建刚.不同土壤改良剂对番茄青枯病的防治效果[J].农业环境科学学报,2013,32(7):1 368-1 374.
[6]孔德英,肖崇刚.氨基寡糖素对番茄青枯病防治作用[J].西南农业大学学报,2005,27(3):327-330.
[7]叶建如,顾 钢,张 瀛.几种药剂防治烟草青枯病的药效评价[J].中国烟草科学,2013,34(1):72-76.
[8]任建国,王俊丽,岳美云.21种杀菌剂对番茄疮痂病菌的毒力测定[J].中国蔬菜,2011,4:56-60.
[9]司升云,蔡定军,吴仁锋,等.农药室内生物测定数据处理系统[CP/DK].武汉市蔬菜科学研究所,2006.
[10]赵晓军,王美琴,周建波,等.山西省黄瓜灰霉病菌对乙霉威的抗药性检测[J].山西农业科学,2011,39(10):1 096-1 098.
[11]檀志全,谭海文,覃保荣,等.5%氨基寡糖素AS在番茄上的应用效果初探[J].中国植保导刊,2013,10:65-66.
[12]奉代力,王 强,郑纪慈,等.几种杀菌剂对番茄灰霉病菌的抑菌效果对比研究[J].浙江农业学报,2013,25(1):119-123.
[13]蒋细良,王劲波,王慧敏,等.中生菌素对水稻悬浮细胞过氧化物酶基因转录表达的影响[J].中国生物防治,2006,22(3):207-210.
[14]王刘庆,王秋影,廖美德.多粘类芽孢杆菌生物特性及其机理研究进展[J].中国农学通报,2013,29(11):158-163.
[15]孙艳秋,李宝聚,陈 捷.寡糖诱导植物防卫反应的信号传导[J].植物保护,2005,31(1):5-9.
[16]杨普云,李 萍,王战鄂,等.植物免疫诱抗剂氨基寡糖素的应用效果与前景分析[J].中国植保导刊,2013,33(3):20-21.
[17]孔德英,肖崇刚.氨基寡糖素对番茄青枯病防治作用[J].西南农业大学学报,2005,27(3):327-330.
