福建洛阳江口红树林小型底栖动物的研究
2014-10-22郭玉清
常 瑜,郭玉清
(1.集美大学水产学院,福建厦门361021;2.福建省海洋渔业资源与生态环境重点实验室,福建厦门361021)
0 引言
福建泉州洛阳江口红树林湿地位于泉州湾河口湿地自然保护区,是亚热带河口湿地的典型代表[1].湾内水体受北支潮控制,属正规半日潮.这里天然的红树植物有桐花树 (Aegiceras comiculatum)、秋茄(Kandelia candel)和白骨壤(Avicennia marina)3种,均分布在湾口从秀涂至石湖连线的内湾内,同时这里也是桐花树和白骨壤在太平洋西岸自然分布的北界[2].主要恢复区以桐花树和秋茄混交林为主,桐花树占70%,植株高度大致为1.5~2.5 m[2].
红树林生态系统具有复杂的有机碎屑食物链.小型底栖动物作为海洋碎屑食物链的关键中间环节,已经成为海洋环境监测和生态系统健康评估体系的一个关键指标[3].截至目前为止,已经有许多学者对泉州湾洛阳江红树林保护区有过研究,包括湿地人工生态恢复[4]、生态旅游价值[5]、沉积物中汞分布及形态特征[6]、大型底栖动物的多样性[7-8]等等,而对小型底栖动物尤其是自由生活海洋线虫的研究尚未见报道.本研究的目的在于通过对泉州湾洛阳江红树林保护区小型底栖动物数量及线虫群落结构的研究,以期为该红树林湿地健康评价指标体系的构建以及红树林的生态修复提供借鉴,为红树林底栖小食物网的研究提供一些参考.
1 材料与方法
1.1 采样站点与时间
本研究采样站点设在桐花树树林中(24.95°N,118.69°E). 沿着海水流动向海的方向,设采样站位3个,分别以Q1、Q2和Q3表示 (见图1).3个站位间隔100 m左右.采样时间为2012年10月和2013年1月、4月、7月 (因7月份样品损坏,本文只用3个季度月的数据).
1.2 野外采样及室内分选
选择底质类型相对一致、无扰动的地点取样.用内径为2.9 cm的注射器改制成的取样管,从表层采集5 cm深度的芯样,每个采样点采集重复样4个,分别直接装入广口瓶,现场加入体积分数为5%的福尔马林溶液固定,共获得36份样品.
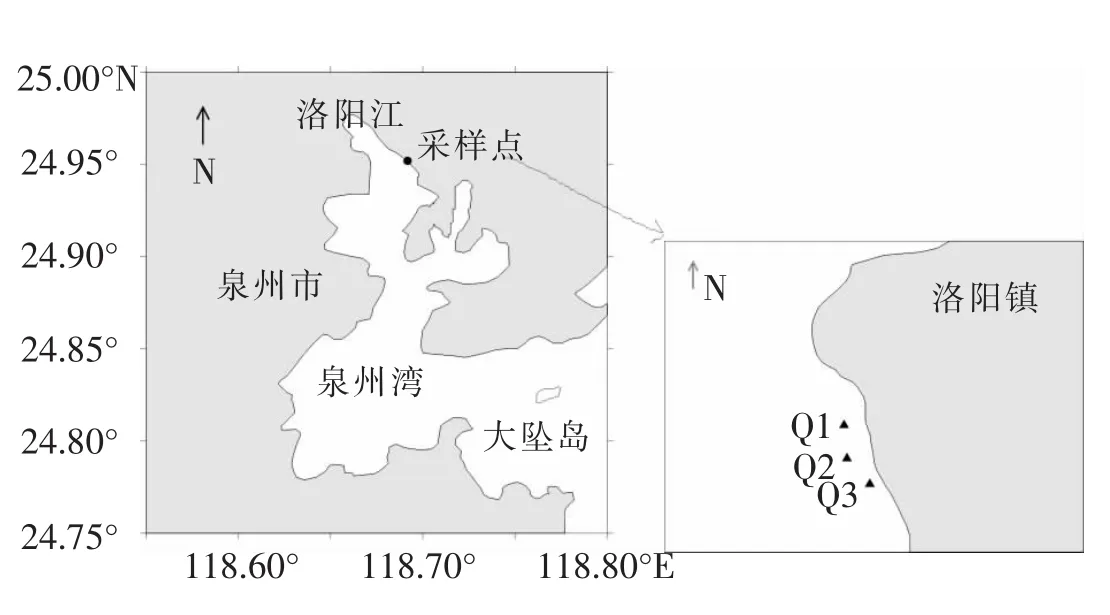
图1 福建泉州洛阳江口红树林湿地采样点示意图Fig.1 Map of the estuarine mangrove in Luoyang River,Fujian Province,showing the positions of the sampling sites
在室内,将样品倒在由500 μm和50 μm两层网筛组成的套筛内,用过滤过的自来水缓缓冲洗直至大部分的粘土和粉砂被除尽.之后,用Ludox提取液 (ρ(水)∶ρ(Ludox)=1∶1.15)将样品转移至离心管,放入离心机3500 r/min离心10 min,重复离心3次.选取上清液,用50 μm孔径网筛过滤,将所截留的全部后生动物转移到划有等宽平行线的培养皿中,在解剖镜下 (型号:Nikon-SMZ800)把所有的小型底栖动物按类群分别计数.并将线虫全部挑出,放到特制的玻璃容器中,倒入混合溶液 (V(甘油)∶V(酒精)∶V(水)=1∶1∶18)进行虫体的透明,在干燥箱内静置2周后,制片.
2 结果
2.1 泉州洛阳江红树林小型底栖动物的种类组成
泉州湾红树林共鉴定出10个小型底栖动物类群,包括自由生活海洋线虫、底栖桡足类、多毛类、寡毛类、水生昆虫、海螨类、涡虫类、介形类、链虫、甲壳类无节幼体和其他未鉴定种.在所有样品中,自由生活海洋线虫是最优势的类群,占总丰度的92.94%.桡足类为第二优势类群,为5.24%,其次为寡毛类 (0.87%)、多毛类 (0.73%),其他类群占0.21%,包括水生昆虫、海螨、涡虫类、介形类、端足类、无节幼体和其他未鉴定种 (见表1).
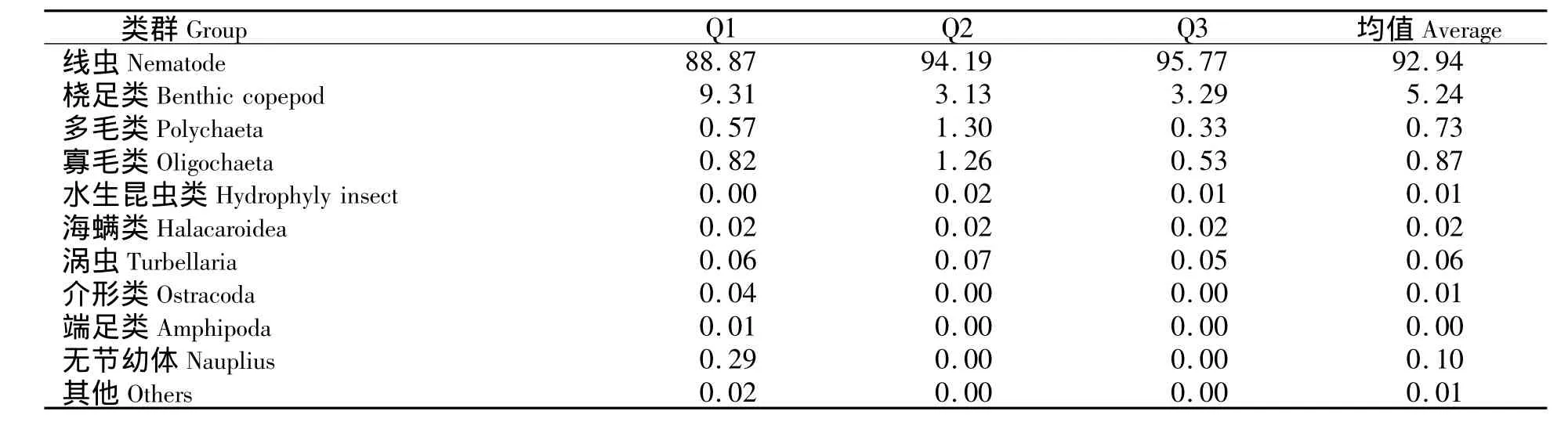
表1 不同站位小型底栖动物类群丰度的百分比Tab.1 The percentages contributing to meiofauna density at Luoyang River mangrove%
2.2 泉州湾小型底栖动物丰度的空间分布
小型底栖动物的丰度在离海较近的Q1站位最高,均值为(93.8±28.2)ind/cm2,范围为18.9~203.4 ind/cm2,变化幅度较大;在离海距离最近的Q3次之,平均为(78.4±14.4)ind/cm2.经统计分析结果为:P=0.994(P>0.05),表明不同采样站位间小型底栖动物的丰度不存在显著性差异.

表2 洛阳江红树林区不同站位小型底栖动物的丰度Tab.2 Spatial variations in meiofauna density at Luoyang River mangrove(ind·cm-2)
2.3 泉州洛阳江红树林小型底栖动物丰度的季节变化
线虫在冬季均占据绝对优势,桡足类其次.线虫在春季丰度最高,为(90.6±15.1)ind/cm2,秋季最低,为(21.0±4.4)ind/cm2.桡足类则在冬季数量最高.多毛类、寡毛类、其他类在各个季节均有分布,但所占比例很小.统计分析结果为:P=0.026,差异显著,说明小型底栖动物的丰度存在明显的季节差异.
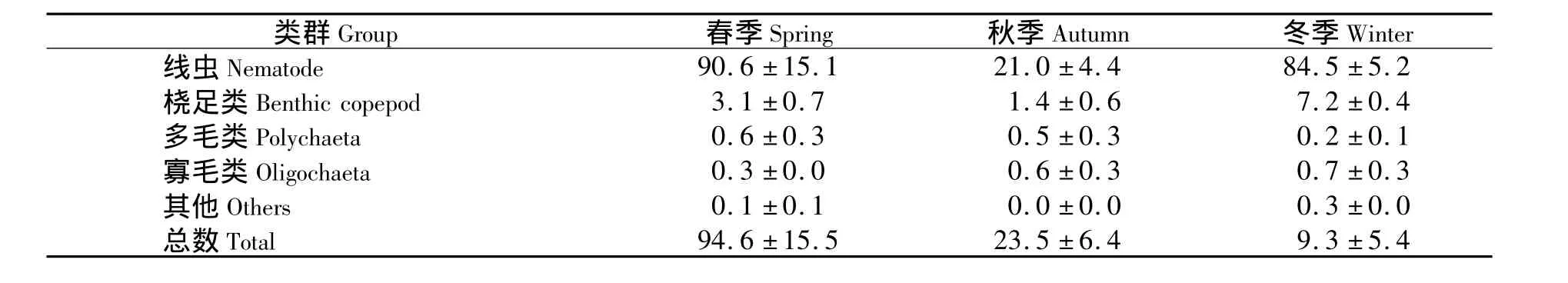
表3 洛阳江红树林区不同季节小型底栖动物的丰度Tab.3 Seasonal fluctuations of meiofaunal density at Luoyang River mangrove(ind·cm-2)
2.4 泉州湾线虫的群落结构和多样性分析 (以秋季为例)
本研究共鉴定线虫419条,结果表明分别属于27属,13科.其中有9个属是不同潮层和季节所共有的属.按优势度排序前五名的优势属依次为Sabatieria、Parasphaerolaimus、Adoncholaimus、Parodontophora、Terschellingia和Viscosia(并排第五),分别占总丰度的22.13%、13.58%、13.12%、10.18%、6.55%和6.55%,合计占到总丰度的72.11%.
Wieser[9]根据线虫口器的不同结构,将自由生活海洋线虫划分为4个功能类群,分别为选择性食沉积物者、非选择性食沉积物者、刮食者以及捕食者.从属的数量分析,洛阳江红树林区非选择性沉积食性者,所占的比例最大,为40.74%;其次是刮食者,占29.63%;捕食者与选择性沉积食性所包括的属数最少,分别为18.52%、11.11%.从个体数量分析,非选择性沉积食性者占总个体数的51.47%;捕食者次之,占23.79%;选择性沉积食性则占据比例较小,仅为7.76%.而无论从属的数量还是个体数来说,均以非选择性沉积食性者为压倒性的取食类型,说明泉州洛阳江红树林区的自由生活海洋线虫主要以腐烂的有机碎屑为食.
从3个站位物种多样性指数的结果可以看出 (见表4):离海最远的Q1站,出现的种类数为14种,是3个站位中出现数量最少的,其丰富度指数、香农-威纳指数也最低.Q2站位线虫的物种丰富度指数、香农-威纳指数最高,物种优势度指数最低.位于离海最近的Q3站位,这两种指数的数值位于Q1和Q2站位的中间.
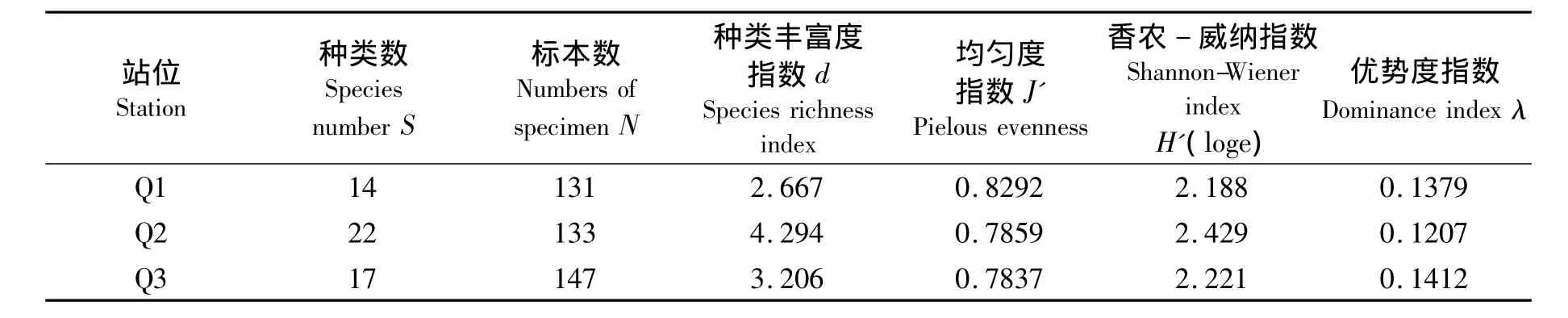
表4 不同站位海洋线虫群落的生物多样性指数Tab.4 Biodiversity indices in Luoyang River mangrove
从3个站位的群落K-优势度曲线 (见图1)可以看出,Q1站位所代表的群落优势度曲线位于图形的最上方,表明该站位线虫群落具有高的物种优势度和低的物种多样性.Q2站位所代表的群落优势度曲线位于图形的最下方,表明该站位群落具有低的群落优势度和高的物种多样性.Q3站位的K-优势度曲线,位于Q1和Q2站位的中间.这些结果与单变量参数的结果是一致的.
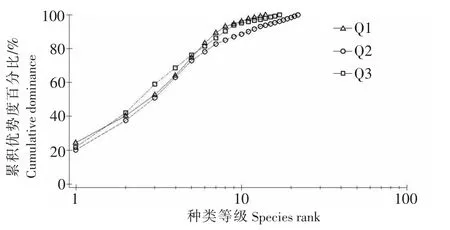
图2 洛阳江红树林3个站位海洋线虫群落的K-优势度曲线Fig.2 K-dominance curves derived from nematode abundances at three stations in Luoyang River mangrove
3 讨论
3.1 泉州湾红树林小型底栖动物的种类组成
河口红树林潮间带 (特别是中高潮区)沉积环境中,动物既要耐受变化无常的自然环境因子的作用,又要经受大型底栖动物活动的影响,同时也受到近岸人类活动的干扰[10].独特的生境特征往往使小型底栖动物成为这里最丰富的动物类群,自由生活海洋线虫由于其有数量多、分布广和生活周期短等特点又构成海洋小型底栖无脊椎动物中的最主要类群.郭玉清[11]对厦门凤林红树林湿地 (人工林)冬季4个断面13个站位的研究共鉴定出自由生活海洋线虫、桡足类、多毛类、寡毛类以及其他类5类,线虫占小型底栖动物的76.11% ~96.13%.刘均玲等[12]于2012年冬季对海南东寨港国家级红树林保护区小型底栖动物进行的研究中发现了7个类群,分别为自由生活海洋线虫、桡足类、涡虫类、多毛类、寡毛类、海螨类及其他类,线虫占到90.53%~97.02%.本研究中线虫的数量仍然占绝对优势92.92%,但出现的类群较多,为11个类群.可能的原因,一方面是本研究在一年的不同季节采样,增加了稀有类群出现的频率,另一方面是其他研究可能将偶然出现的标本归入了其他类中.但是对于小型底栖群落而言,稀有种加入到群落中对多样性的影响较小,而优势种的改变对多样性影响却很大[13],泉州湾红树林中出现的类群种类较多,也并不一定代表这里的生物多样性就一定更高,还需要做进一步的研究.
3.2 泉州湾小型底栖动物丰度的空间分布和季节变化
泉州湾河口湿地自然保护区总面积876.9 hm2,主要保护河口滩涂红树林、湿地生物及鸟类[2].本研究采样地在洛阳江口桐花树林,位于泉州湾湾顶,这里受到径流和潮汐两者共同的相互影响,盐度数值随海湾河口向河内逐渐降低[5].但研究结果表明不同采样站位小型底栖动物的组成及丰度不存在显著性差异.可能的原因在于,尽管3个采样站位存在一定的空间距离,但基本处于同一潮位,使沉积物类型、有机质含量、氧含量以及含水量基本保持一致.黄雅琴[9]2010年在洛阳江红树林自然保护区Qch2断面 (在本研究采样区域内)测得,表层沉积物是以细颗粒为主的淤积区,中值粒径为7.11,全年有机质的质量分数平均为1.86%,硫化物的质量分数7.06 mg/kg.另外,由于河口沉积物中的间隙水是密度较大的海水 (下沉),因此在潮汐周期内的盐度变化远远小于上覆水[14].相似的生境造成3个站点小型底栖生物的丰度尽管存在不同,但未构成显著差异.
关于小型底栖动物丰度的季节变化,王伯荪等[15]对深圳河口福田红树林泥滩海洋线虫的研究表明:春季最高,冬季次之,夏季再次之,秋季最低.本实验的结果与之相似:春季最高,为(94.6±15.5)ind/cm2,秋季最低,为(23.5±6.4)ind/cm2,统计分析表明存在明显的季节差异.吴辰[16]研究福建漳江口红树林秋茄、桐花树和白骨壤4个季度小型底栖动物的平均丰度分别为(150.03±73.52)、(171.75±62.17)和(260.71±80.26)ind/cm2,丰度随季节变化的顺序为:冬季>春季>夏季>秋季.曹靖[17]研究广东湛江高桥无瓣海桑、桐花树和木榄4个季度小型底栖动物的平均丰度分别为(118.82±39.052)、(107.18±61.36)和(73.90±23.78)ind/cm2,但丰度随季节变化的顺序与上面提到的研究结果几乎完全相反,秋季>春季>夏季>冬季.小型底栖动物的数量受许多生物因素和非生物因素的共同影响,而河口沉积环境本身的异质性及变化多样,决定了河口红树林小型底栖动物丰度的变化范围较大.上述不同学者给出的不同站位小型底栖动物丰度平均数的较大标准差,也说明小型底栖动物群丰度季节变化的复杂性.
Chinnadurai[18]在印度东南岸Pichavaram 和Parangipettai红树林 (11.45°N,79.78°E)冬季采样得出小型底栖动物丰度的最大值为890 ind/cm2.Mokievsky[19]等人在越南Khan Hoa省 (12°12.033'N,109°10.899'E)Nha Trang红树林春季采样,得出小型底栖动物群丰度为73.5~24.4 ind/cm2.这些热带红树林小型底栖动物丰度低于我国目前报道的红树林小型底栖动物丰度的数值,似乎在一定程度上说明了自然地理位置的差异决定着红树林小型底栖动物丰度的差异.
3.3 自由生活海洋线虫的群落结构
曹靖[17]研究广东湛江高桥桐花树红树林自由生活海洋线虫群落结构时表明,Terschellingia的优势度平均为20%、Sabatieria为11%、Parasphaerolaimus为4%.厦门凤林红树林湿地的优势种为Viscosia sp.、Spilophoralla sp.、Terachellingia sp.、Sabatieria sp.,其优势度分别为7%、15.65%、18.9%、40.9%.这两者的研究结果与本研究有一定的相似度.吴辰[16]研究福建漳江口桐花树红树林海洋线虫群落结构的结果,6个优势度超过6%的优势种中,有4个属出现在本研究的结果中(Sabatieria、Terschellingia、Parodontophora、Parasphaerolaimus),而且Sabatieria的优势度平均 (冬春两季)为32.25%,成为绝对优势种,与本研究的结果更为相似.Chinnadurai[20]研究表明印度桐花树红树林中出现线虫种类23种,优势属为Dorylaimopsis,其优势度为30.3%.Mokievsky[19]得出越南红树林中的优势种为 Chromadorella sp.、Ptycholaimellus sp.、Sabatieria sp.、Haliplectus floridanus、Anoplostoma nhatrangensis和Litinium subterraneum.这些结果与国内红树林中出现的优势种差异较大,表明了红树林湿地作为海洋海岸湿地的主要类型之一,其间海洋线虫群落的结构既有一定的相似性,又存在地域、不同红树植物生境的特殊性.
致谢:本研究在野外采样过程中得到蔡东亿同学的相助,在室内样品分选过程中得到华彦宇和李元滨同学的帮助,在此表示衷心的感谢.
[1]黄宗国,万为民.海洋河口湿地生物多样性[M].北京:海洋出版社,2004:73-115.
[2]李裕红.全球气候变化对泉州湾河口湿地红树林生态系统的影响及对策[J].海峡科学,2012(2):10-12.
[3]刘均玲,黄勃.红树林生态系统小型底栖动物研究进展 [J].海洋科学,2012,36(10):118-122.
[4]叶功富,范少辉,刘荣成,等.泉州湾红树林湿地人工生态恢复的研究 [J].湿地科学,2005,3(1):8-12.
[5]刘怀如,袁怡圃,梁美霞,等.泉州湾红树林生态旅游价值及其开发探讨 [J].福建林业科技,2010,37(3):136-138,161.
[6]于瑞莲,胡恭任,刘越,等.泉州湾红树林湿地沉积物中汞分布及形态特征 [J].生态学杂志,2011,30(5):1004-1007.
[7]黄雅琴,李荣冠,江锦祥.泉州湾洛阳江红树林自然保护区潮间带软体动物多样性及分布 [J].海洋科学,2011,35(10):110-116.
[8]黄雅琴.洛阳江红树林自然保护区大型底栖动物多样性研究[D].厦门:国家海洋局第三海洋研究所,2010.
[9] WIESER W.Die Beziehung zwischen Mundhlengestalt,Ernahrungsweise und workommen bei freilebenden marine nematoden [J].Archives fur Zoologie,1953,4(26):436-484.
[10]伍淑婕,梁士楚.人类活动对红树林生态系统服务功能的影响 [J].海洋环境科学,2008,27(5):537-542.
[11]郭玉清.厦门凤林红树林湿地自由生活海洋线虫群落的研究 [J].海洋学报,2008,30(4):147-153.
[12]刘均玲,黄勃,梁志伟.东寨港红树林小型底栖动物的密度和生物量研究[J].海洋学报,2013,35(2):187-192.
[13] HEIP C H R,DECRAEMER,W.The diversity of nematode communities in the southern North Sea [J].J Mar Biol Ass,1974,54(1):251-255.
[14]沈国英,施并章.海洋生态学[M].北京:海洋出版社,2010:212-219.
[15]王伯荪,廖宝文,王勇军,等.深圳湾红树林生态系统及其持续发展[M].北京:科学出版社,2002:67-69.
[16]吴辰.福建漳江口红树林和盐沼湿地小型底栖动物的研究[D].厦门:厦门大学环境生态学院,2013.
[17]曹靖.湛江高桥红树林湿地小型底栖动物群落的生境多样性研究[D].厦门:厦门大学环境生态学院,2013.
[18] CHINNADURAI G,FERNANDO OLIVIA J.Meiofauna of mangroves of the southeast coast of India with special reference to the free-living marine nematode assemblage [J].Estuarine,Coastal and Shelf Science,2007,27(1):329-336.
[19] MOKIEVSKY V O,TCHESUNOV A V,UDALOV A A,et al.Quantitative distribution of meiobenthos and the structure of the free-living nematode community of the mangrove intertidal zone in Nha Trang bay(Vietnam)in the South China Sea[J].Russian Journal of Marine Biology,2011,37(4):272-283.
[20] CHINNADURAI G,FERNANDO,OLIVIA J.Meiobenthos of Cochin mangroves(Southwest coast of India)with special emphasis on free-living marine nematode assemblages[J].Russian Journal of Nematology,2006,64(2):127-137.
