脱氧胆酸在人结肠癌细胞株HCT116迁移和侵袭中的作用及其机制研究
2014-10-22赵会君房静远
赵会君 孔 炫 房静远
上海交通大学医学院附属仁济医院消化内科 上海市消化疾病研究所(200001)
结直肠癌是消化系统常见恶性肿瘤,病死率在恶性肿瘤中居第四位[1]。动物脂肪摄入量增加是促进结直肠癌形成的重要因素[2]。动物脂肪摄入量增加可促进胆汁酸分泌,导致体内次级胆汁酸含量增加。脱氧胆酸(deoxycholic acid,DCA)是参与肠肝循环的一种次级胆汁酸,研究[3]显示结直肠癌患者粪便中的DCA含量明显高于健康人,且DCA含量升高的结直肠癌患者肿瘤复发风险显著增加。Yui等[4]的研究显示,DCA可诱导结肠上皮细胞DNA损伤、线粒体破坏,促进结肠上皮细胞凋亡,并可引起细胞基因组不稳定性,导致基因突变增加,进而促进结肠癌发生。Da Silva等[5]的研究发现,DCA在体外可通过激活蛋白激酶B和p38,促进ERK1/2磷酸化,诱导结肠癌细胞增殖。DCA是生理状态下体内长期存在的代谢分子,然而目前研究多为以高浓度DCA短时间刺激细胞,采用长时间慢性刺激的研究甚少。本研究以DCA长时间刺激人结肠癌细胞株HCT116,探讨DCA在结肠癌细胞迁移和侵袭中的作用及其机制,以期为结直肠癌的防治提供理论依据。
材料与方法
一、细胞株和主要试剂
人结肠癌细胞株HCT116购自American Type Culture Collection(ATCC),培养于含10%胎牛血清的McCoy’s 5A培养基中(37℃,5%CO2)。DCA、DMSO购自Sigma公司,CCK-8试剂盒购自东仁化学科技(上海)有限公司,Matrigel基质胶购自BD公司,Transwell小室购自Millipore公司,Bradford蛋白定量试剂盒购自碧云天生物技术研究所,兔抗人上皮型钙黏蛋白(E-cadherin,E-cad)抗体、鼠抗人神经型钙黏蛋白(N-cadherin,N-cad)抗体、兔抗人维生素D受体(VDR)抗体购自Abcam公司,GAPDH抗体、HRP标记的羊抗兔二抗、兔抗鼠二抗购自上海康成生物工程有限公司,ECL试剂盒购自Pierce公司。
二、方法
1.细胞增殖率检测:取对数生长期HCT116细胞,以5×103/孔接种于96孔板,培养24 h,更换为无血清McCoy’s 5A培养基培养6 h,分别以含DCA 12.5、50、200 μmol/L 和 DMSO 的培养基处理细胞0、12、24、36 h,吸除培养基,加入 100 μL 无血清培养基和10 μL CCK-8试剂,37℃培养2 h,于酶标仪450 nm波长处测定吸光度(A)值。细胞增殖率(%)=(实验孔A值-空白孔A值)/(阴性对照孔A值-空白孔A值)×100%,根据细胞增殖率绘制生长曲线。
2.细胞迁移能力检测:取对数生长期HCT116细胞,接种于25 cm2培养瓶,以含 DCA 12.5 μmol/L的McCoy’s 5A培养基培养,隔天换液,以含DMSO的培养基作为阴性对照组。培养3 d后消化细胞,接种于6孔板培养24 h,待细胞密度达到100%,以无菌黄色Tip头于6孔板内划痕,PBS冲洗,加入含DCA 12.5 μmol/L或DMSO的培养基培养,显微镜下多位点拍照,4 d后再次拍照观察划痕愈合情况。
3.细胞侵袭能力检测:细胞培养同迁移能力检测。培养5 d后消化细胞,以含DCA 12.5 μmol/L或DMSO的无血清培养基重悬细胞至1.0×106/mL。以经无血清培养基稀释的 Matrigel基质胶(1∶3)包被Transwell小室底部膜的上室面,待基质胶稀释液聚合成凝胶,取细胞悬液200 μL加入小室,下室加入含30%胎牛血清和DCA 12.5 μmol/L或DMSO的培养基,培养2 d后取出小室,以棉签擦除小室聚碳酸酯膜上表面细胞和凝固的基质胶,4%多聚甲醛固定 15 min,0.1%结晶紫溶液染色30 min,倒置显微镜下观察并任意选取5个视野(×20)计数聚碳酸酯膜下表面细胞,结果取均值。
4.蛋白质印迹法检测E-cad、N-cad、VDR蛋白表达:取对数生长期HCT116细胞,分别以含DCA 12.5 μmol/L的培养基处理 1、3、7、14、28 d,或以含DMSO的培养基处理28 d,收集细胞提取总蛋白,以Bradford法行蛋白定量。每一样本取100 μg蛋白上样,行10%变性SDS-PAGE电泳,转膜,5%脱脂牛奶封闭,分别加入兔抗人E-cad抗体(1∶200)、鼠抗人N-cad抗体(1∶500)、兔抗人VDR抗体(1∶500)和GAPDH抗体(1∶5000),4℃过夜,TBST洗膜,加入HRP标记的羊抗兔二抗(1∶5000)或兔抗鼠二抗(1∶5000),室温孵育1 h,ECL显影,凝胶成像系统拍照和分析。
三、统计学分析
结 果
一、HCT116细胞增殖率
CCK-8 实验结果显示,经 12.5、50、200 μmol/L DCA作用36 h的 HCT116细胞,细胞增殖率较DMSO组明显升高,以12.5 μmol/L组升高最为显著(P<0.05)(见图1)。
二、HCT116细胞迁移力和侵袭力
划痕实验结果显示,经12.5 μmol/L DCA作用7 d的HCT116细胞,细胞迁移力较DMSO组明显增强(见图2);Transwell实验结果显示,该组细胞侵袭力亦较DMSO组显著增强(P<0.01)(见图3)。
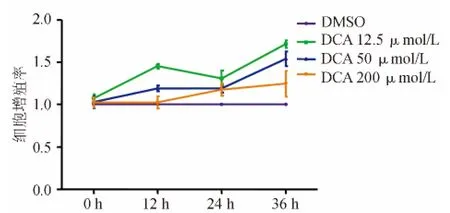
图1 不同浓度、不同时间DCA处理组HCT116细胞增殖率比较

图2 12.5 μmol/L DCA处理对 HCT116细胞迁移力的影响(划痕实验)
三、E-cad、N-cad、VDR 蛋白表达
蛋白质印迹法检测结果显示,DCA组E-cad和N-cad表达水平随DCA作用时间的延长而升高,第28 d时明显高于DMSO组;DCA组VDR表达水平在第1 d时较DMSO组有所上升,其后呈下降趋势,第28 d时较DMSO组明显降低(见图4)。
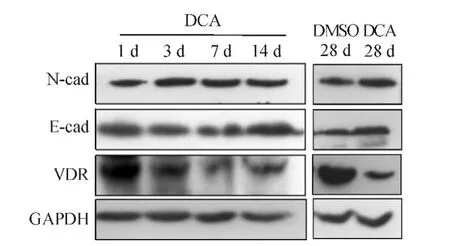
图 4 12.5 μmol/L DCA 处理对 HCT116 细胞 E-cad、N-cad、VDR表达的影响(蛋白质印迹法)
讨 论
DCA是参与肠肝循环的次级胆汁酸,作为一种诱导结直肠癌发生的代谢产物,近年来在人群流行病学和基础研究方面得到广泛关注。近年研究发现DCA可促进结肠癌细胞增殖,然而其在结肠癌细胞迁移和侵袭中的作用尚未明确。本研究以不同浓度DCA刺激人结肠癌细胞株HCT116,证实DCA可促进HCT116细胞增殖,浓度为12.5 μmol/L时效应较 50、200 μmol/L 显著,因此以12.5 μmol/L作为理想剂量进行后续研究。
肿瘤远处转移是结直肠癌患者死亡的主要原因。本研究通过以DCA刺激HCT116细胞较长时间,探讨DCA对HCT116细胞迁移力和侵袭力的影响,结果显示经DCA作用7 d的HCT116细胞,细胞迁移力和侵袭力显著增强。进一步以DCA作用于HCT116 细胞 1、3、7、14、28 d,研究 DCA 对上皮-间质转化(epithelial-mesenchymal transition,EMT)相关标记物E-cad、N-cad表达的影响,结果发现两者表达水平随DCA作用时间的延长而升高,第28 d时明显高于DMSO组。E-cad是维系细胞间紧密连接的钙连接蛋白,在EMT过程中表达减少或缺失,而N-cad在EMT过程中表达增加,该变化可促进癌细胞迁移[6]。然而有学者指出,细胞在经历EMT时,并非所有的EMT标记物均会发生变化[7]。Nieman等[8]的研究发现,在E-cad未发生明确变化的情况下,N-cad可促进人乳腺癌细胞迁移和侵袭。Cho等[9]对肝细胞癌的研究显示,N-cad不仅能促进癌细胞侵袭,还可促进癌细胞增殖,并抑制其凋亡。由此可见,本研究中N-cad表达水平升高即可证实DCA对结肠癌细胞的迁移、侵袭具有促进作用,而E-cad表达水平升高在此过程中的作用有待进一步明确。
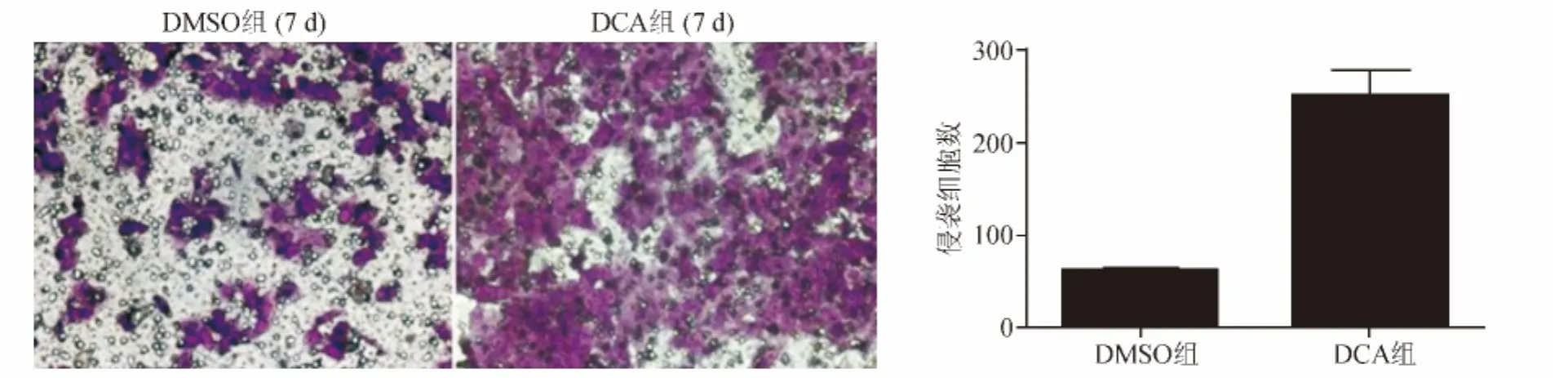
图3 12.5 μmol/L DCA处理对HCT116细胞侵袭力的影响(Transwell实验,×20)
VDR是肠道上皮细胞的核受体之一,可通过抑制Wnt/β-catenin通路,阻止结直肠癌早期恶性演变,对肿瘤发生、发展具有抑制作用[10]。研究[11-12]显示,约90%的结直肠癌患者存在VDR表达下调,低分化结直肠癌组织的VDR表达水平较高分化结直肠癌组织降低。EMT相关转录因子SNAIL1、SNAIL2可抑制VDR表达,而VDR可促进E-cad表达[13-14]。本研究结果显示,DCA作用于HCT116细胞后,VDR表达水平呈双向变化,在短时间内(第1 d)呈上升趋势,但3、7、14、28 d 后呈下降趋势,推测DCA作用后VDR表达在短时间内升高可能是细胞为适应并抑制DCA的毒性作用而产生的反应性调节,但后期该调节作用减弱,VDR表达呈下降趋势,促进结肠癌细胞迁移、侵袭。
综上所述,DCA可促进结肠癌细胞增殖,且较长时间(7 d)的DCA刺激能显著增强结肠癌细胞的迁移力和侵袭力,其机制可能与上调N-cad表达和下调VDR表达有关,然而具体作用机制仍未完全明确,有待后续进一步深入研究。
1 Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
2 Yang CX,Kuroishi T,Huang XE,et al.Correlation between food consumption and colorectalcancer:An ecological analysis in Japan[J].Asian Pac J Cancer Prev,2002,3(1):77-83.
3 Kawano A,Ishikawa H,Kamano T,et al.Significance of fecal deoxycholic acid concentration for colorectal tumor enlargement[J].Asian Pac J Cancer Prev,2010,11(6):1541-1546.
4 Yui S,Kanamoto R,Saeki T.Deoxycholic acid can induce apoptosis in the human colon cancer cell line HCT116 in the absence of Bax[J].Nutr Cancer,2008,60(1):91-96.
5 Da Silva M,Jaggers GK,Verstraeten SV,et al.Large procyanidins prevent bile-acid-induced oxidant production and membrane-initiated ERK1/2,p38,and Akt activation in Caco-2 cells[J].Free Radic Biol Med,2012,52(1):151-159.
6 Jeanes A,Gottardi CJ,Yap AS.Cadherins and cancer:how does cadherin dysfunction promote tumor progression[J]?Oncogene,2008,27(55):6920-6929.
7 Thompson EW,Williams ED.EMT and MET in carcinoma--clinical observations,regulatory pathways and new models[J].Clin Exp Metastasis,2008,25(6):591-592.
8 Nieman MT,Prudoff RS,Johnson KR,et al.N-cadherin promotes motility in human breast cancer cells regardless of their E-cadherin expression[J].J Cell Biol,1999,147(3):631-644.
9 Cho SB,Lee KH,Lee JH,et al.Expression of E-and N-cadherin and clinicopathology in hepatocellular carcinoma[J].Pathol Int,2008,58(10):635-642.
10 Larriba MJ,Martín-Villar E,García JM,et al.Snail2 cooperates with Snail1 in the repression of vitamin D receptor in colon cancer[J].Carcinogenesis,2009,30(8):1459-1468.
11 Larriba MJ,Valle N,Pálmer HG,et al.The inhibition of Wnt/beta-catenin signalling by 1alpha,25-dihydroxyvitamin D3 is abrogated by Snail1 in human colon cancer cells[J].Endocr Relat Cancer,2007,14(1):141-151.
12 Vandewalle B,Adenis A,Hornez L,et al.1,25-dihydroxyvitamin D3 receptors in normal and malignant human colorectal tissues[J].Cancer Lett,1994,86(1):67-73.
13 Peña C,García JM,García V,et al.The expression levels of the transcriptional regulators p300 and CtBP modulate the correlations between SNAIL,ZEB1,E-cadherin and vitamin D receptor in human colon carcinomas[J].Int J Cancer,2006,119(9):2098-2104.
14 Peña C,García JM,Larriba MJ,et al.SNAI1 expression in colon cancer related with CDH1 and VDR downregulation in normal adjacent tissue[J].Oncogene,2009,28(49):4375-4385.
