AGO1基因对拟南芥叶边缘锯齿状发育的影响
2014-10-20李素芬冀芦沙
李素芬,赵 燕,冀芦沙
(1.聊城大学生命科学学院,山东聊城 252000;2.聊城大学农学院,山东聊城 252000)
叶是植物体的基本营养器官之一,在植物的生命活动中起着重要作用,研究植物叶的发生、发育的分子机理,是发育生物学的一个重要课题。叶片发育的阶段大致可分为叶原基的起始和叶极性的建立。叶原基是在茎的顶端分生组织(shoot apical meristem,SAM)中形成的。叶极性的建立是叶发育的核心环节。ZILBERMAN等的新细胞决定理论认为,叶边缘锯齿、叶卷曲是某些直接或间接影响细胞分裂或生长分化的基因突变造成的[1]。从叶形成的分子机制上看,SAM细胞及周边细胞的发育形成叶原基,叶原基产生极性分化并从细胞分裂状态转入细胞生长阶段,平展、正常的叶片逐渐形成。控制这一发育进程的一系列基因的突变及影响细胞分裂、生长分化的因素都有可能使叶发育异常,产生卷曲、锯齿状等异型叶片[1]。
近年来研究表明,AGO1基因在植物叶极性的分化方面具有重要的调节作用。通过对AGO1基因进行突变研究,发现AGO1基因能通过靶向作用于TCP转录因子基因家族来调控植物叶形态建成[2]。AGO1基因在芽顶端组织、花器官和果实中表达,AGO1基因过表达突变体产生叶片卷曲、花发育异常、叶片偏上生长、果实畸形等异常表型。西红柿中,LA基因编码一个包含AGO1基因的转录因子,AGO1基因通过介导LA基因调控叶边缘细胞发育。LA表达水平升高,导致叶边缘发育异常化;降低LA表达水平,则使叶边缘细胞持续生长。
AGO蛋白参与RISC复合体的形成,选择性的招募microRNAs和siRNAs参与RNA沉默,是PTGS中RISC的催化发动机。另外,AGO蛋白的一个很重要的功能是催化RISC对靶RNA的特异性切割。有研究表明,这个切割作用是由PIWI这个结构域来完成的。PIWI与RNase H具有相似的结构特征[3],可以发挥核酸内切酶活性以切割靶RNA。除了提供催化RISC切割活性外,PIWI结构域中还存在一个可以直接与Dicer结合的区域,AGO蛋白可能就是以此为结构基础通过与Dicer互作而进入RISC装配过程的[4]。此外,AGO是构成RdDM复合物重要成分,在异染色质的沉默及传播中是必需的。
在拟南芥中,AGO家族有10位成员,其中AGO1调节叶片发育,参与PTGS,可能是各种RNA剪切途径剪切器的组分,是拟南芥中唯一参加miRNA生物途径的AGO蛋白,AGO1在体外可以结合miRNA并催化靶基因的剪切[2];AGO4参与转座子和反向重复序列的DNA甲基化[5],是维持异染色质的必需因子,而且AGO4可以催化产生次级siRNA(secondary siRNAs)以放大沉默信号[6];AGO6主要招募与异染色质有关的siRNAs,在DNA甲基化和TGS途径中起重要作用[7];AGO7(又称ZIPPY)主要调节植物发育时速,是某些ta-siRNAs沉默复合体的形成所必需的[8-9]。
本实验以野生型拟南芥为背景克隆出编码AGO1蛋白的基因[8]。构建基因获得AGO1植物表达载体pBI121-AGO1,利用农杆菌介导的方法转化拟南芥,通过抗性筛选,获得转基因植株。并通过对转基因植株进行表型观察及AGO1蛋白的RT-PCR检测,以确定拟南芥中AGO1的功能。本实验为后续AGO1基因在拟南芥中功能的鉴定提供了有利的研究基础。
1 材料与方法
1.1 材料
1.1.1 拟南芥来源
拟南芥(Arabidopsisthaliana)栽培品种Columbia。
1.1.2 质粒与菌株
E.coliDH5α,BL21,克隆载体pGEM18-T Simple,由 Takara公司提供;P.pastorisGS115,pPIC9,pPIC9K,pF41,均由Clontech公司提供。
1.1.3 酶与试剂
限制性内切酶(NotⅠ,SalⅠ),T4DNA ligase,RNase A,IPTG,X-Gal,DNA Marker DL 2000,TagDNA聚合酶,DNA凝胶回收试剂盒(PCR Fragment Recovery Kit),质粒微量提取试剂盒,RNA PCR Kit(AMV)Ver.3.0,均购自宝生物(大连)公司。Trizol试剂购自Invitrogen公司。其他试剂为分析纯。
1.2 方法
1.2.1 拟南芥总RNA的提取及反转录
参照Trizol说明书从生长4周大的野生型拟南芥中提取总RNA,将RNA溶于20μL含DEPC水中。按照RNA PCR Kit(AMV)Ver.3.0试剂盒取2μL总RNA进行反转录得10μL cDNA[9]。
1.2.2 引物设计
根据TAIR网站中AGO1基因编码区序列以及酵母表达载体pPIC9K上的多克隆位点,通过Primer Premier 5.0软件设计3对引物 P1:5′—ATGCCGGTTCAGTAGGAGGAGTCGC—3′;P2:5′—CATAAGCTCGACATTGCTTCCACCAACC—3′;P1GUS:5′—CGCATGATTGAACAAGATG—3′;P2GUS:5′—TCCCGCTCAGAAGAACTCGTC—3′。
1.2.3 质粒表达载体的构建
将AGO1基因的PCR回收产物和pET30空载体以EcoRⅠ和XhoⅠ双酶切,37℃水浴过夜后,进行琼脂糖(质量浓度10g/L)凝胶电泳并回收,然后在T4DNA连接酶作用下室温连接4h,转化E.coliDH5α,通过氨苄青霉素(Amp+)抗性筛选得到AGO1基因的重组子。挑取阳性克隆小提质粒DNA并双酶切鉴定。运用BamHⅠ和EcoRⅠ双酶切重组质粒,将AGO1基因片段连入双元表达载体pBI121(35S::GUS),与GUS融合蛋白,然后在T4DNA连接酶作用下室温连接4h,转化大肠杆菌DH5α,通过卡那霉素(Kan+)抗性筛选得到重组子。
1.2.4 转基因拟南芥筛选
鉴定正确的质粒转化农杆菌株GV3101,涂布于Kan+抗性的LB平板37℃过夜培养。PCR鉴定阳性克隆。然后挑取阳性单克隆于2mL LB中,37℃230r/min振荡培养过夜。次日5 000g离心5min,去上清收集菌体,加入5mL质量分数5%的蔗糖溶液重悬。运用浸花法侵染野生型拟南芥,在含50μg/mL(质量浓度)卡那霉素的MS培养基上筛选T1代,取T1代和野生型植株的叶片提取DNA,以野生型为阴性对照进行PCR鉴定,选取阳性株系。取阳性植株的T1代种子为实验材料。
1.2.5 转基因拟南芥拷贝数检测
选用T1代叶片边缘为锯齿状稳定表型的5个转基因拟南芥株系中各15棵拟南芥为遗传材料,采用CTAB法提取T1代拟南芥基因组DNA。事先选取已证明为单拷贝纯合体的转基因拟南芥植株基因组DNA样品为对照,分别设计特异引物单独扩增内源基因(α-tubilin)和外源基因(NPTⅡ),结果显示内源基因和外源基因具有相似的扩增效率。因α-tubilin特异性引物,上游引物:5′-AGAAGAGCCTTTGCTGGCC-3′(P1),下游引物:5′-CCAACAATCTATCAGCCACG-3′(P2),目的片段大小为791bp;同时设计了外源基因NPTⅡ(新霉素磷酸转移酶Ⅱ基因)的特异性引物,上游引物:5′-ACAATCGGCTGCTCTGATG-3′(P1),下游引物:5′-TCAGAAGAACTCGTCA AGAAG-3′(P2),目的片段大小为741bp。对PCR扩增反应最佳循环数确定在20~25之间[10]。因此本实验中,以拟南芥核基因组上单拷贝内源基因为内参,与核基因组上插入的外源基因一起以提取的转基因拟南芥植株基因组DNA为模板,置于单一PCR管中同时进行聚合酶链式反应(PCR)。PCR最佳反应体系:94℃,3min,1个循环;94℃30s,56℃30s,72℃1min,24个循环。反应产物经琼脂糖凝胶电泳,在凝胶成像系统下呈现出外源基因和内源基因两条目的片段大小不同的条带,照相保存。将图片置于ImageJ软件下,捕捉分析两条目的条带的灰度比。同时该实验在相同条件下重复3次。
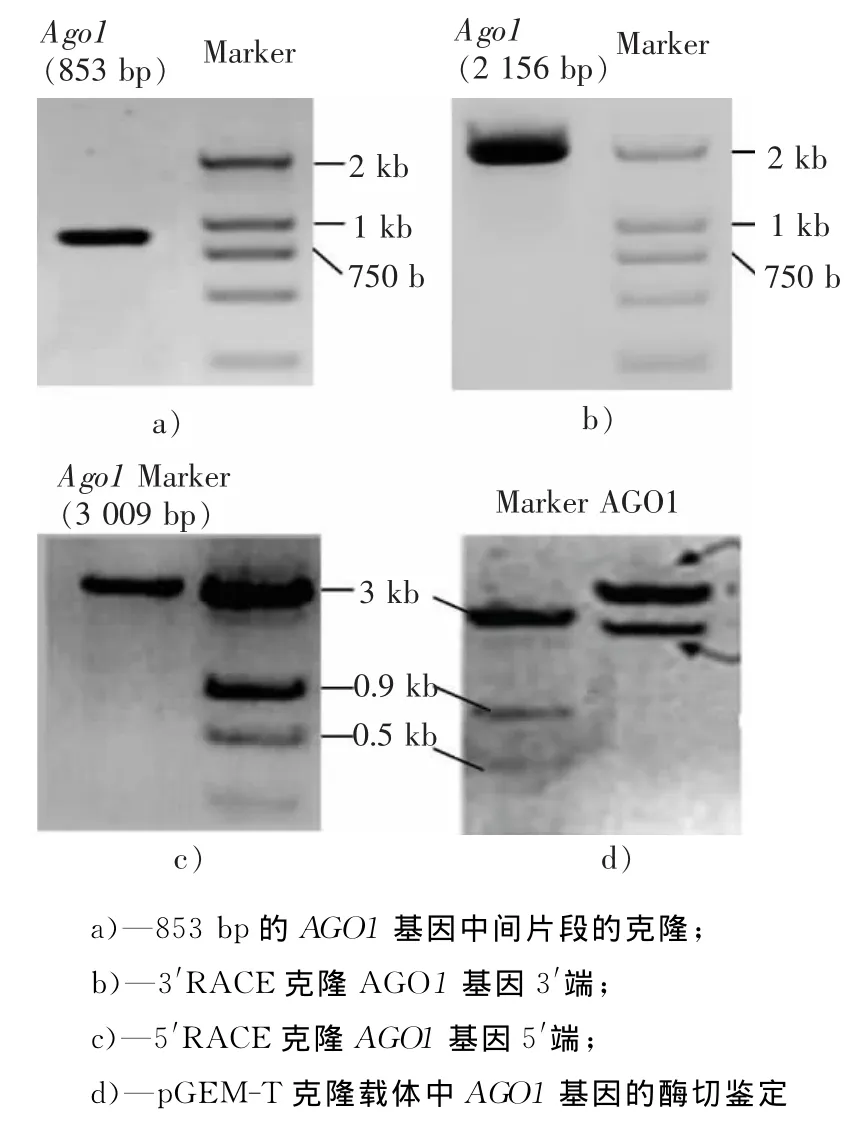
图1 拟南芥AGO1基因全长序列的克隆及测序Fig.1 Cloning and sequencing of the full-length Arabidopsis AGO1 gene
2 结果与分析
2.1 拟南芥AGO1基因的克隆及鉴定分析
本实验以拟南芥野生型Columbia品种叶片总RNA反转录产物为模板,使用Pfx高保真聚合酶,能够很好的扩增AGO1基因的相关序列。由于拟南芥基因组已知,根据TAIR网站上发布的AGO1基因序列设计5′端特异引物特异扩增AGO1基因5′端,经生工测序得该片段长853bp(见图1a)),且测序结果检测显示该片段包含AGO1基因转录起始位点ATG。随即在基因的ORF去设计3′RACE引物对AGO1基因3′进行扩增,得到所示长度为2 156bp(见图1b))的AGO1基因序列,最终得到3 009bp的全长(见图1c))。对获得的克隆进行了全长的测序(生工测序),得到了无突变的克隆,通 过 与 NCBI/TAIR 网 站 注 册 的AGO1基 因(At1g48410)进行比对,两者的同源性高达96%(比对结果见图1)。证实本实验克隆的基因为拟南芥AGO1基因。AGO1全长cDNA基因使用了在PCR产物3′端添加A碱基后,做T-A克隆的办法,将基因的全长cDNA序列克隆至pGEM T-easy克隆载体中,对连接后的载体进行酶切验证(见图1d))。
2.2 重组表达载体pBI121-AGO1的构建
35S启动子在单子叶和双子叶植物中可以高效启动外源插入片段的组成型表达。本实验用XbaⅠ,BamHⅠ双酶切将外源AGO1基因插入到植物高效表达载体pBI121的35S启动子与GUSA报告基因之间,得到如图2a)所示的AGO1基因的高效表达载体,使AGO1-GUS融合蛋白在植物体内得以高效表达。图2b)为XbaⅠ和SalⅠ酶切鉴定结果。该载体含有卡那霉素(Kanamycin)抗性基因,转化拟南芥以后可以用卡那霉素筛选农杆菌转化体(GV3101-AGO1)。农杆菌浸染植株后,该pBI121载体上左右边界序列(LB及RB)之间的T-DNA区段将随机整合入外植体基因组中,进而得以转录表达。
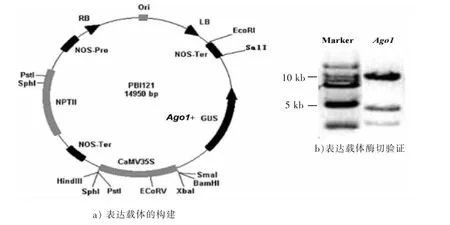
图2 重组表达载体pBI121-AGO1的构建Fig.2 Recombination of the pBI121-AGO1 vector
2.3 农杆菌侵染后抗性转基因植株的筛选情况及RT-PCR分析
侵染后的拟南芥植株成熟以后收获的T1代种子,经过消毒,播种在GM抗性培养基上(含 Kanamycin质量浓度50mg/mL),4 ℃春化后放在长日照条件下进行萌发,筛选出抗性植株共34棵。将其进行基因组PCR检测GUSA基因,共筛选到pBI121-AGO1植株15棵。图3为34棵T1代卡那抗性株系中对GUSA基因片段(750bp)进行扩增后筛选出的15棵AGO1转基因植株。转基因拟南芥在抗性培养基上萌发6~8d后将抗性苗移至营养基质中生长。图4a)所示为2周及4周后转基因拟南芥的生长情况。如图4b)所示为相应的拟南芥RT-PCR分析AGO1的表达情况,Tubulin基因表达情况以及提取的总RNA作对照。
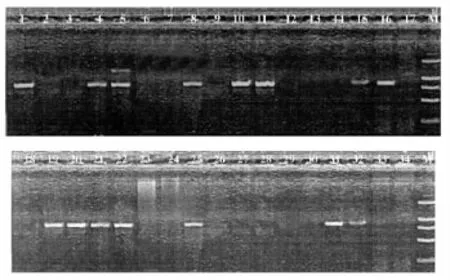
图3 转基因拟南芥的PCR鉴定Fig.3 PCR Amplification of the transgenic Arabidopsis
2.4 T1代转基因植株表型观察
把T1代转基因拟南芥在抗性培养基上萌发6~8d后将抗性苗移至营养基质中生长4周,以观察地上部分表型(如图5)。与野生型相比,在15个转AGO1基因的株系中有5个株系拟南芥出现明显叶片细长,呈锯齿状。
2.5 T1代转基因拟南芥株系的拷贝数检测
为了鉴定携带单拷贝外源基因的转基因拟南芥植株,以拟南芥核基因组上已知的单拷贝内源基因(αtubulin)为内参,转基因拟南芥植株基因组DNA为模板,在同一PCR反应体系中扩增内源基(α-tubulin)和外源目的基因(NPTⅡ),循环数为22,反应产物在琼脂糖凝胶上电泳,获得了预期大小的2条特异性扩增条带(见图6)。从以上5个株系中选取10株转基因拟南芥植株,经ImageJ软件捕捉分析两条目的条带的灰度比,实验发现除1号转基因株系外,其他转基因株系中外源基因与内源基因的扩增条带灰度比均为1,及初步说明检测植株即为单拷贝外源基因的转基因拟南芥植株。1号转基因拟南芥的灰度比为1.8,有待孟德尔遗传实验的进一步验证。
3 讨 论

图4 转基因拟南芥的表型及RT-PCR分析Fig.4 Phenotype and RT-PCR analysis of the transgenic Arabidopsis
3.1 克隆全长基因的过程中需要注意的问题
1)保证PCR模板的质量 这就要求从RNA的提取开始,每一步都要保证质量,只有获得高质量的反转录产物,才能保证能够扩增出目的基因。
2)选择合适的DNA聚合酶和合适的PCR反应条件 一种合适的PCR聚合酶,既要有较高的酶活力,又要有较高的保真度。经过多次实验摸索,笔者选择了Invitrogen公司的Pfx高保真DNA聚合酶,该酶的保真度较高,同时酶活力也足以满足扩增3kb基因的需要。PCR反应条件也是一个很重要的方面,主要的因素有退火温度、延伸时间、扩增循环数等,这些都需要经过反复实验来获得最优化的方案。
3)选择合适的RACE引物扩增基因全长常规意义上运用RT-PCR技术克隆全长基因,首先扩增的是基因的中间片段,其次是设计特有的5′端和3′端的特异引物对基因的全长进行有效克隆。由于拟南芥基因组中AGO1基因序列已知,实验设计之初在AGO1基因5′端设计特异引物对其进行扩增,获得853bp中间片段。根据所得到的中间片段,设计引物3′-RACE嵌套式引物。同样摸索引物组合及退火温度。最后实验得到用5′引物和B26引物做第1次PCR,退火温度选择较低的50℃;PCR产物稀释1 000倍后作为模板,以5′引物和B25为引物进行第2次PCR,退火温度提高到54℃。测序结果得到目的条带。

图5 叶片为锯齿状的T1代转基因拟南芥照片Fig.5 T1transgenic Arabidopsis with the serration margin leaves
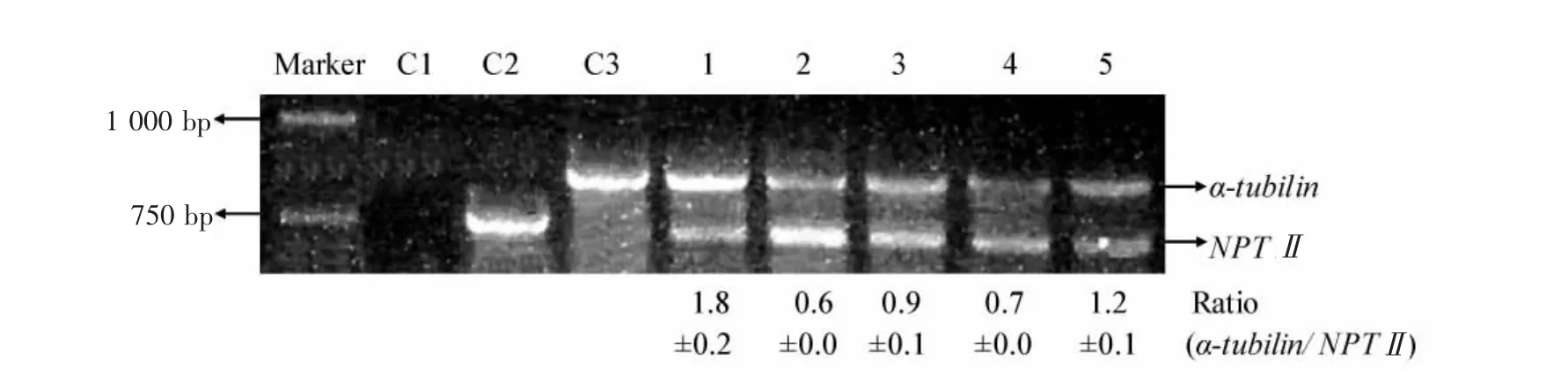
图6 单拷贝外源基因的转基因拟南芥鉴定Fig.6 Identification of transgenic plants carrying a single copy of integrated T-DNA
4)确定最佳的连接反应和酶切反应的时间 有文献报道,连接反应的反应时间为48h,笔者的结果显示,连接12h已经足够,过长的时间毫无必要,反而延长实验的周期。若酶切反应不完全,或酶切后末端有复性会造成载体自身环化,平板上长出大量阴性菌落,降低了连接效率,给挑去阳性菌落带来很大困难,因此应尽量延长酶切时间,保证酶切彻底,酶切反应的时间至少1.5h。
3.2 转基因方法的选择
植物表达载体构建好后,下一步即为基因转化工作。将目的基因导入靶植物细胞内,使其整合到植物基因组,使目的基因成为转基因植物基因组的有机组成部分,并进行可遗传的表达。目前,基因转化的方法主要有农杆菌介导法和DNA直接转化法。DNA直接转化法包括:PEG介导基因转化法、基因枪法、电激法等。
与DNA直接转化法相比,农杆菌介导法具备很多明显的优点。在转化质量方面,农杆菌转化的DNA结构完整、整合位点较稳定、拷贝数低、转化的片段较大(可达50kb)、转化机理清楚、整合后的外源基因结构变化较小[9]。而DNA直接转化法,DNA结构变化较大,会发生DNA甲基化、环化,片段分离和丢失、重排等,此外转入基因拷贝数高,由此而引起的甲基化会造成基因表达沉默。在转化效率方面,DNA直接转化法效率比较低,为0.01%~1%,而农杆菌介导法的转化效率约为0.1%~5%,甚至更高。此外,农杆菌介导的转化方法与DNA直接转化法相比,在转化和筛选上有简易性[10]。
当然,农杆菌介导转化也存在一些缺点,比如农杆菌感染过程会对植物组织造成损伤,T-DNA整合如植物基因组时边界可能会发生截短;T-DNA可能以串联形式整合;甲基化等原因造成基因转化后失活;转移到T-DNA区的2个基因未必共表达等。但是瑕不掩瑜,随着研究工作的深入,农杆菌介导法很可能会广泛应用于植物基因的转化。
基于以上分析,笔者选择了农杆菌介导的方法,转化拟南芥植株。
3.3 影响农杆菌介导的双子叶植物基因转化效率的因素
1)启动子 设计植物转化方案所要考虑的一个非常重要的因素是启动子的选择。本实验中笔者选用的是CaMV35S启动子,这种启动子在所有组织中都启动基因表达,具有持续性,不表现时间和空间的特异性;相对恒定的表达RNA和蛋白质。
2)植物基因型 不同双子叶植物对农杆菌的敏感程度不同,甚至同一种双子叶植物的不同品种对农杆菌的敏感程度也会大不相同。Columbia型拟南芥对农杆菌较敏感,转化效率较高。
3)筛选用抗生素 筛选时所用的不同抗生素对于转化的细胞会有不同的伤害作用,从而使转化效率受到影响。在筛选方案中应选用对敏感细胞伤害大而对转化细胞伤害小的抗生素作为筛选剂,既要保证较高的筛选效率又要保证较高的转化效率。本实验所采用的表达载体含有卡那霉素(Kanamycin)抗性基因,因此转化以后可以用卡那霉素作为农杆菌的筛选剂。
4)农杆菌菌株类型 不同菌株对同一种植物的感染能力不同。本实验采用的根癌农杆菌(Agrobacteriumtumefaciens)GV3101已被初步证明感染后的拟南芥能力较强。
5)表面活性剂的选择 转换用的表面活性剂Silwet L-77能促进农杆菌吸附于外植体表面,促进TDNA的转移,在最佳质量分数0.02%时可以使侵染效率提高到4倍[8]。
4 实验结论
通过提取总RNA进行RT-PCR,及PCR方法成功克隆了AGO1基因。利用农杆菌介导花序浸泡法成功获得了转基因拟南芥植株。RT-PCR分析转基因植株显示,转基因植株生长2周时AGO1蛋白的表达量明显多于非AGO1基因转基因植株,在第4周时对照转基因植株与AGO1基因转基因植株中AGO1蛋白的表达量基本相当,但比野生型植株表达量多。从获得的T1代超表达AGO1基因转基因拟南芥的表型可以看出,超表达AGO1基因转基因拟南芥叶片明显成锯齿状,说明AGO1基因对拟南芥叶片发育有影响[11-12]。超表达AGO1基因转基因拟南芥叶片的锯齿状表型与已报道的拟南芥AGO1基因突变体表型相近,至于产生这一表型的原因仍需进一步验证。在15个转AGO1基因的株系中仅有5个株系拟南芥出现明显叶片细长,呈锯齿状。对以上5个转基因植株拷贝数检测,发现除1号株系以外其他4个株系均为单拷贝插入,从实验水平上证实,转基因株系叶片锯齿状表型并不是由于多拷贝数的外源基因在转录翻译过程中的基因沉默而引起的。表型观察发现1号转基因株系叶片锯齿状程度明显低于其他4个株系。此外,本次实验目的在于以实验所得的转有AGO1基因的转基因拟南芥为实验材料,仅以分析AGO1在植物发育,响应外源胁迫及相关途径中的作用。为进一步分析miRNA作用机理及RNAi介导的作用通路提供材料支撑。
AGO1基因是小RNA功能途径中一个关键的基因,目前对于AGO1基因功能的研究已经取得了一些成果。以往的研究多是基于遗传学手段,从突变体入手,从表型来鉴定基因的功能。使用这一办法确实取得了一些成果[13-14]。但是,随着研究的深入,问题逐渐暴露出来:首先,在大多数物种中,AGO1基因家族都是有多个成员组成的,这些成员之间势必存在着功能上的冗余,这就为遗传学研究带来了很大的困难,以拟南芥为例,在拟南芥目前已经鉴定的10个AGO1基因中仅有AGO1,AGO4,AGO7等基因有了明确的功能研究[15],其余的功能至今未知;其次,小RNA发挥功能过程,不仅仅是几个基因的作用,还有很多基因参与其中,这其中就有一些是我们还未知的[4];最后,小RNA的行使功能的过程,并不仅仅是蛋白组分发挥作用,其中还有小RNA本身。基于上述原因,建议从生物化学的角度出发,结合分子生物学手段来解决这些问题。
[1] ZILBERMAN D,CAO X F,JACOBSEN S E.ARGONAUTE4control of locus-specific siRNA accumulation and DNA and histone methylation[J].Science,2003,299(5607):716-719.
[2] GRISHOK A,PASQUINELLI A E,CONTE D,et al.Genes and mechanisms related to RNA interference regulate expression of the small temporal RNAs that controlC.elegansdevelopmental timing[J].Cell,2001,106(1):23-24.
[3] MA J B,YE K,PATEL D J.Structural basis for overhang-specific small interfering RNA recognition by the PAZ domain[J].Nature,2004,429(6989):318-322.
[4] 宋雪梅,燕 飞,杜立新.RNA诱导沉默复合体中的生物大分子及其装配[J].遗传,2006,28(6):761-766.
SONG Xuemei,YAN Fei,DU Lixin.Components and assembly of RNA-induced silencing complex[J].Hereditas:Beijing,2006,28(6):761-766.
[5] 王 鹏,赵显军,朱国萍.植物 RNA沉默的分子机制研究进展[J].生命科学,2008,20(5):784-789.
WANG Peng,ZHAO Xianjun,ZHU Guoping.Progress in molecular mechanism of RNA silencing in plants[J].Chinese Bulletin of Life Sciences,2008,20(5):784-789.
[6] PERAGINE A,YOSHIKAWA M,WU G,et al.SGS3andSGS2/SDE1/RDR6are required for juvenile development and the production oftrans-acting siRNAs inArabidopsis[J].Genes &Development,2004,18:2368-2379.
[7] 奥斯伯F,布伦特R,金斯顿R.精编分子生物学实验指南[M].第3版.颜子颖,王海林,译.北京:科学出版社,1998.
AUSUBEL F,BRENT R,KINGSTON R.Short Protocols in Molecular Biology[M].3rd ed.Translated by YAN Ziying,WANG Hailin.Beijing:Science Press,1998.
[8] CLOUGH S J,BENT A F.Floral dip:A simplified method for agrobacterium-mediated transformation of arabidopsis thaliana[J].The Plant Journal,1998,16(6):735-743.
[9] CHENG M,FRY J E,PANG S,et al.Genetic transformation of wheat mediated by agrobacterium tumefaciens[J].Plant Physiology,1997,115(3):971-980.
[10] 宋 锋,孙 敏,罗克明.一种基于PCR技术鉴定单拷贝转基因烟草的方法[J].中国生物工程杂志,2010,30(4):83-88.
SONG Feng,SUN Min,LUO Keming.A simple and rapid PCR-based method for identifying transgenic tobacco plants carrying a single copy of the integrated gene[J].China Biotechnology,2010,30(4):83-88.
[11] 王文婧,刘 婷,郭 磊,等.SLC/AGO1基因控制拟南芥细胞分裂与定向伸长[J].植物学报,2011,46(4):370-378.
WANG Wenjing,LIU Ting,GUO Lei,et al.SLC/AGO1coordinates cell division and expansion in arabidopsis[J].Bulletin of Botany,2011,46(4):370-378.
[12] CARBONELL A,FAHLGREN N,GARCIA-RUIZ H A,et al.Functional analysis of threearabidopsisARGONAUTES using Slicer-defective mutants[J].Plant Cell,2012,24(9):3613-3629.
[13] 胥 猛,谢雯凡,潘惠新,等.杨树ARGONAUTE基因的克隆及序列分析[J].林业科学,2011,47(3):46-51.
XU Meng,XIE Wenfan,PAN Huixin,et al.Cloning and characterization ofARGONAUTEgenes in populus[J].Scientia Silvae Sinicae,2011,47(3):46-51.
[14] de ALBA A E M,JAUVION V,MALLORY A C,et al.The miRNA pathway limits AGO1availability during siRNA-mediated PTGS defense against exogenous RNA[J].Nucleic Acids Research,2011,39(21):9339-9344.
[15] 杨燕燕,石林丹,王 西,等.本生烟AGO2全长基因的克隆及序列分析[A].中国植物病理学会2012年学术年会论文集[C].青岛:中国植物病理学会,2012.65-69.
YANG Yanyan,SHI Lindan,WANG Xi,et al.The smokeAGO2fail full-length gene cloning and sequence analysis[A].Chinese Society for Plant Pathology,2012Academic Essays[C].Qingdao:Chinese Society for Plant Pathology,2012.65-69.
