酿酒酵母细胞壁合生元对肉仔鸭肠道结构的影响
2014-10-19冯治敏伍金娥王学东张敬明
常 超*, 冯治敏, 王 琨, 伍金娥, 王学东, 张敬明
(1.武汉轻工大学食品科学与工程学院,湖北武汉 430023;2.武汉科诺生物有限公司,湖北武汉 430074)
胃肠道在营养成分的消化和吸收方面发挥着核心作用。胃肠道上分布着大量的微生物菌群,在黏膜层上形成一道防御屏障,肠上皮细胞能分泌一种糖蛋白,可减少肠道细菌在肠壁上黏附(Blomberg等,1993)。另外,胃肠道上天然存在着不同类型的有益菌和致病菌,当病原微生物的数量过多时,就可能损害动物的健康,导致肠道炎症的发生,从而降低动物生产性能,增加死亡率。甘露糖和酵母细胞壁已被证明与具有Ⅰ型菌毛的致病菌(如沙门杆菌、大肠杆菌)对肠壁的黏附作用有较强竞争力。在饲料中添加酵母细胞壁,不仅能改变肠道内益生菌和病原菌的比例,并且通过增加杯状细胞的数量和大小,改善肠道形态学,对肠道的健康起着积极的影响 (Dimitroglou等,2009;Shen等,2009)。本试验通过研究合生元对樱桃谷肉鸭肠道结构的影响,为进一步合理利用合生元提供理论依据。
1 材料与方法
1.1 试验动物及日粮 选1日龄樱桃谷肉鸭200羽(由湖北春江鸭厂提供),随机分成4组,每组5个重复,每个重复10羽。对照组饲喂基础日粮,抗生素组饲喂基础日粮中添加 4 mg/kg黄霉素,复合芽孢菌组饲喂基础日粮中添加2 mg/kg黄霉素和1×106cfu/g复合芽孢菌,合生元组饲喂基础日粮中添加2 mg/kg黄霉素、0.5×106cfu/g复合芽孢菌和0.3 g/kg酵母细胞壁。芽孢杆菌及多糖的用量是综合考虑前人试验效果及添加成本来调整的。试验期35 d,其中1~2周为试验前期,3~5周为试验后期。各期基础日粮组成及营养水平见表1。试验鸭于室内同一环境下散养。每个重复1栏,24 h光照,每天喂料2次,自由采食和饮水,每天记录饲料投放量和剩余量,每天清洗饮水器和料槽1次。免疫接种及疾病预防、消毒按常规方法进行。
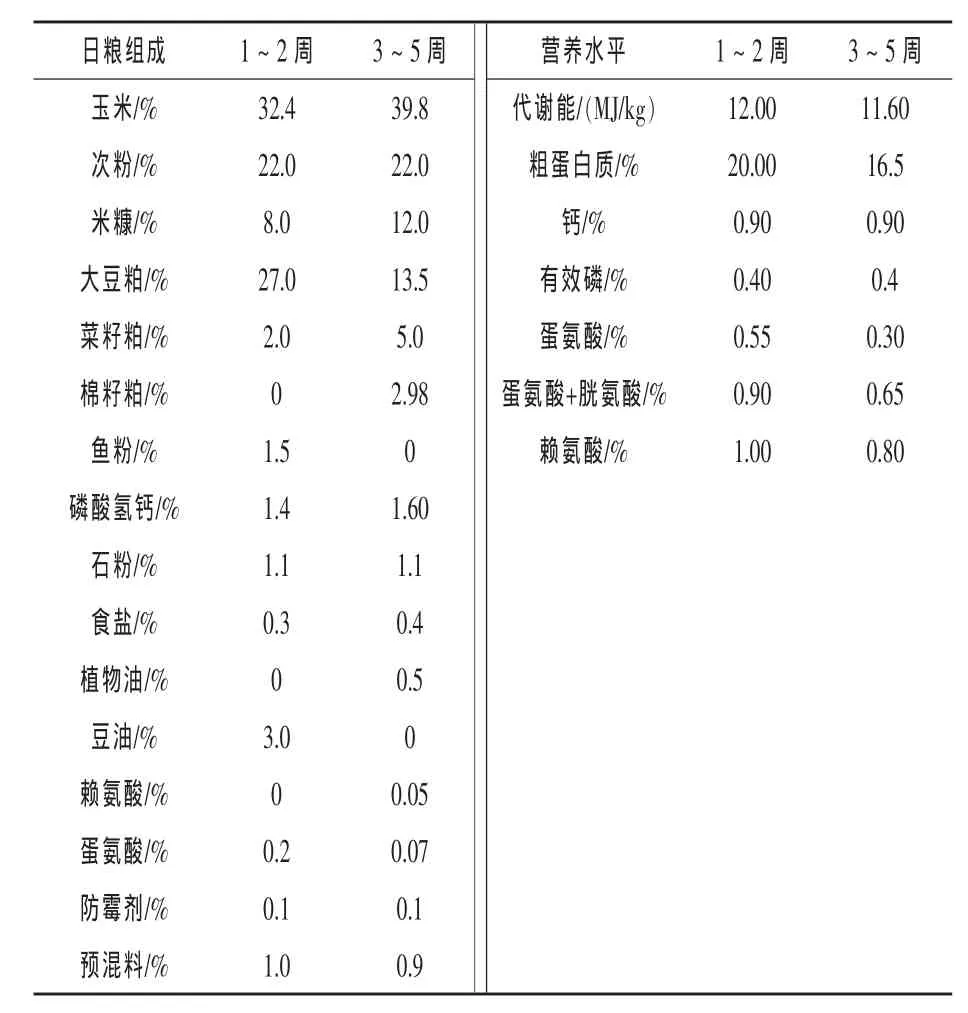
表1 基础日粮组成及营养水平(风干基础)
1.2 样品采集及测定 选取35日龄各试验组和对照组鸭各8只,屠宰后分离肠段,用温热生理盐水小心冲洗至无肠内容物后,取十二指肠、空肠中段及回肠中回盲瓣前端2 cm处,约2 cm肠段用生理盐水冲洗干净,置于10%福尔马林溶液中固定;将固定好的肠段制作组织切片;选取3张绒毛完整,走向平直的组织切片,对比观察肠黏膜和肠绒毛组织形态的变化,使用Nikon荧光生物显微镜并应用爱普图像处理分析软件4.0测定每个视野中3条最长绒毛长度及隐窝深度。
1.3 数据处理与分析 利用Excel进行数据整理,采用SPSS 16.0软件中的平衡试验设计方差分析过程(Anova)进行数据统计分析,均值的多重比较采用Duncan’s法,结果采用 “平均值±标准差”表示。
2 结果与分析
2.1 合生元对十二指肠组织形态的影响 由表2可知,合生元组对刺激十二指肠绒毛的生长并未表现出明显的作用,与对照组相比无显著差异(P>0.05)。隐窝深度方面,合生元组与对照组、抗生素组相比无显著差异(P>0.05),较复合芽孢菌组降低了11.80%(P<0.05)。绒毛长度/隐窝深度的比值(V/C)方面,合生元组较其他三组差异均不显著(P>0.05)。表明合生元对十二指肠生长发育无显著影响。

表2 合生元添加剂对肉鸭十二指肠结构的影响(n=24)
2.2 合生元对肉鸭空肠结构的影响 由表3可知,在空肠部分,抗生素组、复合芽孢菌组和合生元组组间绒毛长度无显著差异(P>0.05),但在降低隐窝深度方面,合生元组较对照组、抗生素组、复合芽孢菌组分别下降12.93%、13.31%和14.00%(P<0.05)。V/C值方面,各组间无显著差异(P>0.05),但合生元组较对照组略高出5.13%(P>0.05)。
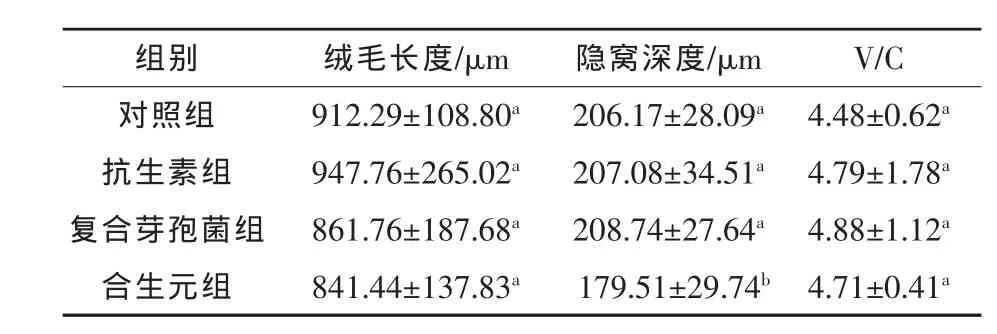
表3 合生元添加剂对肉鸭空肠结构的影响(n=24)
2.3 合生元对肉鸭回肠结构的影响 由表4可知,在回肠部分,合生元组作用于回肠效果明显,回肠绒毛长度较对照组、抗生素组与复合芽孢菌组分别增加了1.46%(P > 0.05)、11.65%(P >0.05)、27.09%(P < 0.05)。 合生元组、复合芽孢菌组隐窝深度较对照组分别下降3.65%、14.18%(P>0.05),合生元组V/C较对照组、抗生素组和复合芽孢菌组分别增加13.06%(P>0.05)、27.85%(P< 0.05)和 19.73%(P< 0.05)。合生元组处理的回肠肠绒毛粗壮且排列整齐、紧密,皱褶增多,此结果综合表明,回肠上皮细胞成熟率上升,吸收功能增强,回肠是合生元作用的主要肠道位点,合生元具有改善回肠消化吸收的能力。
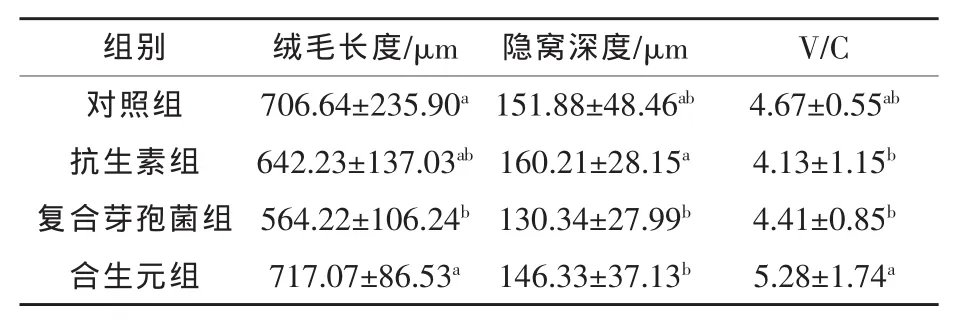
表4 合生元添加剂对肉鸭回肠结构的影响(n=24)
3 讨论
近年来,随着微生态研究的飞速发展,家禽的肠道健康已引起越来越多学者的高度重视。家禽小肠黏膜的结构和状态显示着其肠道的健康水平,与自身的快速生长及抗病防病有着重要的关系。因此,维持健康状态或修复病理状态下肠道结构和功能的完整性,保持肠道健康已成为家禽健康生产的关键所在。小肠内容物中的有毒物质会影响小肠微绒毛的长短和小肠上皮细胞的生长。肠绒毛的数量、长度和形态结构很大程度上决定消化道的消化吸收功能(杨玉荣等,2006)。小肠绒毛是营养物质吸收的主要组织,绒毛的长度与其肠上皮细胞数量呈正相关,绒毛短时,成熟的绒毛细胞减少,对营养成分的吸收能力降低。隐窝深度是反映肠上皮细胞生成率的指标。正常状态下,小肠隐窝基部的上皮细胞不断增殖,并向绒毛上皮移行,同时伴随着具有吸收能力的肠上皮细胞的分化、成熟和衰老,不断修复着正常脱落的肠上皮。如果此过程减慢,则隐窝变深。因此,隐窝变浅意味着肠上皮细胞成熟率增加,其分泌和吸收功能增强。绒毛长度/隐窝深度的比值(V/C)综合反映小肠的功能状况,比值下降,表示黏膜受损,消化吸收功能降低,常伴有腹泻的发生,动物生长发育受阻;比值上升,则黏膜改善,消化吸收功能增强,腹泻率降低,生长发育加快 (伍金娥等,2011;Santin 等,2001)。 众多的试验证明,合生元制剂能调整、维持肠道内正常微生物菌群平衡,减少肠道内氨、胺等毒害物质的产生,增强动物免疫功能,促进肠道消化吸收,从而达到防病治病、提高饲料转化率和动物生产性能的目的(王学东等,2012;郝光等,2008;井明艳和赵树盛,2005)。综合本试验的结果来看,合生元降低了空肠的隐窝深度,提高了回肠的绒毛长度,其绒毛长度/隐窝深度的比值(V/C)较对照组有不同程度的提高,研究表明,使用的合生元替代了商业日粮中添加的50%抗生素后,对肉鸭的肠道结构具有积极的改善作用。
合生元组作用的肠段部位表现出明显差异,与对照组相比并未表现出显著的刺激十二指肠和回肠绒毛的增长,未能有效刺激十二指肠的肠细胞成熟与分化。Santin(2001)等在肉鸡的基础饲料中添加0.2%酵母细胞壁饲喂1日龄肉鸡的生长试验,并开展了对各肠道绒毛长度和隐窝深度的研究。结果显示,0.2%酵母细胞壁具有促进生长、提高饲料利用率的作用;与对照组相比,饲喂酵母细胞壁处理组的十二指肠、回肠绒毛长度和隐窝深度及其绒毛高度/隐窝深度并未表现出显著影响,只有在空肠部分表现出显著增加。本研究中,在促进绒毛生长和促进上皮细胞成熟率方面,合生元作用回肠的效果最佳。究其原因可能在于,一是本试验中制备的是酵母细胞壁与复合芽孢菌的合生元,导致了其作用位点与之不一样。二是本试验中试验动物为鸭,是否存在动物的种属差异,有待进一步确证。但是在降低隐窝深度方面表现出独特优势,加速了上皮细胞的成熟与分化,该结果与 Santin(2001)等研究一致。
本研究中发现,合生元组的绒毛高度/隐窝深度指数要优于复合芽孢菌组,这说明在复合芽孢菌组中添加酿酒酵母细胞壁具有增强益生菌的效果,能够促进肠细胞的分化、生长,增强消化吸收功能,从而提高饲料转化率和动物生产性能。
[1]郝光,王振国,王雪飞,等.合生元的研究进展[J].中国微生态学杂志,2008,20(5):511 ~ 513.
[2]井明艳,赵树盛.益生素和益生元在营养和健康中的新观念[J].现代食品科技,2005,42(15):93 ~ 98.
[3]伍金娥,常超,王学东,等.益生菌对肉仔鸭肠道结构的影响[J].湖北农业科学,2011,50(22):4670 ~ 4673.
[4]王学东,刘华梅,伍金娥,等.肉鸭日粮中合生元部分替代抗生素的应用研究[J].饲料工业,2012,33(5):35 ~ 37.
[5]杨玉荣,佘锐萍,张日俊,等.大豆活性肽对肉鸡肠道黏膜结构的影响[J].中国畜牧杂志,2006,42(15):13 ~ 15.
[6]Awad W A,Ghareeb K,Abdelraheem S,et al.Effects of dietary inclusion of probiotic and synbiotic on growth performance,organ weights,and intestinal histomorphology of broiler chickens[J].Poult Sci,2009,88:49 ~ 56.
[7]Blomberg L,Krivan H C,Cohen P S,et al.Piglet ileal mucus contains protein and glycolipid (galactosylceramide)receptors specific for Escherichia coli K88 fimbriae[J].Infect Immun,1993,61:2526 ~ 2531.
[8]Dimitroglou A,Merrifield D L,Moate R,et al.Dietary mannan oligosaccharide supplementation modulates intestinal microbial ecology and improves gut morphology of rainbow trout,Oncorhynchusmykiss (Walbaum)[J].J Anim Sci,2009,87:3226 ~ 3234.
[9]Santin E,Maiorka A,Macari M,et al.Performance and intestinal mucosa development of broiler chickens fed diets containing Saccharomyces cerevisiae cell wall[J].J Appl,2001,10(3):236 ~ 244.
[10]Shen Y B,Piao X S,Kim S W,et al.Effects of yeast culture supplementation on growth performance,intestinal health,and immune response of nursery pigs[J].J Anim Sci,2009,87:2614 ~ 2624.■
