糖皮质激素对内毒素耐受的影响
2014-10-16张丽丽赵欣欣王宗谦
张丽丽,赵欣欣,杨 琦,闵 睿,王宗谦
0 引言
内毒素又名脂多糖(lipopolysaccharide,LPS),是革兰阴性菌菌壁的主要成分,具有广泛的生物学活性,可通过激活相关受体介导信号通路调控炎症及免疫系统。当机体受到内毒素打击时,可诱导多种细胞(主要为单核巨噬细胞系统)活化并产生多种促炎因子,如肿瘤坏死因子α(tumour necrosis factor-a,TNF-α)、白细胞介素 1(interleukin-1,IL-1)、IL-6、IL-8、干扰素 γ 等,以及多种抗炎介质,如 IL-10、转化生长因子 β(transforming growth factor β,TGF-β)、糖皮质激素(glucocorti-coid,GC)等,参与机体免疫炎症反应,使机体出现如发热、体重下降,严重时可致脓毒症、系统性炎症反应综合征,甚至多器官功能障碍综合征等。然而,预先予机体小剂量的LPS刺激,机体对随后大剂量或致死量LPS攻击呈现出低反应甚至无反应的现象,这种现象称为内毒素耐受。内毒素耐受的形成避免了机体产生持续过度的炎症反应,对机体是一种保护作用。内毒素耐受的发生机制目前尚未完全清楚。LPS通过引起内源性糖皮质激素释放,抑制促炎因子基因转录[1-2]。糖皮质激素可能参与内毒素耐受的发生机制。然而,糖皮质激素对内毒素耐受的形成起到促进还是抑制作用,目前不同的研究结论不同。本实验将通过不同时间点给予外源性糖皮质激素-地塞米松干预,观察其对内毒素耐受的影响。
1 材料与方法
1.1 实验动物 8~12周龄雌性昆明鼠,体重26~38 g,购于中国医科大学实验动物中心,SPF级,饲养于中国医科大学附属第四医院动物室独立通风笼具系统,标准灭菌复合饲料及纯净水饲养,室内自然温度及光照。主要试剂:脂多糖(LPS,O55:B5)(宝信生物公司),地塞米松磷酸钠注射液(天津药业焦作有限公司),TNF-α ELISA kit(博士德),IL-10 ELISA kit(博士德)。
1.2 昆明鼠分组 Ⅰ组:对照组(20只),分为ⅠA组:健康对照(10只)、ⅠB组:单次直接致死剂量LPS(2LD50=8 mg/kg)对照组(10只);Ⅱ组:标准内毒素耐受组(6只);Ⅲ组:高剂量Dex干预组(12只),ⅢA组为初始LPS刺激前高剂量Dex干预组(6只),ⅢB组为终末致死量LPS前高剂量Dex干预组(6只);Ⅳ组:低剂量Dex干预组(12只),ⅣA组为初始LPS刺激前低剂量Dex干预组(6只),ⅣB组为终末致死量LPS前低剂量Dex干预组(6只)。
1.3 各组处置 ⅠA组小鼠:连续5 d腹腔注射0.9%氯化钠注射液(0.5 mL/d)。ⅠB组小鼠:连续4 d腹腔注射0.9%氯化钠注射液(0.5 mL/d),第5天腹腔注射致死剂量LPS(8 mg/kg)。Ⅱ组小鼠:连续 4 d 腹腔注射 LPS[80 μg/(kg·d)],第5 天腹腔注射致死剂量LPS(8 mg/kg)。ⅢA组小鼠:连续4 d 腹腔注射 LPS[80 μg/(kg·d)],第 1 天注射LPS前1 h腹腔注射Dex(10 mg/kg),第5天腹腔注射致死剂量LPS(8 mg/kg);ⅢB组小鼠:连续4 d 腹腔注射 LPS[80 μg/(kg·d)],第 5 天腹腔注射致死剂量LPS(8 mg/kg),注射致死量LPS前1 h腹腔注射Dex(10 mg/kg)。ⅣA组小鼠:连续4 d腹腔注射 LPS[80 μg/(kg·d)],第 1 天注射 LPS前1 h腹腔注射Dex(1 mg/kg),第5天腹腔注射致死剂量LPS(8 mg/kg)。ⅣB组小鼠:连续4 d腹腔注射 LPS[80 μg/(kg·d)],第 5 天腹腔注射致死剂量LPS(8 mg/kg),注射致死量LPS前1 h腹腔注射Dex(1 mg/kg)。于第5天注射致死量LPS后3 h采用摘眼球法取血标本,留取血清,4℃保存,次日检测血清细胞因子。
1.4 TNF-α和IL-10水平测定 取血清标本,依照博士德ELISA kit说明书具体操作,检测OD值,应用curve exert 1.3软件绘制标准曲线,求得浓度值。
1.5 统计学分析 应用SPSS 18.0软件分析,计量资料均采用±s表示,两组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
①ⅠA组 TNF-α、IL-10水平极低,ⅠB组TNF-α、IL-10水平较ⅠA组显著增高,差异有统计学意义。Ⅱ组TNF-α、IL-10水平较ⅠB组显著下降,差异有统计学意义,但仍高于ⅠA组,见表1。②Dex干预组TNF-α水平与标准内毒素耐受组比较(表2):ⅢA、ⅣA组 TNF-α 水平与Ⅱ组 TNF-α水平差异无统计学意义(P>0.05),ⅢB、ⅣB组TNF-α水平低于Ⅱ组TNF-α水平,差异有统计学意义(P<0.05)。③Dex干预组IL-10水平与标准内毒素耐受组比较(表2):ⅢA、ⅣA组IL-10水平高于Ⅱ组IL-10水平,差异有统计学意义(P<0.05),ⅢB、ⅣB组IL-10水平与Ⅱ组IL-10水平差异无统计学意义(P>0.05)。由于部分血样溶血或获取血清量少,检测血清样本数量与各组小鼠数量有差异。

表1 健康对照组、LPS对照组及标准内毒素耐受组TNF-α、IL-10水平比较
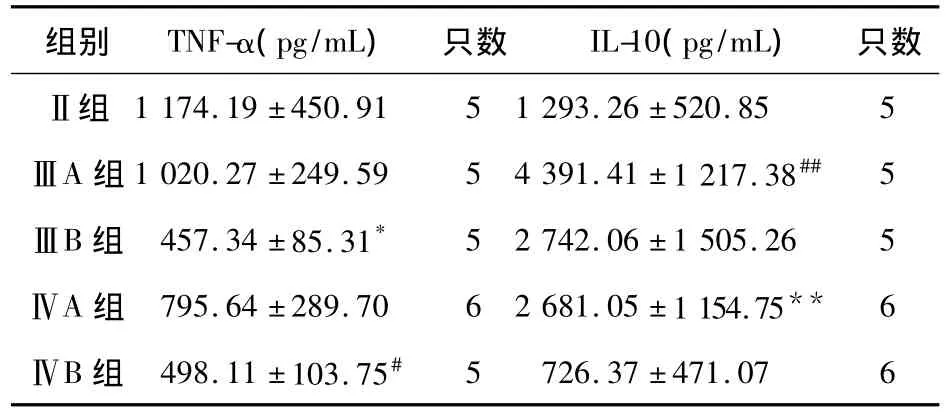
表2 地塞米松干预各组与标准内毒素耐受组TNF-α、IL-10 水平比较
3 讨论
内毒素耐受现象是生物在长期进化中形成的一种保护性调节机制,以避免机体产生持续过度的炎症反应,是机体防御机制的重要组成部分[1]。此外,在生命的早期过程中不可避免地接触到的环境内毒素对机体免疫耐受的调节也具有重要作用[3]。人工诱导针对内毒素的免疫耐受可能具有改善自身免疫性疾病的作用[3-5]。内毒素耐受现象的机制目前没有被完全阐明,大量研究表明,单核巨噬细胞系是内毒素作用的主要靶细胞,此外,树突细胞与内毒素耐受也具有密切关系。内毒素信号转导主要为Toll样受体4(TLR4)识别后与髓样分化因子-88(MyD88)衔接,进一步与白介素-1受体相关激酶(IRAKs)、TNF受体相关因子-6(TRAF-6)作用,激活NF-κB诱导激酶(NIK)和丝裂素活化蛋白激酶(MAPKs),导致NF-κB和JNK活化,转录因子向核内易位,基因表达,最终导致炎症因子的释放。目前主要认为内毒素耐受与TLR4表达下调、IRAK水平下调、MAPK活性降低、NF-κB 活化障碍具有相关性[1]。
GC常被用于治疗感染性休克、全身炎症反应综合征等,以减轻炎症反应,GC的应用也将影响到内毒素耐受形成。GC对机体免疫系统具有广泛而重要的调节作用。GC对诱导内毒素耐受的作用仍存在争议。Glenn等[6]研究表明,切除肾上腺的鼠不能形成对LPS的耐受,通过补充外源性糖皮质激素能够恢复鼠对LPS的耐受能力。Raquel等[7]研究表明,在Dex条件下,树突细胞保持在未成熟状态,促进免疫耐受。Rearte等[2]研究表明,内毒素耐受的持久性依赖于GC,但Dex对内毒素耐受的形成具有抑制作用。上述这些体外或动物实验研究结果不尽相同,这可能与内毒素耐受产生过程的复杂性相关,可能研究结果只来自于内毒素耐受的一个特殊阶段,或与应用不同的动物模型、选择外源性糖皮质激素干预的方法不同、应用试剂及检测方法不同相关。
TNF-α被认为与内毒素耐受密切相关,目前绝大部分研究表明,机体第一次受到LPS刺激时TNF-α显著升高,形成内毒素耐受时TNF-α升高水平明显降低,机制可能与内毒素耐受时IRAKs表达下降,IRAK/MyD88结合被抑制,NF-κB活化障碍相关[1]。Rearte等[2]通过抗 TNF-α 抗体不能改变LPS诱导耐受的实验说明了TNF-α与内毒素耐受虽然相关,但其不是耐受建立的相关责任细胞因子。尽管对TNF-α是否能诱导耐受观点不一致,但内毒素耐受时TNF-α升高水平显著降低这一事实是绝大数研究公认的,本实验同样证实了,当小鼠第一次受到LPS刺激时,TNF-α水平显著升高,多次LPS干预,形成内毒素耐受,小鼠受到致死量LPS打击时TNF-α升高水平明显下降。外源性糖皮质激素-地塞米松能够抑制TNF-α的产生,我们设想在建立内毒耐受形成过程中在不同的时间点予Dex干预,是否仍能够抑制TNF-α的产生,促进内毒素耐受。实验结果表明,在初始LPS刺激前1 h,给予高剂量Dex(10 mg/kg)或低剂量Dex(1 mg/kg)干预均不影响TNF-α水平,即在较早期给予Dex干预,并不影响接下来内毒素耐受的建立。然而,终末致死量LPS前高剂量或低剂量Dex干预能显著降低TNF-α水平,即注射致死量内毒素前1 h腹腔注射Dex能进一步降低TNF-α水平,对内毒素耐受有促进作用,同时也说明了1 mg/kg Dex与10 mg/kg Dex剂量对TNF-α水平影响无显著差异,这一实验结果与Glenn等[6]认为Dex对内毒素耐受起到是促进作用的结论一致,但不同点在于其动物模型为肾上腺切除鼠,除外了内源性糖皮质激素的干扰,其结论认为在初始LPS刺激前予Dex能恢复内毒素耐受能力。然而本实验结果表明,在终末致死量LPS攻击前的一定时段内Dex干预能通过降低TNF-α水平促进内毒素耐受,而过早给予Dex干预则不能对内毒素耐受的TNF-α水平产生显著影响。
IL-10作为抗炎细胞因子在调节炎症免疫反应中具有重要作用。Randow等[8]通过体外实验证实,人体单核细胞的耐受可以通过IL-1、IL-10、TGF-β前处理被部分模仿,在耐受过程中应用抗IL-10或抗TGF-β抗体可阻止这一现象产生,而IL-10缺失则会使树突细胞缺乏对LPS的反应,损毁免疫耐受[9],由此提示IL-10是内毒素耐受形成过程中的重要细胞因子。然而,有研究表明,IL-10基因敲除小鼠仍能产生内毒素耐受[10],此结果提示我们IL-10的存在并不是内毒素耐受的必要条件。Rearte等[2]的研究也认为IL-10并不是耐受维持至关重要的细胞因子,在小鼠产生内毒素耐受时,其体内仅有低水平的IL-10。IL-10对内毒素耐受形成的作用目前不是十分明确,在内毒素耐受形成时IL-10水平是升高还是降低,目前仍无一致的结论。本实验表明,当小鼠第一次受到LPS刺激时IL-10水平显著升高,多次LPS刺激,形成内毒素耐受,小鼠IL-10升高水平明显下降,这一结果与Rearte等所得结论相一致,提示IL-10可能参与内毒素耐受的形成。在终末致死量LPS前予高剂量Dex(10 mg/kg)或低剂量Dex(1 mg/kg)干预均不显著影响IL-10水平;但在终末致死量LPS刺激前96 h给与Dex干预,使机体在内毒素耐受形成时产生IL-10水平增高,推测Dex对IL-10调控作用可能需要较长时间,但对内毒素耐受时的TNF-α水平没有显著影响,说明IL-10不是形成内毒素耐受的决定性细胞因子。
内毒素耐受产生机制至今仍未完全明确。目前可通过多次LPS刺激建立内毒素耐受动物模型,本实验分别于初始LPS刺激前和终末致死量LPS前予高/低剂量Dex干预内毒素耐受形成过程,通过检测小鼠体内TNF-α、IL-10水平变化,间接推断Dex对内毒素耐受的影响,结合初始LPS刺激前予高剂量Dex或低剂量Dex干预不影响TNF-α水平,但能升高 IL-10水平,终末致死量LPS前高剂量Dex或低剂量Dex干预能降低TNF-α水平,但不影响IL-10水平。我们可得出初步结论,终末致死量LPS前较短时间内予以Dex干预可能对促进内毒素耐受更有意义,同时也提示Dex剂量过高可能不会带来更多受益,IL-10对内毒素耐受的形成可能不具有决定作用。结合临床,应用大剂量激素可增加副作用发生风险,在高剂量激素与低剂量激素对内毒素耐受作用无差异的情况下,我们可以考虑应用小剂量激素治疗感染性休克/败血症患者可能带来更多临床受益,这一结论与Annane等[11]主张低剂量糖皮质激素治疗败血症相一致。糖皮质激素对内毒素耐受形成的影响值得深入研究。
[1]李维朝,蒋电明,朱凤臣,等.内毒素耐受的分子机制研究进展[J].中国免疫学,2010,26:764-768.
[2]Rearte B,Landoni V,Laborde E,et al.Differential effects of glucocorticoids in the establishment and maintenance of endotoxin tolerance[J].Clin Exp Immunol,2010,159:208-216.
[3]Kristofor KE,Shigeki T,Farshid N,et al.Early life exposure to lipopolysaccharide suppresses experimental autoimmune encephalomyelitis by promoting tolerogenic dendritic cells and regulatory T cell[J].J Immunol,2009,183:298-309.
[4]Olivier J,Sandrine R,Natacha B,et al.Dendritic cells modulated by innate immunity improve collagen-induced arthritis and induce regulatory T cells in vivo[J].Immunology,2008,126:35-44.
[5]赵欣欣,毕莹,闵睿,等.内毒素抑制胶原诱导的鼠关节炎[J].中华微生物学和免疫学杂志,2011,31:689-690.
[6]Glenn F,Evans,Zuckerman SH,et al.Glucocorticoid-dependent and independent mechanisms involved in lipopolysaccharide tolerance[J].Eur J Immunol,1991;21:1973-1979.
[7]Cabezon R,Ricart E,Espana C,et al.Gram-negative enterobacteria induce tolerogenic maturation in dexamethasone conditioned dendritic cells[J].PLoS One,2012,7:e52456.
[8]Randow F,Syrbe U,Meisel C,et al.Mechanism of endotoxin desen-sitization:involvement of interleukin 10 and transforming growth factor beta[J].J Exp Med,1995,181:1887-1892.
[9]Fang Z,Bogoljub C,Hongmei Li,et al.IL-10 deficiency blocks the ability of LPS to regulate expression of tolerance-related molecules on dendritic cells[J].Eur J Immuno,2012,42:1449-1458.
[10]Berg DJ,Kuhn R,Rajewsky K,et al.Interleukin-10 is a central regulator of the response to LPS in murine models of endotoxic shock and the Shwartzman reaction but not endotoxin tolerance[J].J Clin Invest,1995,96:2339-2347.
[11]Annane D,Bellissant E,Bollaert PE,et al.Corticosteroids in the treatment of severe sepsis and septic shock in adults:a systematic review[J].JAMA,2009,301:2362-2375.
