极端环境细菌Gracilibacillus ureilyticus抑菌活性物质的提取与分离
2014-10-15刘振华聂永芳周晨妍孙景博郭伟云
刘振华,聂永芳,周晨妍,孙景博,郭伟云
(1.新乡医学院生命科学技术学院 河南省医学遗传学与分子靶向药物高校重点实验室培育基地,河南 新乡453003;2.河南科技学院机电学院,河南 新乡453003)
真菌在自然界非常普遍,但大多数都是非致病的。一些致病性真菌一般也仅引起手足头癣等浅表病害,容易治愈。从20世纪70年代开始,大量药物被用于癌症和艾滋病等临床治疗,导致病人免疫力下降,深部真菌感染疾病的死亡率逐渐上升[1]。深部真菌病的病原菌主要为念珠菌属,其次为曲霉属、酵母菌属、霉菌属等[2]。临床上真菌感染率的上升导致抗真菌药物使用率的升高,进而使得耐药菌株也不断增多,造成临床治疗的困难[3]。两性霉素B曾经一直是治疗真菌感染的一线药物,但其副作用很大(包括肾毒性及其注射带来的不良反应)[4]。三唑类药物(化学合成药)有较好的疗效和相对较低的毒性,但是因长期使用已引起部分真菌的耐药性。因此,迫切需要开发新的抗真菌药物。
芽孢细菌Gracilibacillus ureilyticus是一株在盐碱土壤中新发现和鉴定的菌株[5],研究表明其发酵培养产生的活性组分对白色念珠菌、金黄色葡萄球菌、大肠杆菌均有抑制作用,其中对白色念珠菌的抑菌活性较强,可能成为新型的抗真菌抗生素。因此,作者在此研究极端环境细菌Gracilibacillus ureilyticus活性物质大孔吸附树脂脱色和离子交换树脂提取工艺条件,旨在优化其提取分离工艺,为进一步开发利用奠定基础。
1 实验
1.1 材料、培养基与仪器
芽孢细菌Gracilibacillus ureilyticus,购自中国普通微生物菌种保藏管理中心(CGMCC),其发酵液经絮凝去除菌体后备用。
检验菌为白色念珠菌。
沙堡氏固体培养基:蛋白胨10g,葡萄糖40g,琼脂20g,蒸馏水1 000mL,调pH 值至5.4~5.8,115℃高压蒸气灭菌30min。
沙堡氏液体培养基:除不加琼脂外,配方同上。
大孔吸附树脂D101,天津瑞金特化学品有限公司;大孔吸附树脂XAD18、Amberlite离子交换树脂FPC22H、FPC3500、FPA51、FPA90CL,美国陶氏公司。
SENCO R-205型旋转蒸发仪,上海申生科技有限公司;PH070A型恒温培养箱,上海一恒科学仪器有限公司;PHS-3C型pH计,上海雷磁仪器厂。
1.2 方法
参照文献[6]按以下步骤进行提取:发酵絮凝液→大孔吸附树脂脱色→离子交换树脂提取→氨水洗脱→粗提液→减压蒸馏→粗制品。
1.2.1 大孔吸附树脂脱色
各取10.0g大孔吸附树脂XAD18和D101,分别装入直径15.0mm的层析柱中,然后加入200.0mL发酵絮凝液,进行动态吸附。流出液每20.0mL接1管,观察颜色变化并测活;吸附后的树脂依次用120.0 mL水、25%乙醇、75%乙醇、100%乙醇和丙酮洗脱;将含有机溶剂的洗脱液浓缩后再溶于水,观察洗脱液颜色并测活。
1.2.2 离子交换树脂提取
1)静态吸附
将发酵絮凝液 pH 值分别调为 3.0、5.0、7.0、9.0、11.0,各取30.0mL置于烧瓶中,分别用4种离子交换树脂(FPC22H、FPC3500、FPA51、FPA90CL)进行静态吸附,观察絮凝液的颜色并测活,确定合适的离子交换树脂。
吸附后的FPC22H树脂依次用水、70%乙醇和1.0mol·L-1HCl溶液洗脱,吸附后的FPA51树脂依次用水、70%乙醇和0.5mol·L-1氨水洗脱。记录洗脱液的pH值并测活。
2)动态吸附
分别取300.0mL发酵絮凝液加入到装有10.0g FPC22H树脂的2个层析柱中进行动态吸附,每30.0 mL接1管,共接10管,其中一个层析柱依次用0.05 mol·L-1和0.5mol·L-1的氨水洗脱,测定抑菌活性。另外一个层析柱,吸附后先依次用30.0mL水和180.0mL 25%、50%和70%的乙醇洗脱,然后再用180.0mL 0.0005mol·L-1、0.005mol·L-1、0.05 mol·L-1和0.5mol·L-1氨水洗脱,观察颜色变化。
1.3 抑菌活性测定方法
1)将冰箱中保存的白色念珠菌用沙堡氏固体培养基活化(37℃生长24h),然后接种到沙堡氏液体培养基中,于37℃、200r·min-1培养12h。
2)吸取一定量的白色念珠菌培养液于沙堡氏固体培养基平皿内,摇动平皿使培养液均匀分布,用移液器取出多余部分,将平皿开盖晾干,制成含菌平皿。
3)用直径为6mm的无菌打孔器在固体培养基平皿上打孔,将100μL待测样品液注入孔内,37℃恒温培养,每个样品设置2个重复对照。
4)24h后测量并记录抑菌圈直径。
2 结果与讨论
2.1 大孔吸附树脂脱色
实验发现:XAD18树脂吸附后的流出液每管都有一定活性,水、25%乙醇和75%乙醇洗脱液活性很弱,100%乙醇和丙酮洗脱液无活性。表明XAD18树脂对活性物质有微弱吸附作用,且易被洗脱。
D101树脂吸附后流出液每管都无活性,说明D101树脂对活性物质有一定吸附能力;水洗脱液有活性,乙醇和丙酮洗脱液无活性,说明该类活性物质可以被水洗脱。该类物质的极性比水小、比乙醇等有机溶剂大,分析其可能为离子型化合物,所以下一步用离子交换树脂分离提取。
比较XAD18和D101两种树脂对色素的吸附能力发现,D101树脂可以吸附更多的色素,所以后续分离提取工艺采用D101大孔吸附树脂脱色,然后进行离子交换树脂提取。为充分利用D101树脂的脱色能力,絮凝液和D101树脂的比例以10mL∶1g较为适宜。
2.2 离子交换树脂提取
2.2.1 离子交换树脂的选择
絮凝液经离子交换树脂FPC3500、FPA51、FPA90CL、FPC22H静态吸附后的颜色变化如表1 所示。

表1 静态吸附后絮凝液的颜色变化Tab.1 Color of flocculation liquid after static adsorption
由表1 可知:絮凝液经弱碱FPA51和强酸FPC22H树脂吸附后几乎无色,表明这2种树脂均有较好的脱色效果;不同pH值的絮凝液经弱酸FPC3500和强碱FPA90CL树脂吸附后均具有一定颜色,表明这2种树脂吸附色素能力较差,但是随着絮凝液pH值变小,吸附后絮凝液的颜色变浅,表明较低的pH值有利于这2种树脂吸附色素。
絮凝液经离子交换树脂FPC3500、FPA90CL、FPC22H、FPA51静态吸附后的活性变化如表2 所示。
由表2 可知,强酸FPC22H和弱碱FPA51树脂对絮凝液中活性物质的吸附效果最好,FPA90CL树脂越偏碱吸附效果越好。由于FPC22H树脂在不同pH值下都可以完全吸附絮凝液中的活性物质,因此,选择FPC22H树脂更为合适。
实验发现:吸附活性物质的强酸FPC22H和弱碱FPA51树脂的水、70%乙醇洗脱液均无活性,可能是洗脱液的浓度不合适,需进一步探索。

表2 不同pH值的絮凝液被离子交换树脂吸附后的抑菌圈直径/cmTab.2 Inhibition zone diameter for different pH values of flocculation liquid after static adsorption by ion exchange resin/cm
2.2.2 离子交换树脂提取条件的选择
由前述实验结果可知,静态条件下FPC22H可以完全吸附絮凝液中的活性物质,故选择FPC22H研究其动态条件下对活性物质的吸附与洗脱。
1)吸附
实验发现:絮凝液经FPC22H吸附后的流出液中前9管都没有活性,只有第10管有活性(抑菌圈直径为0.95cm,图1)。说明10.0g树脂在吸附270.0 mL(因每30.0mL收集1管)絮凝液时达到饱和,此时应停止吸附。后续实验絮凝液和树脂比例以20mL∶1g较为合适。

图1 絮凝液经FPC22H树脂动态吸附后第10管有活性Fig.1 Activity of 10th tube of flocculation liquid after dynamic adsorption by FPC22Hresin
由图1可知,10号样品有一定活性,11号样品仅有微弱活性,可能为残余在树脂中未被吸附的部分活性物质。
2)洗脱
以乙醇、氨水为洗脱剂,对吸附了活性物质的FPC22H树脂进行洗脱,考察洗脱液的颜色变化及活性,结果如表3 、表4所示。
综合表3 和表4可知:(1)乙醇可以脱去色素,但不能洗脱活性物质,其中50%乙醇脱色效果最好,可能是因为该活性物质的极性比乙醇大;(2)0.05mol·L-1的氨水和0.5mol·L-1的氨水都可以洗脱活性物质,而且都有颜色,可能是该活性物质本身有颜色或者是有一种或几种同活性物质性质相同的色素被同时洗脱下来;(3)0.05mol·L-1氨水的洗脱效果最好,洗脱后的溶液活性比吸附前减弱,说明活性物质有部分损失。

表3 乙醇和氨水洗脱液的颜色变化Tab.3 Color of alcohol and ammonia eluention
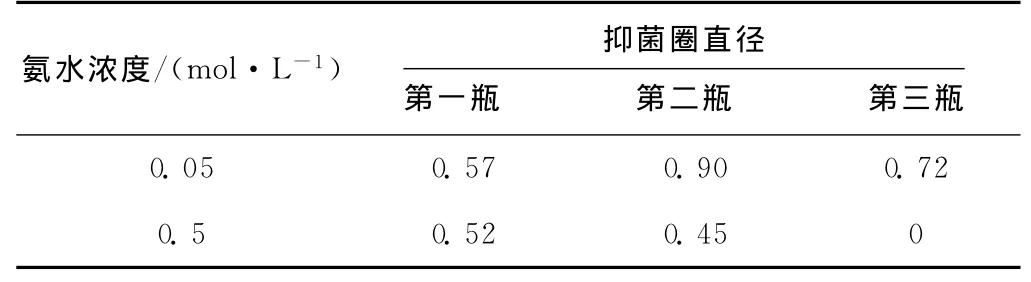
表4 氨水洗脱液的抑菌圈直径/cmTab.4 Inhibition zone diameter of ammonia eluention/cm
3 结论
研究了芽孢细菌Gracilibacillus ureilyticus抗白色念珠菌活性物质的分离提取工艺,确定脱色及提取工艺如下:(1)絮凝液选用D101大孔吸附树脂脱色,合适的絮凝液与D101树脂比例为10mL∶1g,大孔吸附树脂吸附的部分活性物质可被水全部洗脱。(2)选择强酸型阳离子交换树脂FPC22H吸附絮凝液,絮凝液中活性物质可以被FPC22H树脂吸附且不受pH值影响,合适的絮凝液与FPC22H树脂比例为20mL∶1g;0.05mol·L-1氨水的洗脱效果最好。
[1]殷瑜,黄为一,陈代杰.微生物来源的抗真菌抗生素的研究进展[J].中国新药杂志,2004,13(2):113-117.
[2]刘自贵,裘雁秋,谭明珍,等.院内真菌感染及其药物的敏感性分析[J].华西医学,1999,14(4):393-394.
[3]周中仲,孙殿春,郑慧哲,等.新型抗真菌药物尼可霉素的进展[J].中国制药信息,2002,18(1):22-25.
[4]高国平.两性霉素B肾中毒[J].国外医学:外科学分册,1995,22(4):218-219.
[5]HUO Y Y,XU X W,CUI H L,et al.Gracilibacillus ureilyticus sp.nov.,a halotolerant bacterium from a saline-alkaline soil[J].International Journal of Systematic and Evolutionary Microbiology,2010,60(6):1383-1386.
[6]梁雪琴.一种核苷嘧啶类抗真菌抗生素的分离纯化及抗菌活性的研究[D].杭州:浙江大学,2010.
