肺癌血清蛋白质双向电泳图谱的建立*
2014-10-15李雪华刘燕青谷彦军
李雪华 刘燕青 谷彦军 刘 静
1 武警后勤学院附属医院病理科,天津市 300162; 2 天津市职业与环境危害防制重点实验室
肺癌已成为当前世界各国常见的恶性肿瘤之一,预后很差,5年存活率仅为14%[1]。蛋白质组学(proteomics)为肺癌的研究提供了新的思路和技术平台。双向凝胶电泳(two-dimensional polyacrylamide gel electrophoresis,2-DE)是蛋白质组学研究的核心技术,用于分离蛋白质[2]。固相pH 梯度(immobilized pH gradient,IPG)干胶条的出现使得2-DE的重复性大大改善,尽管如此,稳定性和重复性仍然是2-DE技术的主要问题。本研究利用2-DE技术分离肺癌血清蛋白质,建立稳定的肺癌血清蛋白质2-DE图谱,对2-DE的条件进行了各方面的调整优化,为进一步的肺癌血清蛋白质组学研究奠定基础。
1 材料与方法
1.1 材料和仪器 肺癌血清标本取自武警后勤学院附属医院。IPG干胶条(pH 3~10L、pH 3~10NL、pH 4~7,17cm)、IEF buffer(pH 3~10)、三丁基膦(Tributyl phosphine,TBP)均为Bio-Rad公司产品;尿素、硫脲、二硫苏糖醇(DTT)、CHAPS、SDS等均为Sigma公司产品。等电聚焦仪(Protean IEF cell)、垂直电泳系统(proteanⅡxi cell)均购自Bio-Rad公司,透射扫描仪为 Umax PowerLook 1100。
1.2 方法
1.2.1 血清收集:取研究对象肘正中静脉血3ml,4℃放置50min,1 500r/min离心10min,吸取血清,Bradford法测定血清蛋白浓度,分装,存于-80℃冰箱备用。
1.2.2 双向凝胶电泳:2-DE 方法主要参考文献[3]和仪器操作手册进行。以pH 4~7、17cm IPG胶条为例。600μg蛋白质与上样缓冲液(7mol/L尿素,2mol/L 硫 脲,4%CHAPS,50mmol/L DTT,2mmol/L TBP,0.2%IEF buffer pH 3~10,痕量溴酚蓝)充分混合,总体积为400μl,上样,胶条被动重水化16h;等电聚焦电泳(IEF)条件为250V1h、500V1h、1 000V1h、5 000V3h、10 000V70 000 Vh;等电聚焦完毕,IPG胶条立即在平衡液 A(6mol/L 尿 素、2%SDS、pH 8.8 的 0.05mol/L Tris-HCL、20%甘油、2%DTT)中平衡15min,再于平衡液B(以2.5%碘乙酰胺替换平衡液A中2%DTT)中平衡15min。之后的垂直板SDS-PAGE电泳条件为每块胶12mA 30min、每块胶24mA直至溴酚蓝达胶底线。
1.2.3 凝胶染色:2-DE所得凝胶参考文献进行硝酸银染色[4]。
2 结果与讨论
通过以上方法和实验条件能够得到较稳定的肺癌血清蛋白质2-DE图谱,蛋白质点能够较好分离。实验的条件的调整与优化主要从以下各方面进行。
2.1 IPG胶条的pH范围的选择 最初本研究采用pH 3~10L(线性)胶条分析蛋白总体情况,发现血清蛋白主要集中于pH 4~7段(图1A),后来笔者应用了pH 3~10NL(非线性)(图1B)、pH 4~7(图1C)和pH 4.7~5.9的胶条(图1D),进一步提高上样量、分辨率以及低丰度蛋白质的检测能力。
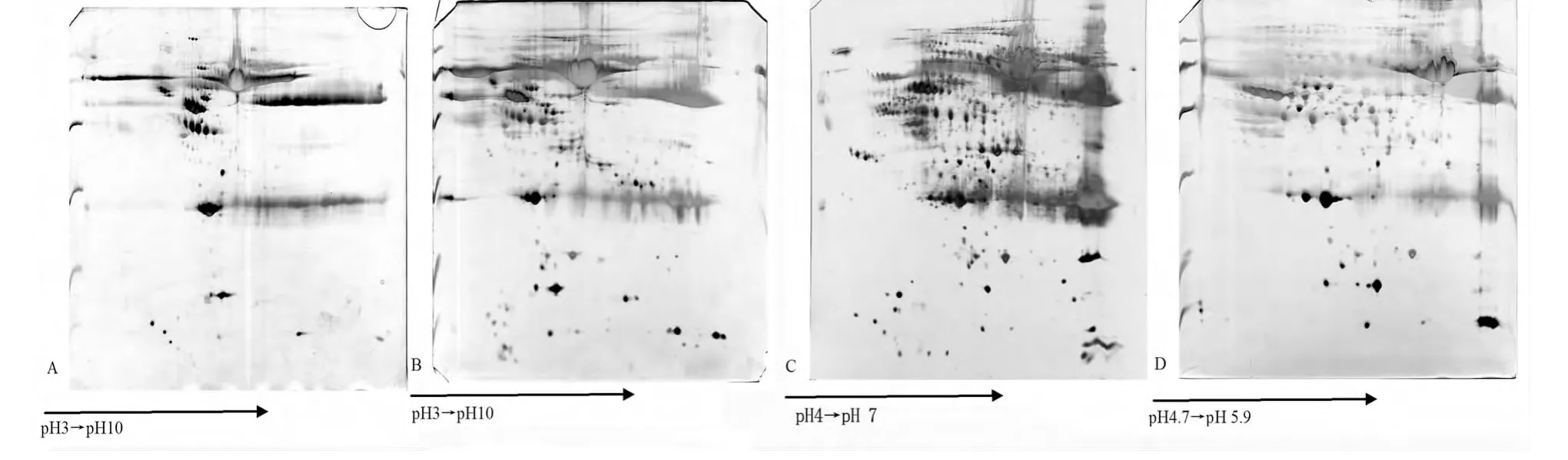
图1 IPG胶条pH范围的选择
2.2 蛋白质的加样量 对于某一特定pH范围的IPG胶条,选择合适的蛋白质加样量才能使2-DE图谱蛋白质点清晰分辨。加样量过大,会使蛋白点融合,分辨率降低,不利于软件分析和取点鉴定;加样量过小,则低丰度蛋白不能被检测。经过多次实验摸索,加样量600μg比较适合,大部分蛋白点能够清晰分辨。
2.3 聚焦参数设置 对于不同的样品、不同的上样量、不同的pH范围的胶条、不同的标本处理方法或者不同的样品缓冲液聚焦参数的设置是不同的,具体条件要实验摸索。聚焦不够,蛋白没有到达相应的等电点部位,会出现横向条纹;但是聚焦过度,蛋白质会在等电点附近发生沉淀,同样会出现横向条纹;而且二者都可能使所能检测的蛋白点数减少。最初实验中由于聚焦过度2-DE图谱中出现一些横向的细条纹。经多次实验调整,最终所设置的IEF聚焦参数为:对于pH4~7的胶条,600μg左右的上样量,按照前述聚焦步骤,总Vh 70 000左右,能够对血清蛋白质较好的分离;对于pH4.7~5.9的胶条,1 400μg左右的上样量,总Vh 85 000左右。以下为聚焦过度和聚焦适度的2-DE图谱比较(图2)。
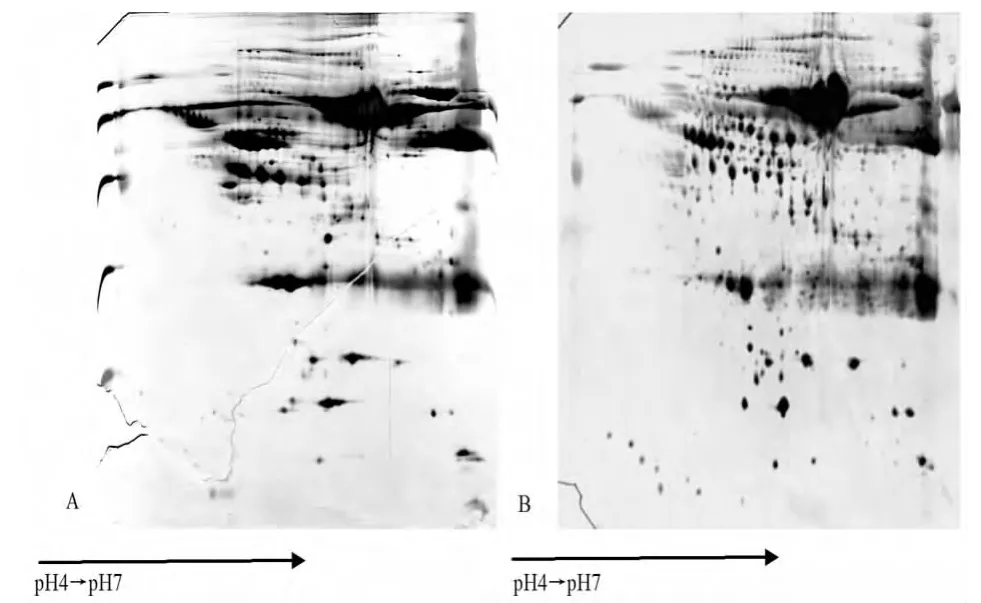
图2 IEF聚焦参数设置对2-DE结果的影响
2.4 血清蛋白质缓冲液 2-DE样品蛋白质缓冲液一般分为样品制备的裂解液和上样缓冲液。样品缓冲液的配方多种多样,对于不同样品的蛋白质,缓冲液的成分和浓度会有所不同。对于某一特定样品的蛋白质,要想达到最佳分离效果,必须对缓冲液的成分和浓度进行预实验、调整。本研究最初应用了不适合的血清蛋白上样缓冲液,导致实验结果较差(图3A)。经过预实验调整,目前笔者应用的上样缓冲液成分是7mol/L尿素、2mol/L硫脲、4%CHAPS、50mmol/L DTT、2mmol/L TBP、0.2%IEF buffer pH3~10、痕量溴酚蓝,能够达到较好电泳效果(图3B)。
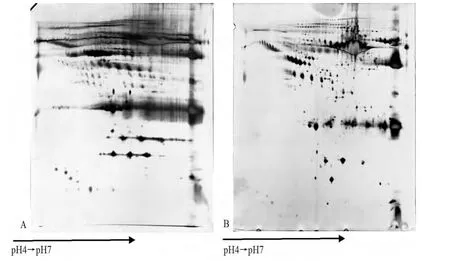
图3 血清蛋白质缓冲液对2-DE的影响
2.5 血清蛋白质的纯化 丙酮沉淀蛋白质的方法,被广泛用于蛋白质标本的预处理纯化,可以去除盐、脂、核酸等杂质的干扰,可以富集低浓度蛋白质。而沉淀的方法会丢失少量的蛋白质。所以本研究进行了血清蛋白质丙酮沉淀与不沉淀的比较。图4A为经过丙酮沉淀的血清蛋白2-DE图,图4B为未沉淀蛋白2-DE图,二者的加样量相同。通过比较可以发现两张图蛋白点极为相似。以后的实验中尽量采取不沉淀的方法,但如果血清盐、脂等严重干扰等电聚焦电泳,则可以采取沉淀的方法纯化标本,去除干扰成分。
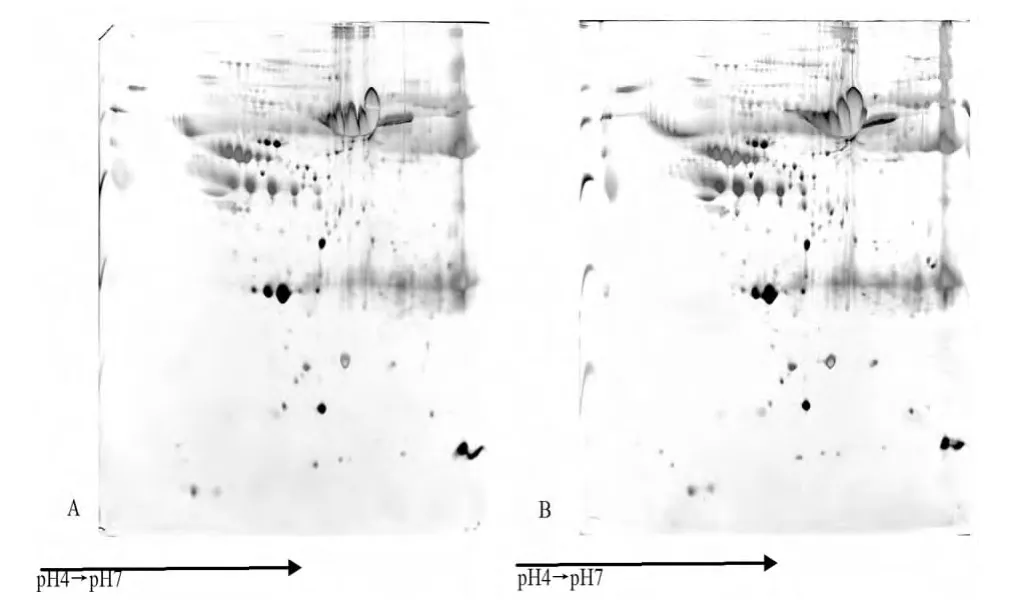
图4 丙酮沉淀与不沉淀蛋白质2-DE图比较
本研究对肺癌血清蛋白质2-DE的各种条件进行了优化,建立了重复性较好的血清蛋白质2-DE技术,获得了较稳定的肺癌血清蛋白质2-DE图谱,为进一步比较、分析、鉴定肺癌相关血清蛋白质,开展相关的蛋白质组学研究奠定了一定的基础。
[1]刘璟.肺癌治疗的进展〔J〕.医学理论与实践,2011,24(1):25.
[2]Aebersold R,Mann M.Mass spectrometry-based proteomics〔J〕.Nature,2003,422(6928):198.
[3]Curreem SO,Watt RM,et al.Two-dimensional gel electrophoresis in bacterial proteomics〔J〕.Protein Cell,2012,3(5):346.
[4]Görg A,Weiss W,Dunn MJ.Current two-dimensional electrophoresis technology for proteomics〔J〕.Proteomics,2004,4(12):3665-3685.
