腭裂相关基因甲状腺转录因子-2转基因小鼠的生物学特征
2014-10-13黄磊石冰郑谦蒙田
黄磊 石冰 郑谦 蒙田 王䶮
1.广州市第一人民医院口腔科,广州 510016;2.口腔疾病研究国家重点实验室 华西口腔医院(四川大学);3.唇腭裂外科,成都 610041
近年来转基因动物技术已广泛应用在发育生物学研究中。应用转基因动物模型研究唇腭裂遗传因素,为精确建立人类遗传性疾病的动物模型提供了可能。甲状腺转录因子-2(thyroid transcription factor-2,TTF-2)属于叉头/螺旋翼结构域蛋白家族,其基因在小鼠定位于4C2[1],在人类定位于9q22[2]。TTF-2-/-小鼠和人TTF-2基因突变均表现为腭裂及甲状腺发育不全等畸形[3-5],这从一个侧面证实TTF-2与腭裂的发生有一定关系。为观察TTF-2基因高表达对腭突发育产生的影响,本研究构建pBROAD3-TTF-2重组表达载体,通过显微注射法将TTF-2重组表达载体注射入小鼠受精卵雄原核,建立TTF-2转基因小鼠,在一定范围内增加TTF-2的表达,观察TTF-2基因的活动规律和其表达产物(蛋白质)的作用。
1 材料和方法
1.1 材料
1.1.1 实验动物 SPF级成年C57BL/6J小鼠和昆明白小鼠,均购自四川大学实验动物中心。
1.1.2 主要仪器 CO2孵箱(Sanyo公司,日本),显微操作系统(Nikon公司,日本),立体解剖显微镜(Olympus公司,日本);拉针仪、微锻仪、毛细玻璃管(Narishage公司,日本),电泳仪、凝胶成像系统(Bio-Red公司,美国),梯度聚合酶链反应(polymerase chain reaction,PCR)仪(Eppendorf公司,美国)。
1.1.3 主要试剂 PCR试剂盒,PCR产物回收试剂盒,DNA Marker,Kpn Ⅰ、Hind Ⅲ酶,以上试剂均购自宝生物工程(大连)有限公司;孕马血清促性腺激素(pregnant mare serum,PMS)购自内蒙古赤峰松山兽药厂,人绒毛膜促性腺激素(human chorionic gonadotrophin,hCG)购自宁波激素制品厂;胶回收试剂盒为日本QIAGEN公司产品,基因组提取试剂盒购自上海生工生物工程技术服务有限公司;α-32P-dCTP购自北京亚辉生物工程公司,羊抗小鼠TTF-2多克隆抗体IgG购自美国 Santa Cruz公司。
1.1.4 载体与菌株 pMD18-T与大肠杆菌JM109(Code No.D9052)购自宝生物工程(大连)有限公司;pBROAD3-mcs载体购自美国 InvivoGene公司。
1.2 方法
1.2.1 TTF-2转基因表达载体的构建 应用DNA提取试剂盒,从C57BL/6J小鼠肝脏组织中提取基因组DNA,应用PCR扩增TTF-2基因。扩增引物P1:5’-TATAGATCTATGACAGCCGAGAGCGCGCCGCCG-3’,含Kpn Ⅰ酶切位点;P2:5’-CTATCTAGATTACATGGCAGACACGAACCGATCC-3’,含Hind Ⅲ酶切位点。得到克隆载体pMD18-T-TTF-2,经测序比对正确无突变碱基后,酶切回收TTF-2片段,再定向插入pBROAD3-mcs载体,构建重组表达质粒pBROAD3-TTF-2并鉴定。
1.2.2 转基因小鼠的制备 用PMS和hCG对4~6周龄质量为12.5~14.0 g的雌性C57BL/6J小鼠进行超排卵后,与健康雄鼠合笼,从有精栓的小鼠输卵管壶腹部将受精卵取出,向受精卵雄原核中注入DNA溶液,在CO2孵箱(37 ℃)中培养过夜,将发育成2-细胞的胚胎挑选出来,移植到昆明白假孕小鼠的输卵管中[6],培养12~15 d,观察胎鼠腭突发育情况。
1.2.3 转基因鼠基因组DNA的PCR鉴定 按常规方法提取基因组DNA[6]作为PCR模板,扩增ROSA26启动子下游和TTF-2基因。引物P1’:5’-ACTCCCAGTTCAATTACAGCTGTTG-3’,P2’:5’-GGGCGGCGGTTGGTGTTACGTTTGG-3’;反应参数:95 ℃预变性10 min,95 ℃变性1 min,58 ℃退火1 min,72 ℃延伸30 s,35个循环,最后72 ℃延伸10 min。循环延伸后,采用1%琼脂糖凝胶电脉进行分析。
1.2.4 转基因鼠基因组DNA Southern blot鉴定 用KpnⅠ和EcoRⅠ酶切pBROAD3-TTF-2质粒,用回收的0.7 kb片段为模板,采用随机引物法标记探针。取待检的TTF-2转基因小鼠的DNA,用VspⅠ和XbalⅠ酶切,在2%琼脂糖凝胶上电泳,待凝胶变性、中和后转移至Hybond尼龙膜,然后固定、杂交,并曝光检测。
1.2.5 转基因小鼠腭突组织TTF-2蛋白表达的免疫组织化学检测 取TTF-2转基因小鼠(胚胎12~15 d)腭突,用4%甲醛缓冲液(pH=7.0)固定24 h后,石蜡包埋,5 μm厚连续切片,行免疫组织化学染色,DAB显色。光镜下观察腭突中TTF-2的表达状况。
2 结果
2.1 TTF-2转基因表达载体的构建
2.1.1 TTF-2基因的扩增结果 经PCR扩增获得TTF-2基因片段,其大小与理论值1 113 bp相符(图1a)。
2.1.2 扩增片段的克隆与鉴定 克隆载体pMD18-TTTF-2经转化、扩增后,进行琼脂糖凝胶电泳,其鉴定结果见图1b。
2.1.3 重组表达质粒的酶切鉴定 将重组表达质粒pBROAD3-TTF-2扩增后行KpnⅠ和HindⅢ酶切鉴 定,其电泳结果见图1c。

图1 TTF-2转基因表达载体的构建Fig 1 Construction of plasmid pBROAD3-TTF-2
2.2 转基因小鼠的制备
注射原核期受精卵982枚,发育为2-细胞胚胎580枚(图2),均移植入48个假孕受体昆明白小鼠,得到胎鼠68只。有2只新生鼠出现腭裂(图3),生后24 h死亡。小鼠胚胎腭突发育的组织学切片见图4,观察胚胎12~15 d(E12~E15)的腭突形态,转基因组只是在胚胎15 d(E15)时腭突没有融合而形成腭裂,其余时间对照组与转基因组无明显差别。

图2 受精卵的显微注射 倒置相差显微镜Fig 2 Microinjection of the fertilized ovum inverted phase contrast microscope
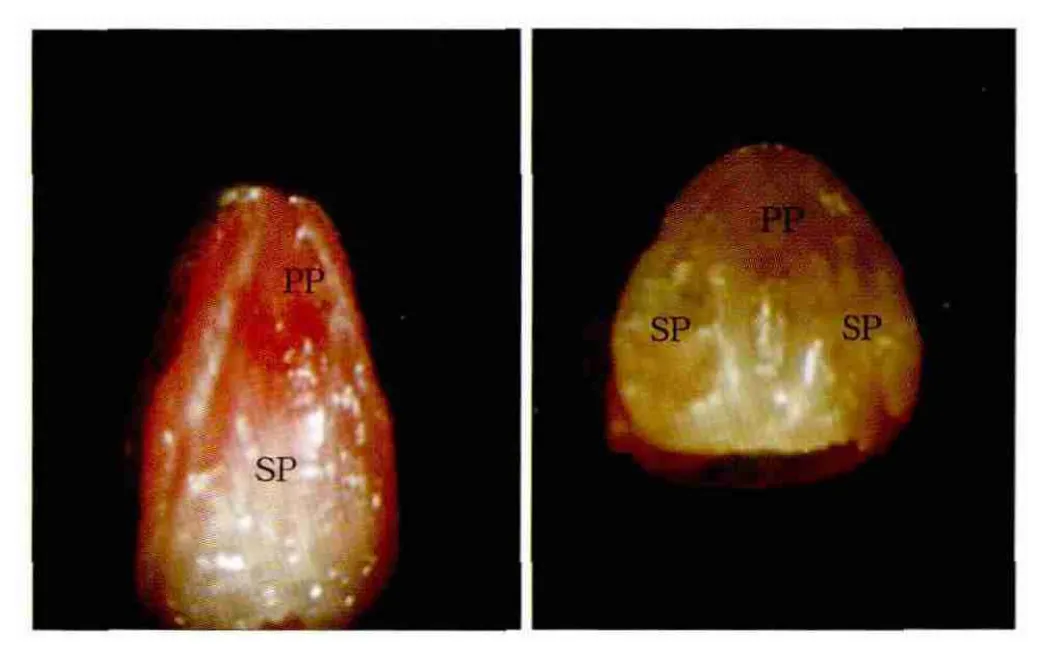
图3 胚胎15 d时的腭突Fig 3 The palatal shelves on E15
2.3 转基因鼠基因组DNA的PCR鉴定结果
68只胎鼠(包括2只腭裂新生鼠)经PCR检测,共有41只鼠可见到784 bp(TTF-2基因的一部分)的阳性条带(图5),2只腭裂新生鼠均有阳性条带,阳性整合率为60.3%。
2.4 转基因鼠DNA的Southern blot鉴定结果
以41份TTF-2 PCR阳性鼠的基因组DNA作为样品,进行Southern blot检测(图6),结果表明,阳性转基因小鼠共有13只,2只腭裂新生鼠均为转基因阳性。
2.5 TTF-2蛋白在转基因鼠腭突中的表达
转基因组胚胎12~15 d的腭突中嵴上皮和间充质中均可见TTF-2阳性细胞,且阳性表达无明显差异(图7)。
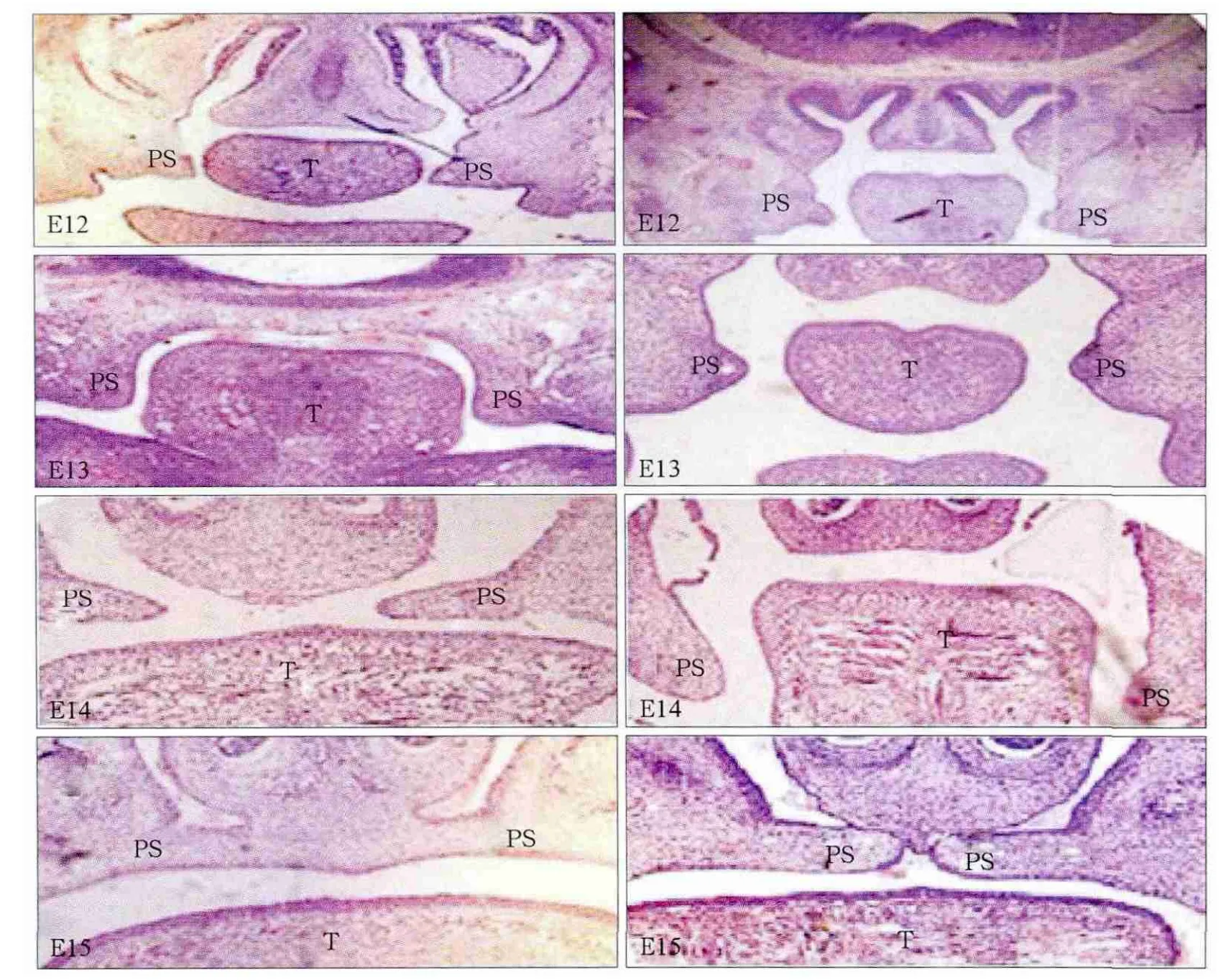
图4 胚胎12~15 d腭突的发育过程 苏木精-伊红染色 × 100Fig 4 Development of the palatal shelves from E12 to E15 hematoxylin-eosin staining × 100
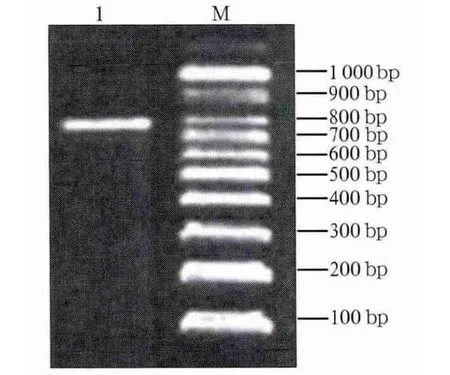
图5 转基因鼠DNA的PCR检测Fig 5 Results of PCR using genomic DNA of the transgenic foetus

图6 转基因鼠DNA的Southern blot结果Fig 6 Results of Southern blots of the genome DNA

图7 TTF-2在转基因小鼠腭突发育过程中(胚胎12~15 d)的表达 DAB × 100Fig 7 TTF-2 expression in the palatal shelves on E12-15 in the transgenic mice DAB × 100
3 讨论
建立TTF-2转基因小鼠模型有利于在活体水平对TTF-2基因及功能进行实验研究。因TTF-2基因仅含有1个外显子而无内含子,本研究采取以基因组DNA为模板用PCR方法将TTF-2基因593位点起始密码子ATG至1 705位点终止密码子TGA之间的基因片段进行扩增,将获得的1 113 bp目的基因片段插入到ROSA26基因启动子与人延长因子1-alpha(elongation factor 1-alpha,EF-1α)基因的3’-非翻译区(3’-untranslated region,3’-UTR)区和poly(A)信号序列之间,构建pBROAD3-TTF-2表达载体。该方法省略了从mRNA反转录成cDNA的过程,更便捷、快速,同时降低了成本。
为使目的基因在转基因小鼠中高表达,本研究选用了具有强启动活性的ROSA26基因启动子,它含有丰富的CpG区,可以在胚胎发育期和成年组织所有细胞中表达报告基因,同时因为pBROAD3载体有人EF-1α基因的3’-UTR区和poly(A)信号序列存在,可在体内长时间有效表达报告基因产物[7-9],这使得本研究构建的pBROAD3-TTF-2表达载体完全符合转基因动物制备的要求。
本研究采用目前最有效的受精卵原核显微注射法,用PacⅠ酶切去掉载体原核片段同时线性化,将5.4 kb线性化pBROAD3-TTF-2表达载体注射入靠近细胞表面的雄原核,共注射982枚受精卵,注射后培养24 h,存活并发育为2-细胞胚胎的受精卵580枚,成功率为59%。将注射后2-细胞胚胎移植到同期发情的48只假孕受体获得68只胎鼠,其中13只为TTF-2转基因阳性,阳性整合率达19%,与其他学者的报道相似[10]。
本课题组在前期研究[11]中发现,TTF-2在腭突的表达呈时空特异性:在C57BL/6J小鼠胚胎12~15 d的腭突发育期,胚胎12 d时TTF-2出现表达,13 d时达到高峰,15 d时表达消失,腭突正常融合。TTF-2-/-小鼠和人类TTF-2基因纯合突变均表现为腭裂及甲状腺发育不全等畸形[3-5],故推测TTF-2的表达与腭突发育密切相关。
本研究建立的TTF-2转基因小鼠表现型为腭裂,免疫组织化学检测发现,从胚胎12~15 d,TTF-2在转基因小鼠腭突中持续高表达,但是腭突的形态只是在胚胎15 d时没有融合,其余时间与对照组无明显差别。笔者推测,TTF-2转基因小鼠在腭突发育时期TTF-2持续高表达而且失去时空特异性,可能是TTF-2转基因小鼠发生腭裂的原因之一;但其确切原因还需进一步研究。
[1]Zannini M, Avantaggiato V, Biffali E, et al. TTF-2, a new forkhead protein, shows a temporal expression in the developing thyroid which is consistent with a role in controlling the onset of differentiation[J]. EMBO J, 1997, 16(11):3185-3197.
[2]Macchia PE, Mattei MG, Lapi P, et al. Cloning, chromosomal localization and identi fi cation of polymorphisms in the human thyroid transcription factor 2 gene (TITF2)[J]. Biochimie, 1999, 81(5):433-440.
[3]De Felice M, Ovitt C, Biffali E, et al. A mouse model for hereditary thyroid dysgenesis and cleft palate[J]. Nat Genet,1998, 19(4):395-398.
[4]Clifton-Bligh RJ, Wentworth JM, Heinz P, et al. Mutation of the gene encoding human TTF-2 associated with thyroid agenesis, cleft palate and choanal atresia[J]. Nat Genet, 1998,19(4):399-401.
[5]Castanet M, Park SM, Smith A, et al. A novel loss-of-function mutation in TTF-2 is associated with congenital hypothyroidism, thyroid agenesis and cleft palate[J]. Hum Mol Genet, 2002, 11(17):2051-2059.
[6]程萱, 陈红星, 杨晓, 等. 提高制备转基因小鼠效率的研究[J]. 中国实验动物学报, 2001, 9(3):160-163.
[7]Zambrowicz BP, Imamoto A, Fiering S, et al. Disruption of overlapping transcripts in the ROSA beta geo 26 gene trap strain leads to widespread expression of beta-galactosidase in mouse embryos and hematopoietic cells[J]. Proc Natl Acad Sci USA, 1997, 94(8):3789-3794.
[8]Kisseberth WC, Brettingen NT, Lohse JK, et al. Ubiquitous expression of marker transgenes in mice and rats[J]. Dev Biol, 1999, 214(1):128-138.
[9]Farley FW, Soriano P, Steffen LS, et al. Widespread recombinase expression using FLPeR ( fl ipper)mice[J]. Genesis,2000, 28(3/4):106-110.
[10]Voncken JW. Genetic modi fi cation of the mouse. General technology; pronuclear and blastocyst injection[J]. Methods Mol Biol, 2003, 209:9-34.
[11]黄磊, 石冰, 宋庆高, 等. TTF-2和TGFβ3在C57BL/6J小鼠腭突发育过程中的表达变化[J]. 河北医药, 2011, 33(14):2085-2087.
