RGD肽修饰壳聚糖作为种植体表面基因载体的研究
2014-10-13张迪刘长虹章锦才蔡德鸿杨晓喻李世轶钟惠兰
张迪 刘长虹 章锦才 蔡德鸿 杨晓喻 李世轶 钟惠兰
1.南方医科大学附属口腔医院·广东省口腔医院种植科,广州 510280;2.南方医科大学附属珠江医院内分泌科,广州 510282
随着社会经济的发展以及口腔修复意识的进步,现在越来越多的患者选择种植修复缺失牙,而骨量不足患者的种植修复因风险大而成为学者们研究的重点。种植体表面处理的目的是为了促进成骨细胞在种植体表面更好地成骨[1]。目前国内外学者着力于研究种植体的不同表面处理方法,如小分子靶向肽修饰壳聚糖作为基因载体、金属钛表面接枝短肽促进成骨细胞的附着与成骨[2]等。
RGD肽是一类含有精氨酸—甘氨酸—天冬氨酸(Arg-Gly-Asp)序列的短肽,广泛存在于生物体内,可与11种整合素特异性结合,促进成骨细胞生长,抑制破骨细胞之间及破骨细胞与基质之间的黏附,从而促进骨组织再生[3]。将RGD肽组装到种植体表面,能明显促进种植体周围的新骨形成,增加种植体固位力。种植体表面RGD组装方法对其在种植体表面上的应用以及种植体骨整合均有一定的影响。改善RGD肽在种植体表面的固定方法是近年来学者们研究的热点[4]。
壳聚糖(chitosan,CS)是一种新型的非病毒基因载体材料,与机体的生物相容性好,可生物降解,能有效地浓缩质粒DNA(plasmid DNA,pDNA),同时其表面带有的阳离子还可以和带有阴离子的DNA有效地结合,从而保护DNA免受DNA酶(DNaseⅠ)的降解[5]。此外,CS具有强的生物黏附作用,毒副作用小,来源丰富,价格低廉,作为非病毒性基因载体具有独特的优势。但是,壳聚糖的低靶向性和低转染效率限制了其临床应用[6]。为了提高壳聚糖的靶向性以及转染效率,本研究拟在壳聚糖分子上进行短肽修饰,然后包裹pDNA,形成RGDCS/pDNA复合体,通过钛表面层层自组装以及化学偶联的方法将复合体接枝到种植体表面,以达到提高种植体植入后成骨效率的目的。
1 材料和方法
1.1 主要材料和设备
CS(分子质量5.0×104,脱乙酰度大于等于90%,浙江金壳生物化学有限公司),1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺盐酸盐[1-(3-Dimethylamino propyl)-3-ethylcarbodiimide hydrochloride,EDC·HCl](上海共价化学科技有限公司),N-羟基琥珀酰亚胺(N-Hydroxysuccinimide,NHS)(上海延长生化科技发展有限公司),RGD肽(无锡亚肽生物科技有限公司),pDNA(华南农业大学资源环境学院),琼脂糖(上海赛百盛基因技术有限公司),上样缓冲液(loading buffer)(TaKaRa公司,日本),DNaseⅠ(TaKaRa公司,日本),纯钛板( 宝鸡三线有色金属材料厂)。
FT-IT Nicolet Impact 410型红外光谱仪(Nicolet公司,美国),Elementar Vario EL Ⅲ元素分析测定仪(Elementar公司,德国),BG-power 600电泳仪(北京百晶生物技术有限公司),GelDoc IT TS2凝胶成像分析系统(UVP公司,美国),NanoacopeⅢ原子力显微镜(atomic force microscope,AFM)(Veeco公司,美国),透析袋(MWCO 3500,上海绿鸟科技发展有限公司)。
1.2 钛表面物理、生化处理[7]
将商业纯钛片切割成方形试样,表面喷砂粗化后行烧结处理,然后进行混合酸液(98%H2SO4︰30%H2O2为1︰1)酸洗2 min,丙酮、无水乙醇、双蒸水依次超声清洗15 min,干燥。80 ℃、5 mo l·L-1NaOH溶液羟化处理24 h,80 ℃双蒸水陈化24 h,双蒸水冲洗,干燥。钛酸四正丁酯(C16H36TiO4)与异丙醇1︰3混合,剧烈搅拌(60 ℃,4 h),制备纳米级TiO2溶胶。羟化后纯钛浸润于溶胶反应10 min,无水乙醇超声清洗,双蒸水再羟化1 min,干燥。重复3次。反应如图1。
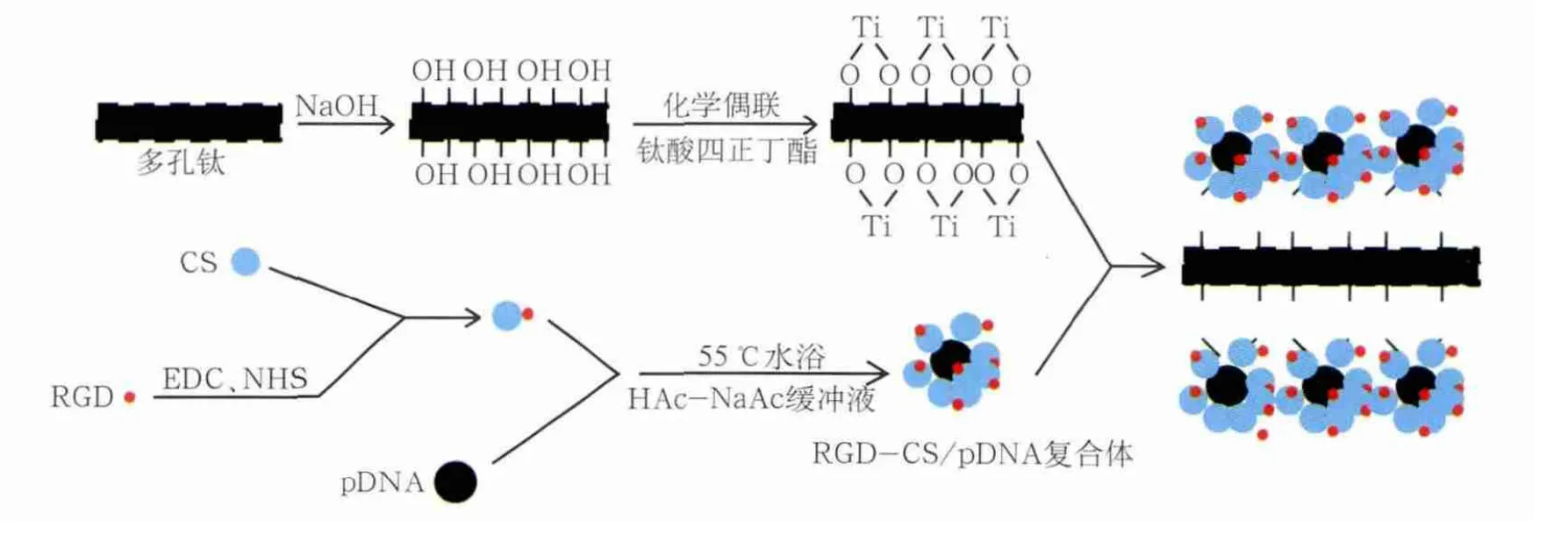
图1 纯钛表面接枝RGD-CS/pDNA复合体示意图Fig 1 The illustration of grafting RGD-CS/pDNA of titanium surface
1.3 RGD接枝CS形成RGD-CS[8]
1.3.1 酰化反应偶联RGD与CS形成RGD-CS 称取RGD肽20.0 mg,用1%HAc-NaAc缓冲液(pH 6.0)2 mL溶解。加入EDC·HCl 100 mg,NHS 50 mg,在4 ℃下磁力搅拌,活化12 h。称取相对分子质量为50×103的CS 20 mg溶于适量1%HAc溶液中,搅拌溶解。用1%NaOH溶液调节pH至6.0,得到黄色澄清溶液。在搅拌下,缓慢滴入活化的RGD溶液中。4 ℃下继续搅拌24 h。将反应液转移至透析袋中,用去离子水透析3 d,每12 h更换一次透析液。透析完毕后,产物冻干待用。反应如图1。
1.3.2 RGD-CS化学结构的表征检测 采用红外光谱仪对RGD-CS进行红外光谱检测(KBr压片法),元素分析仪对CS、RGD、RGD-CS 3种样品中元素C、H、N的含量进行测定。
1.4 RGD-CS包装pDNA
1.4.1 复凝聚法制备RGD-CS/pDNA复合体 称取RGD-CS 10.0 mg,溶于0.2 mol·L-1HAc-NaAc缓冲液(pH 5.0)10 mL中,配制成质量浓度为1 mg·mL-1的RGD-CS溶液。将pDNA配制成0.1 mg·mL-1的溶液。在每一部分实验中,保持每个样品中加入的DNA的质量一定,按照不同的N/P(阳离子载体中的氮原子与DNA的磷原子的摩尔比例)加入一定量的RGD-CS溶液,N/P为0、1、2、5、10、20、50。采用0.2 mol·L-1HAc-NaAc缓冲液(pH 5.0)将复合体溶液定容至相同体积。分别取RGD-CS溶液与骨形态发生蛋白(bone morphogenetic protein,BMP)2质粒溶液在55 ℃水浴预热10 min,迅速将二者混合,通过涡旋仪混匀1 min,将混合物在室温下放置30 min,即得RGD-CS/pDNA复合体。反应如图1。以不经RGD修饰的CS作为对照,在同样条件下,合成CS/pDNA复合体。
1.4.2 凝胶电泳阻滞试验检测RGD-CS对质粒的包裹情况 选取不同N/P比制备样品,取16 μL RGD-CS/BMP2复合体与4 μL Loading Buffer混合,在120 mV电压下电泳30 min。紫外灯下观察RGD-CS对质粒的包裹情况。
1.4.3 AFM观察RGD-CS/pDNA复合体 取RGD-CS/pDNA复合体固定于云母片上,在轻敲模式下用AFM观察其形态,轻敲频率37 kHz,扫描速度1.00 Hz,扫描范围5 μm×5 μm(粗略扫描)或2 μm×2 μm(精细扫描)。
1.5 RGD-CS/pDNA复合体接枝钛片
1.5.1 RGD-CS/pDNA复合体接枝钛片的制备 将钛酸四正丁酯(C16H36TiO4)与异丙醇以1︰3的体积比混合,剧烈搅拌(60 ℃,4 h),制备纳米级TiO2溶胶。羟化后纯钛浸润于溶胶,反应10 min,无水乙醇超声清洗,双蒸水再羟化1 min,干燥。重复上述过程3次。配置7%的3-氨基-三甲氧基硅烷/正己烷自组装液,溶胶涂层后,钛试样置于密闭容器中与自组装液反应,室温24 h,正己烷溶剂超声清洗15 min。将RGD-CS/pDNA复合体按5 mg·mL-1溶于0.1 mol·L-12-吗啉乙磺酸[2-(4-Morpholino)ethanesulfonic acid,MES]/0.5 mol·L-1NaCl活化缓冲液中,调节pH 6.0,使复合体浓度为1.5 mmol·L-1。加入交联剂EDC·HCl(0.4 mg·mL-1)和NHS(0.6 mg·mL-1)反应15 min,调节pH 7.0。将氨基化纯钛浸润在RGD-CS/pDNA复合体混合液中,室温避光振荡反应隔夜。30 mmol·L-1Tris液中止反应。去离子水彻底清洗钛试样3次,每次5 min,去除表面多余物理吸附的复合体,超净台风干备用。
1.5.2 EB染色法紫外灯下检测钛片表面RGD-CS/pDNA复合体的接枝效果 用移液器在钛片表面滴加0.2 pg·mL-1的EB染料,室温条件下染色10 min,在紫外凝胶成像仪下拍照;以白光下接枝有RGDCS/pDNA复合体钛片以及紫外灯下未接枝RGD-CS/pDNA复合体的钛片为对照。
2 结果
2.1 CS接枝RGD
红外光谱检测表明,在偶联了RGD肽后,RGDCS在1 630 cm-1附近的酰胺Ⅰ带显著增加(图2),这表明:在偶联的过程中生成了更多的碳氧双键,证实了酰胺化的成功。
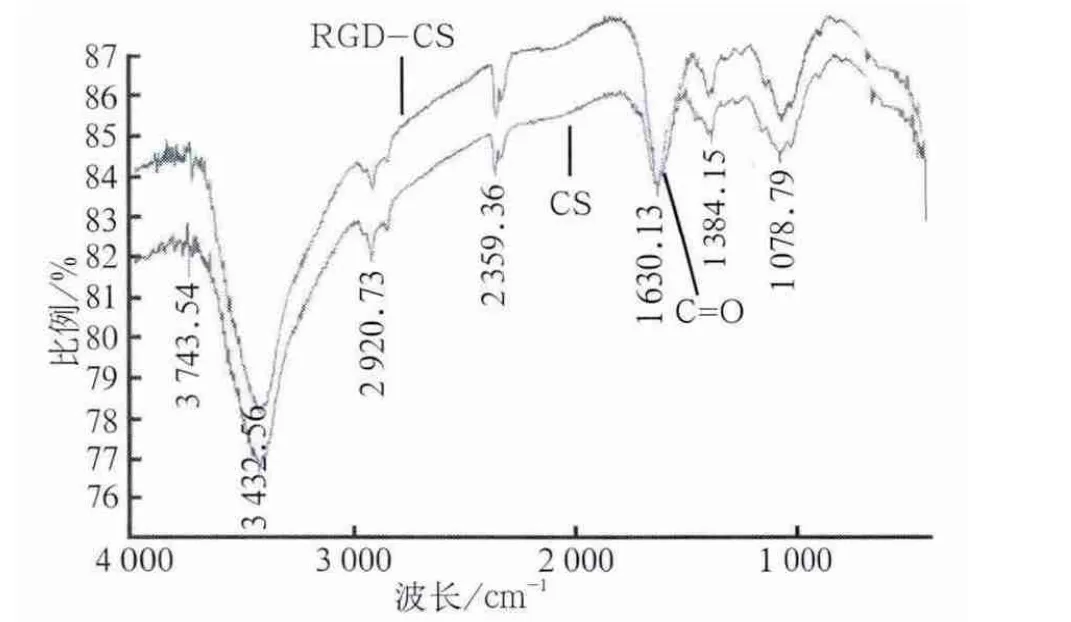
图2 红外光谱分析Fig 2 IR spectrum of CS and RGD-CS
元素分析表明,在偶联了RGD肽后,RGD-CS的N原子含量比例明显高于单纯的CS(表1),这进一步表明:CS接枝RGD成功。

表1 CS/RGD/RGD-CS的元素分析结果Tab 1 Element analysis of CS/RGD/ RGD-CS %
2.2 RGD-CS包装pDNA
凝胶电泳阻滞试验表明:N/P≥2时,pDNA质粒可完全被RGD-CS包裹(图3),表明RGD-CS与pDNA完全复合。原子力显微镜下可以清晰地看到,N/P=2时RGD-CS/pDNA复合体呈类球形(图4)。
2.3 RGD-CS/pDNA复合体接枝钛片
在紫外灯下可见钛片表面具有DNA的荧光(图5),表明钛表面接枝RGD-CS/pDNA复合体成功。
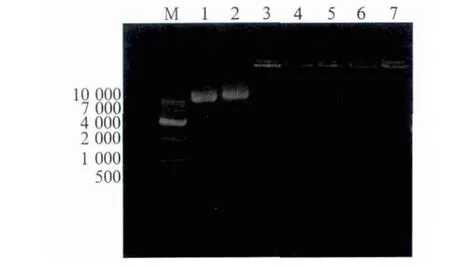
图3 不同N/P下,RGD CS对pDNA包裹的电泳图Fig 3 Electrophoregram of RGD-CS with pDNA under different N/P

图4 原子力显微镜下的RGD-CS/pDNA复合体Fig 4 RGD-CS/pDNA complexes under atomic force microscope

图5 RGD-CS/pDNA复合体接枝钛片的表面观察 EB染色Fig 5 Detect RGD-CS/pDNA complex of titanium EB staining
3 讨论
种植体表面的特性很大程度上影响了细胞的黏附及随后的细胞分化、基质分泌以及组织的愈合,因而与种植体的临床成功率密切相关[9]。有学者[10]将人工合成的RGD序列固定于生物材料表面,结果发现可以促进细胞对生物材料的黏附。将生物活性短肽RGD序列固定在种植体表面,以促进成骨细胞对纯钛或钛合金等生物材料的黏附,促进种植体骨整合,提高种植义齿的成功率,是近几年种植体表面处理研究的重要进展[11]。本研究的重点在于设计合成经RGD修饰的基因治疗载体,接枝在纯钛表面,以增加后期实验中种植体与骨的整合,进一步改善RGD 序列在种植体表面的固定方法以及RGD序列在种植体表面处理中的临床应用。
RGD与材料表面稳定的连接是促进细胞黏附的关键因素,金属钛表面缺乏可以供RGD结合的功能基团,因此需要应用生化、物理等方法处理金属钛表面,使其具有氨基、羟基或羧基等功能基团,从而能以共价键的形式与RGD相连[12]。本研究中采用纯钛片模拟在临床上使用的种植体表面处理方式,成功在壳聚糖上接枝RGD肽,并包裹BMP2质粒形成RGD-CS/pDNA复合体,之后,将复合体成功接枝在金属钛片表面,开创了全新的种植体表面处理技术。本实验用过氧化氢处理钛表面,使其产生功能羟基,利用EDC与NHS活化RGD,在NaOH在作用下,使RGD与CS接枝;在HAc-NaAc缓冲液条件下,使RGD-CS包裹质粒DNA形成RGD-CS/pDNA复合体;金属钛经NaOH、钛酸正四丁酯修饰后,以共价键形式将RGD-CS/pDNA复合体接枝到表面。这是第一次将该方法应用于种植体软组织接触部位的改性处理。元素分析证明,CS、RGD与pDNA三者成功形成了RGD-CS/pDNA复合体,原子力显微镜检测表明复合体颗粒呈类球形。RGD-CS/pDNA复合体接枝钛片后,其表面经EB染色后,可在紫外灯下观察到具有荧光,这表明钛表面存在有DNA,说明RGD-CS/pDNA复合体接枝钛片成功。
目前尚无有效的方法可以将目的基因导入贴附在种植体表面的细胞内并稳定地表达。质粒转化细胞实验技术已经非常成熟,且无需对细胞或质粒进行特别处理,便能确保质粒高效转化到细胞中[13];但在种植体表面,组织与种植体直接接触,如何使种植体表面携带的目标基因高效地转化到组织内,并在组织与种植体之间形成新的骨形成蛋白,尚无突破性进展[14]。出于此目的,本实验在结合以往技术优势的同时,创立了一种新的种植体表面修饰方法,为种植体临床应用提供了理论依据。但在本实验中,质粒已预先固定在钛表面,而后期实验细胞游离在培养基中,这与临床上种植体镶嵌于人体组织内的情况不同,后续的研究将进一步通过细胞和动物实验验证其生物安全性以及临床实用性,为种植体表面处理技术实现突破性的变革。
[1]陈奕帆, 黄元瑾, 宋光保, 等. RGD肽修饰的纯钛种植材料表面成骨细胞黏附增殖能力[J]. 实用口腔医学杂志,2010, 26(1):5-8.
[2]杨晓喻, 李世轶, 刘长虹, 等. 两种钛表面成骨细胞附着静态与动态观察[J]. 广东牙病防治, 2013, 21(11):582-585.
[3]黄旋平, 周诺, 杨媛媛, 等. 脂质体介导的hBMP-2基因转染兔骨髓间充质干细胞的实验研究[J]. 广东医学, 2011,32(23):3032-3034.
[4]Yang GL, He FM, Yang XF, et al. In vivo evaluation of bone-bonding ability of RGD-coated porous implant using layer-by-layer electrostatic self-assembly[J]. J Biomed Mater Res A, 2009, 90(1):175-185.
[5]Schuler M, Owen GR, Hamilton DW, et al. Biomimetic modi fi cation of titanium dental implant model surfaces using the RGDSP-peptide sequence: a cell morphology study[J].Biomaterials, 2006, 27(21):4003-4015.
[6]Bagno A, Piovan A, Dettin M, et al. Human osteoblast-like cell adhesion on titanium substrates covalently functionalized with synthetic peptides[J]. Bone, 2007, 40(3):693-699.
[7]吴纪程, 兰泽栋, 张端强. 重组人血管内皮生长因子和重组人骨形态发生蛋白-7对大鼠成骨细胞增殖能力的影响[J]. 广东牙病防治, 2014, 21(12):624-627.
[8]Liu WQ, Martinez JA, Durand J, et al. RGD-mediated adhesive interactions are important for peripheral axon outgrowth in vivo[J]. Neurobiol Dis, 2009, 34(1):11-22.
[9]Ryu JJ, Park K, Kim HS, et al. Effects of anodized titanium with Arg-Gly-Asp (RGD)peptide immobilized via chemical grafting or physical adsorption on bone cell adhesion and differentiation[J]. Int J Oral Maxillofac Implants, 2013, 28(4):963-972.
[10]Park JC, Lee JB, Daculsi G, et al. Novel analysis model for implant osseointegration using ectopic bone formation via the recombinant human bone morphogenetic protein-2/macroporous biphasic calcium phosphate block system in rats:a proof-of-concept study[J]. J Periodontal Implant Sci, 2012,42(4):136-143.
[11]Choi H, Park NJ, Jamiyandorj O, et al. Improvement of osteogenic potential of biphasic calcium phosphate bone substitute coated with two concentrations of expressed recombinant human bone morphogenetic protein 2[J]. J Periodontal Implant Sci, 2012, 42(4):119-126.
[12]Willett NJ, Li MT, Uhrig BA, et al. Attenuated human bone morphogenetic protein-2-mediated bone regeneration in a rat model of composite bone and muscle injury[J]. Tissue Eng Part C Methods, 2013, 19(4):316-325.
[13]Kroese-Deutman HC, van den Dolder J, Spauwen PH, et al.In fl uence of RGD-loaded titanium implants on bone formation in vivo[J]. Tissue Eng, 2005, 11(11/12):1867-1875.
[14]Chen WC, Ko CL. Roughened titanium surfaces with silane and further RGD peptide modi fi cation in vitro[J]. Mater Sci Eng C Mater Biol Appl, 2013, 33(5):2713-2722.
