酶基抗生物粘泥复合膜的制备及性能
2014-10-13姜艳军吴欣蕊周丽亚
姜艳军,吴欣蕊,冯 凯,周丽亚,高 静
(河北工业大学 化工学院,天津 300130)
生物粘泥(slime)是由微生物及其产生的胞外聚合物与其它有机和无机杂质混在一起,粘着在物体表面的粘滞性物质,广泛存在于循环冷却水系统的管道、冷却塔、船体及水下作业的设备壁上.其危害是导致设备严重腐蚀和结垢,降低换热效果、缩短设备使用寿命等,严重影响生产装置的正常运行,因此,对生物粘泥控制、剥离清洗十分必要[1].目前,控制生物粘泥的方法很多,可分为物理法、化学法和生物法[2].其中传统的控制方法是化学法,即向水系统中投加杀生剂或杀菌剂,通过直接杀灭微生物来减缓生物粘泥的生长[3].而杀生剂一般为化学药剂,会造成环境水体的污染,不符合现在倡导的绿色环保的要求.
采用生物法降解生物粘泥越来越受到人们的关注.酶是一种特殊的蛋白质,在处理过程中不会对环境造成污染,且能够有效的控制生物粘泥的生长.尽管国内已有用酶处理生物粘泥的报道,但都是将酶直接溶于水系统中以降解生物粘泥,这种方法酶易失活且不利于重复使用.在国外,近年来基于酶的抗生物粘泥涂层技术得到了重视和良好的发展[4-6].Hamade等人[7]利用溶菌酶降解细胞壁从而杀灭微生物的功能制备了含5%溶菌酶的复合涂层,并取得专利.蛋白酶、纤维素酶、淀粉酶等具有降解生物粘泥的酶类也用于涂层制备,可很好的降解生物粘泥,达到抗污效果[8-10].基于酶的抗生物粘泥涂层的一个关键问题是酶的活性和稳定性.采用固定化技术为酶创造适宜的微环境是保持酶的活性和提高稳定性的有效手段.Dordick等人[11]利用二氧化硅固定蛋白水解酶制备具有生物催化活性的抗污涂层,获得了较好的抗蛋白吸附性能.但这种抗污涂层在酶催化活性和酶活稳定性方面有待提高.
纳米材料其相对于传统的酶载体材料而言,具有良好的生物相容性、较大的比表面积、较小的扩散限制和高曲率等优点,这使得它在该领域有很大的应用空间[12-13].Jia等人[14]发现,纳米材料显著的尺寸效应可以提高酶与底物的碰撞速率,从而有效提高固定化酶的催化效率.同时,Vertegel和Kim[15-16]均证明,纳米颗粒的尺寸对固定化酶的结构有很大影响,有利于酶活的保持.氧化石墨烯和碳纳米管是新型的纳米材料.氧化石墨烯是石墨烯的氧化物,其表面具有丰富的氧基官能团[17-19].而碳纳米管是由石墨片层卷成的无缝、中空管体.氧化石墨烯和碳纳米管均具有超大的比表面积、良好的介导性质,此外,由于氧化石墨烯表面大量官能团的存在,其碳骨架在理论上存在无限修饰和官能化的可能[20-21].这两种纳米材料在固定化酶领域都有良好的应用前景.本研究以物理吸附法固定胰蛋白酶,载体与蛋白酶之间以弱相互作用相结合,制备方法简便,固定条件温和.Karajanagi等人[22]研究发现,以碳纳米管为载体固定糜蛋白酶时,酶分子的二级结构很稳定, 螺旋和 折叠的数量均没有明显的增减.Rege等人[23]对比研究了聚甲基丙烯酸甲酯(PMMA)、聚苯乙烯(PS)和聚乳酸(PLA)三种聚合材料分别与固定化酶结合制备复合膜的催化活性和稳定性,结果发现PMMA复合膜的酶催化活性要远高于其它材料制备的复合膜.
本研究选用多壁碳纳米管和可大量修饰和官能化的氧化石墨烯2种材料为载体固定胰蛋白酶,并将固定化酶与高分子聚合材料聚甲基丙烯酸甲酯(PMMA)相结合,制备具有生物催化活性的酶基抗生物粘泥复合膜,并从多方面对复合膜的稳定性、力学性能、抗污性能等进行了评价和研究.
1 实验材料和方法
1.1 实验材料
胰蛋白酶、牛血清白蛋白(BSA)由鼎国生物技术有限公司购买;多壁碳纳米管(MWNTs)由深圳纳米港有限公司生产;氧化石墨烯(GO),由山西煤炭化学研究所生产;聚甲基丙烯酸甲酯(PMMA)由荣昌塑胶原料公司生产;磷酸一氢钠、磷酸二氢钠、氢氧化钠、三氯乙酸(TCA)、干酪素、考马斯亮蓝 G250、氯化钠、酵母浸粉、胰蛋白胨、甲苯、丙酮、无水乙醇、甲醇、异丙醇均由天津市江天化工技术有限公司生产;金黄色葡萄球菌(S.aureus)、大肠杆菌(E.coli)由本实验室自己培养获得.
1.2 实验仪器
WDW-02微控电子万能试验机,长春新科实验仪器有限公司;DSA30研究型接触角测量仪,德国Kruss公司;冷冻高速离心机,SIGMA公司;紫外可见分光光度计Evolution300,Thermo FisherScientific公司;集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;光学显微镜XSZ-H、电子天平、pH计,上海精密科学仪器有限公司.
1.3 实验方法
1.3.1 固定化酶的制备
将2mgMWNTs(或GO)载体置于1m L pH 7.0的磷酸盐缓冲溶液(PBS)中,超声波处理15min,使其均匀分散.冷却至室温,加入用同样缓冲溶液配制的酶液,室温下,摇床200 r/m in吸附2h.10000 r/min下离心20min,弃上清液,加入pH 7.0的PBS缓冲液洗去未被固定的游离酶.再离心,重复上述步骤3次.向得到的固定化酶中加入2m L丙酮溶剂,混合振荡1m in后离心弃上清,重复3次,使有机相完全置换出固定化酶中的水相后,将固定化酶置于通风处2 h左右,待有机溶剂完全挥发后,即得到干燥的固定化酶.
1.3.2 固定化酶活性检测
胰蛋白酶催化水解底物酪蛋白生成不被三氯乙酸沉淀的小分子肽以及氨基酸.在一定浓度范围内,酶的水解滤液在波长275 nm处光吸收的增值与胰蛋白酶的活力单位成正比,测定中以标准酪氨酸溶液的光吸收作对照,根据活力单位的定义,确定样品中胰蛋白酶的活性.酶活力单位的定义:25℃,pH 7.0条件下,单位时间内生成1 g酪氨酸所需要的酶量为1U.
在25℃下,向制得的固定化酶中加入2m L 1%的酪蛋白溶液,反应5m in,加入2m L 20%的TCA溶液终止反应.8 000 r/m in离心5m in,过滤上清液,在275 nm紫外光下测上清液的吸光度值.
1.3.3 不同有机溶剂对固定化酶活性的影响
分别取2m L甲醇、乙醇、丙酮、异丙醇和甲苯加入到用PBS缓冲液洗好的固定化酶中,振荡1min,使有机相和水相充分混合,5 000 r/m in下离心5 m in,弃上清,重复上述步骤三次以完全除去固定化酶中的水相,将酶置于通风处2 h,有机溶剂挥发后即可得到干燥的固定化酶粉.检测对比其活性.
1.3.4 抗生物粘泥复合膜的制备
分别取10mg胰蛋白酶粉和10mg MWNTs或2mg GO,按上述方法制备固定化酶,得到两种干燥的固定化酶粉末.另称取10mg胰蛋白酶粉至试管内.称1 g PMMA颗粒,加入到3 g甲苯中,在80℃恒温磁力搅拌水浴锅中溶解完全,稍冷却至室温后加入制备好的MWNTs-Enzyme,混合均匀,平铺在玻璃板上,晾干即可.GO-Enzyme-PMMA复合膜和Enzyme-PMMA复合膜的制备方法同上.
1.3.5 抗生物粘泥复合膜活性检测
将复合膜置于10m L 1%的酪蛋白溶液中,30℃下反应30m in,加入TCA终止反应,离心过滤上清液,在275 nm波长下测吸光度值.
1.3.6 抗蛋白质吸附实验
配制10mg/m L的BSA溶液,将面积为2.5×4 cm2的抗生物粘泥复合膜完全浸没其中,4℃下冷藏保存.用Bradford法分别测复合膜表面的蛋白质吸附量,即将复合膜在蒸馏水中轻蘸3次后,用PBS缓冲液反复淋洗复合膜,以洗下膜表面吸附的蛋白质.取1m L待测液加入到5m L考马斯亮蓝溶液中,反应5m in,在595 nm波长下测吸光度值.
1.3.7 抗菌实验
选金黄色葡萄球菌(革兰氏阳性菌)和大肠杆菌(革兰氏阴性菌),LB培养基常温摇床培养12h,使细菌处于对数期末期.将面积为2×5 cm2的复合膜浸没于细菌悬浊液中,25℃下摇床150 r/m in培养2 h,取出后将复合膜放入蒸馏水中轻蘸3次,去掉表面未附着的细菌.结晶紫染色液染色,晾干.在膜表面任意位置覆盖1张网格片,其中每小格的面积为190 m2.用光学显微镜油镜观察,随机数出每1小格内细胞个数.在不同位置重复上述步骤10次,得到N1-N10.最后计算出单位面积(1 cm2)复合膜表面附着的细胞总个数N.
所有实验数据均取3次平行实验结果的均值.
2 结果与讨论
2.1 载体与酶的质量比对固定酶活性的影响
不同载体对酶的负载能力不同,首先研究了 MWNTs和GO对胰蛋白酶的负载能力.在固定两种载体质量均为2 mg的情况下,依次加入不同质量的胰蛋白酶粉,得到了酶与载体的最佳质量比,优化了固定化酶的条件.如图1所示.
载体MWNTs和GO达到吸附饱和时,与酶的质量比分别为1∶1和1∶5,继续增大酶的加入量,酶活性基本保持不变.在两种载体达到吸附饱和时,MWNTs固定化酶的比活力为32.1 U/mg蛋白,GO固定化酶的比活力为8.83 U/mg蛋白.可以看出,MWNTs固定化酶的活性要远大于GO固定化酶,这是因为MWNTs可以增加吸附在其表面的蛋白质的稳定性,从而有助于更好的保持酶的催化活性[24].
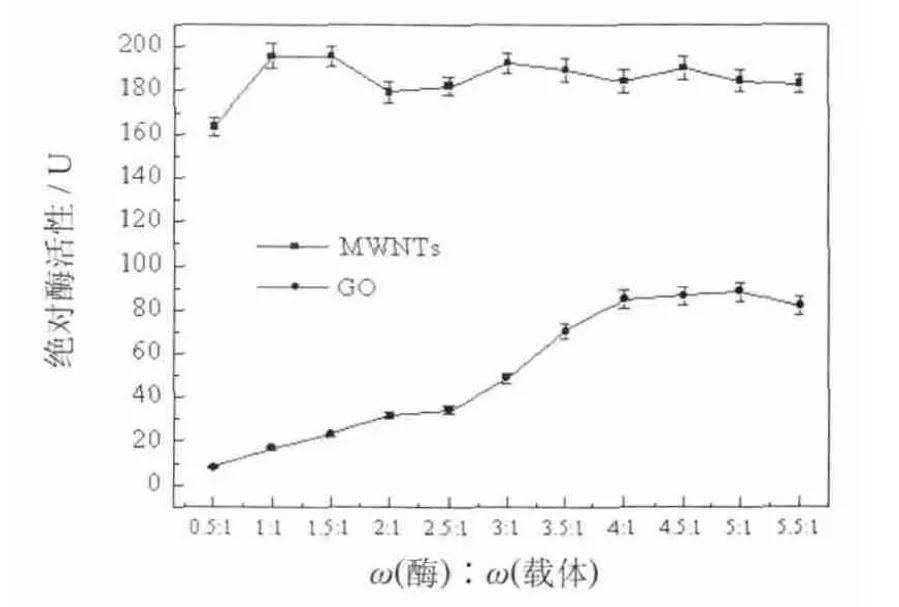
图1 载体与酶的最佳质量比Fig.1 Theoptimal ratio of enzymeand supports
2.2 不同有机溶剂对固定化酶活性的影响
研究了甲醇、乙醇、丙酮、异丙醇和甲苯5种有机溶剂对固定化蛋白酶活性的影响规律(见表1).结果表明,与用pH 7.0的PBS缓冲液淋洗固定化酶相比,丙酮可成倍的提高酶活性,乙醇也能够很好的保持酶活性;相反,甲醇和异丙醇则会造成酶活性的大幅损失,而甲苯会使固定酶活性损失40%左右.这与M ichaela等人的研究结果一致[24].部分有机溶剂能提高蛋白酶活性的原因是溶剂在使酶分子脱水的同时能将酶活变性损失降到最低,且使绝大多数酶分子处在活化构象上,有利于酶催化反应的进行[25].
2.3 酶基抗生物粘泥复合膜性能评价
2.3.1 酶基抗生物粘泥复合膜的稳定性研究
图2为制备好的复合膜样品,从左向右依次为GO-Enzyme-PMMA复合膜、MWNTs-Enzyme-PMMA复合膜和不含酶的PMMA膜.
首先对复合膜的保存稳定性进行了研究.对照实验为用胰蛋白酶粉制备的复合膜.将复合膜分别置于25℃和50℃干燥恒温环境中保存,每3 d取出1次测其活性,加入酶粉的复合膜在第12 d的时候活性基本降为0,而加入固定化酶的复合膜表现出良好的稳定性.在第30 d时,25℃保存的GO-Enzyme-PMMA复合膜酶活性能保持在91.1%,50℃保存的则为89.9%,两者相差不大,可见GO能对酶起到较好的保护作用.而对于MWNTs-Enzyme-PMMA复合膜而言,因为MWNTs具有良好的介导性质和特殊的理化性质,能够较好的保护酶的活性位点[24],从而大幅降低了酶在高温条件下的活性损失.而在Dordick等人利用二氧化硅固定酶并制备成抗生物粘泥涂层的实验中,涂层在55℃下保存3 h后,酶活性损失已高达50%[11],由图3可以看出,MWNTs和GO两种载体材料均能使蛋白酶的稳定性增强,且效果明显.不加入MWNTs或GO时,聚合物基质表面有很多能够允许水分子通过孔隙,这就使水溶性酶分子很容易流失.当MWNTs或GO存在时,一方面酶分子可以吸附在载体上从而减少酶活的泄漏,另一方面固定化酶的加入使其附近的聚合物分子发生重组,最终改变聚合物分子的流动率,有效的将酶固定在复合膜内[23].
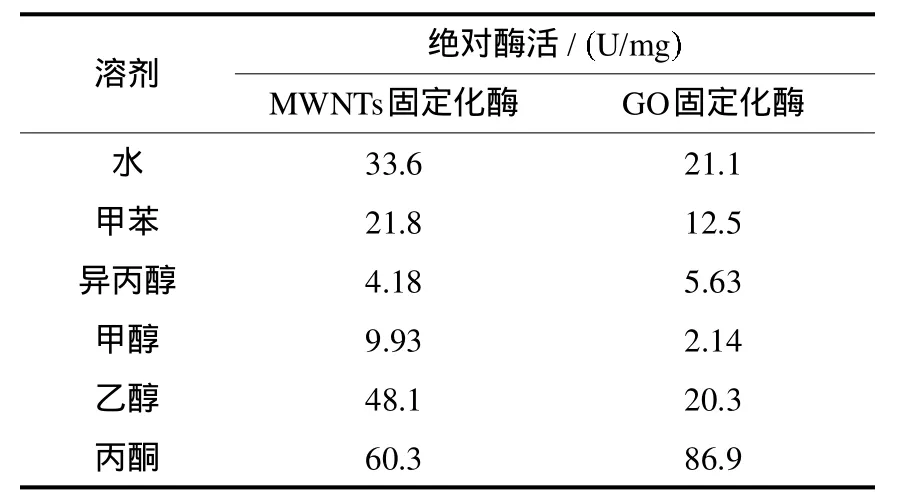
表1 不同有机溶剂对固定化酶活性的影响Tab.1 Influence of differentorganic solvent on Enzyme activity

图2 抗生物粘泥复合膜Fig.2 Antifouling films
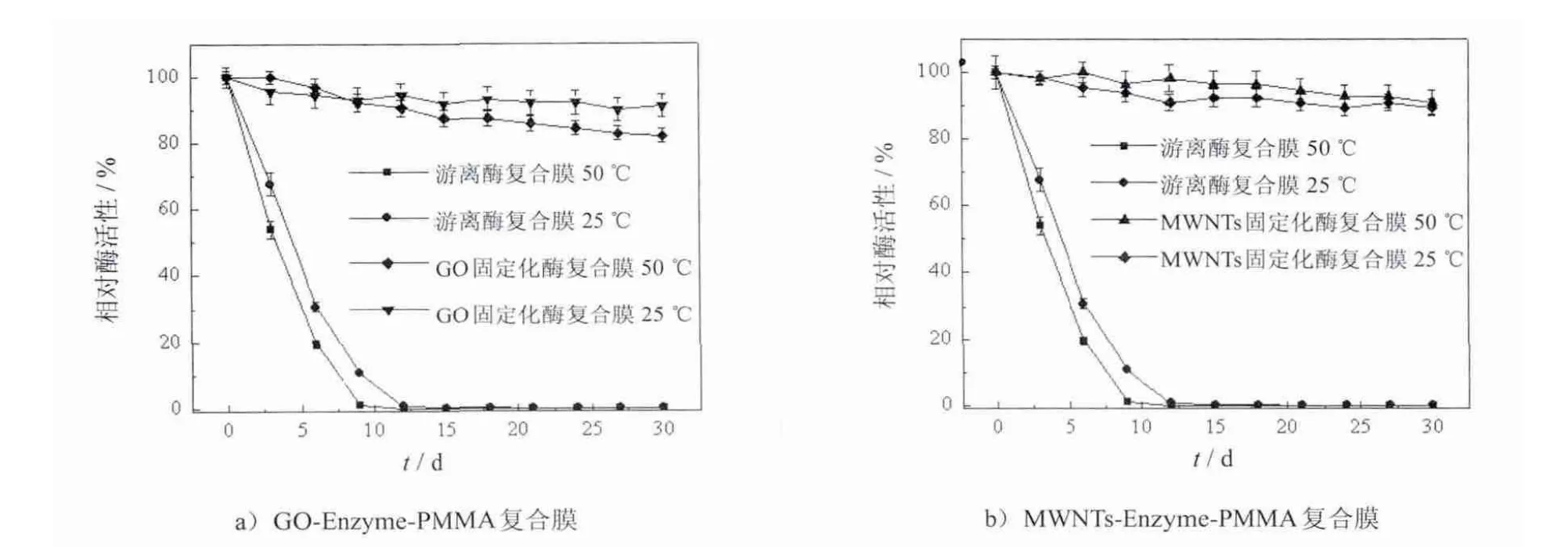
图3 复合膜的保存稳定性Fig.3 Storagestability of GO-Enzyme-PMMA film and MWNTs-Enzyme-PMMA film
2.3.2 酶基抗生物粘泥复合膜的操作稳定性研究
福建竹编的主要技法是“雀目法”,“雀目法”的“雀目”是指六角形透空雀目格,这是由4条篾连贯且交叉地编织而成的。因此,编织而成的竹编工艺品具有透空疏朗的效果。竹编可以通过漂白、染色、上漆获得不同的颜色。漂白后的竹编颜色比较自然朴素,很好地保持了竹子本来的颜色。而染色竹编的颜色主要以老棕色为主,色调比较沉重,工序却并不简单,要经过多次的染色后再进行磨光才能完成。此外,还有一种上漆竹编,是在竹编表面上漆,使竹编工艺品不仅具有竹编的外形,还具有漆器的质感,因此显得非常别致。上漆竹编的品种主要有瓶、盘、罐、篮、盒、灯罩、屏风、挂帘、枕席等[11]。
将加入固定化酶的复合膜连续6次放入新鲜的酪蛋白溶液中,以加入具有相同活力的胰蛋白酶粉的复合膜为参照,比较发现,在6次的反应中2种加入固定酶的复合膜均未见明显的酶活损失现象,而加入酶粉的复合膜酶活降低很快.这与两种载体材料特有的高表面积-体积比有关.超大的表面积使载体与酶能够充分作用结合牢固,减少了酶的泄漏损失.同时,MWNTs固定酶的稳定性要优于GO固定酶,说明固定酶活性和稳定性的提高不仅和碳纳米材料的理化性质有关,MWNTs的高曲率半径和特有的化学性质也起到了重要作用[23].
以上实验结果表明,加入固定酶的复合膜稳定性和重复使用性都优于加入酶粉的复合膜.因此在后续实验中,不再研究含酶粉的复合膜.
2.3.3 酶基抗生物粘泥复合膜的力学性能和亲疏水性
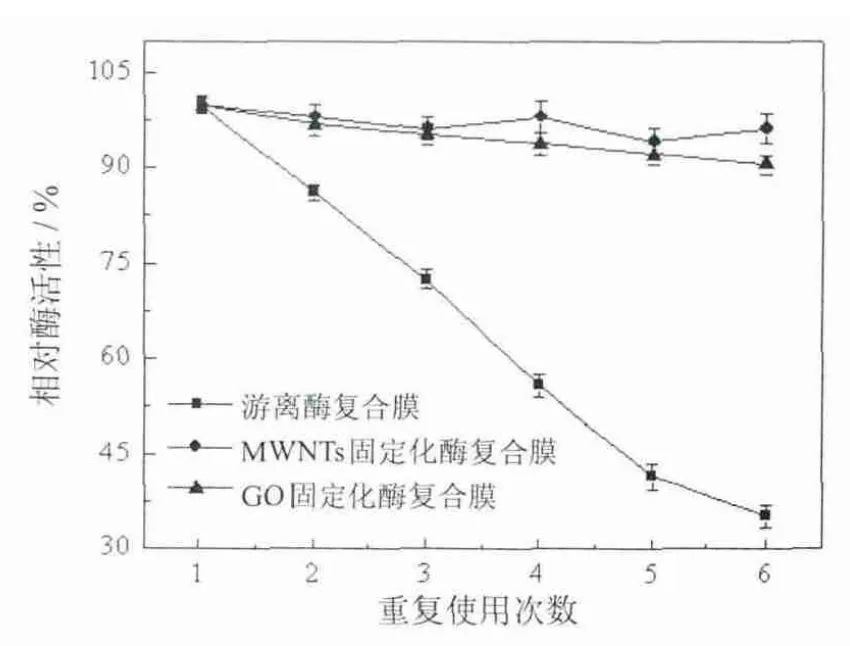
图4 复合膜的操作稳定性Fig.4 Recycling stability of the films
如表2所示,在拉伸实验中,不加入酶的PMMA膜抗拉强度为19.35MPa,断裂伸长率6.6%.加入MWNTs固定酶后其抗拉强度为19.16MPa,断裂伸长率8.56%,而加入GO固定酶的复合膜抗拉强度为18.96MPa,断裂伸长率7.48%.固定化酶的加入使复合膜的抗拉强度略有降低,是因为碳纳米材料自身表面能大,会产生团聚现象从而导致固定酶在PMMA中的分散不够均匀.但加入固定酶的复合膜其断裂伸长率都有所增加,是由于作为固定酶载体的MWNTs和GO具有很好的机械性能,据报道,GO可以增加复合材料的韧性,同时,MWNTs的管状结构以及它与基体界面之间的弱作用力,如受力时存在MWNTs和基体之间的摩擦滑移、化学键的断裂等,使得复合膜的断裂伸长率增加[26-27].
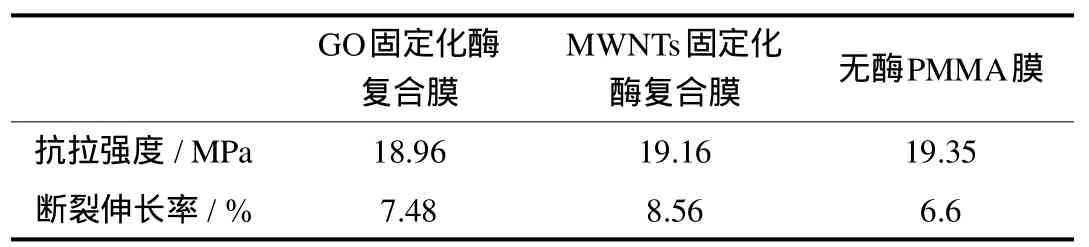
表2 抗生物粘泥复合膜的拉伸实验Tab.2 Tensile testing ofantifouling films
在亲疏水性测试中,固定化酶的加入,对PMMA材料原本的亲水性影响较小,如图6所示,不含酶的PMMA膜接触角为75°,而GO-Enzyme-PMMA和MWNTs-Enzyme-PMMA复合膜的接触角则分别为68.4°和62.4°.复合膜的这些特性,使其具备了应用的可能性.
2.3.4 酶基抗生物粘泥复合膜的抗蛋白质吸附性能

图5 复合膜的静态接触角图像Fig.5 Contactanglesof film
2.3.5 酶基抗生物粘泥复合膜的抗菌吸附性能
蛋白酶针对革兰氏阴性菌和阳性菌具有防止抗生物粘泥形成的特性,且其中丝氨酸蛋白酶的效果尤其显著.胰蛋白酶的抗菌原理不是直接杀灭微生物,而是通过降解粘细胞表面或其分泌的蛋白质来实现控制生物粘泥的形成[28].实验分别选择E.coli(革兰氏阴性菌)和S.aureus(革兰氏阳性菌)2种常见菌来进行复合膜抗菌吸附实验.结果如图7所示,将复合膜表面单位面积吸附的细胞个数值取对数,GO-Enzyme-PMMA膜表面E.coli和S.aureus个数分别为3 467/cm2和7 244/cm2,MWNTs-Enzyme-PMMA膜的则为4 467/cm2和8 318/cm2.而不含酶的PMMA膜表面细胞个数远大于前两者1~2个数量级,分别为51286/cm2和467735/cm2.由此可以看出,GO-Enzyme-PMMA和MWNTs-Enzyme-PMMA复合膜具有显著的抗菌效果.Regina等人还研究了加入变性的蛋白酶之后复合膜的抗菌性能,结果发现,变性酶并不能减少膜表面细胞的吸附[28].
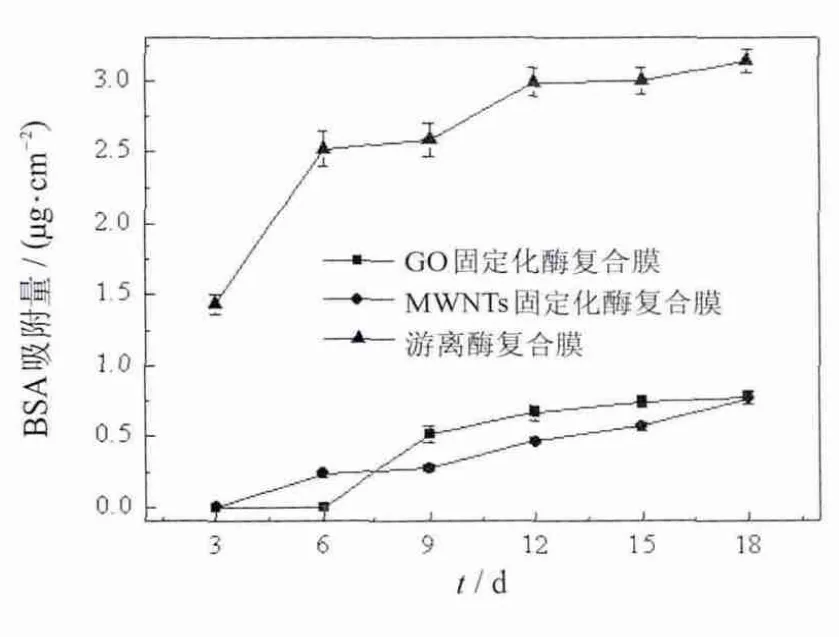
图6 复合膜表面牛血清白蛋白吸附量Fig.6 Amountof BSA adsorbed onto the films
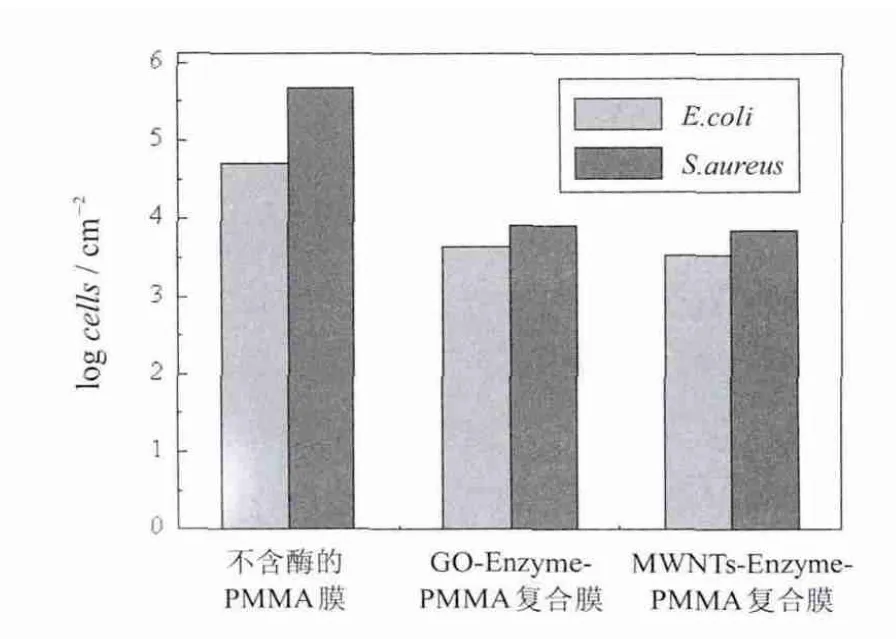
图7 复合膜表面吸附的大肠杆菌和金黄色葡萄球菌数Fig.7 Theamountof E.coliand S.aureusadhered on the films
3 结论
1)以MWNTs和GO为载体固定化胰蛋白酶,使得固定化酶的催化活性和稳定性得到一定程度的提高.其中MWNTs对酶的保护和活化作用更明显.将固定化酶与PMMA结合,制备成酶基抗生物粘泥复合膜.GOEnzyme-PMMA膜在常温、高温条件下保存30 d后,相对酶活性分别为91%和82%.MWNTs-Enzyme-PMMA复合膜在两种条件下保存30 d后,酶活性损失均为10%左右.连续使用六次后,GO-Enzyme-PMMA和MWNTs-Enzyme-PMMA膜的酶活性泄漏损失分别为10%和4%,与用胰蛋白酶粉制备的复合膜相比较,两种含固定化酶的复合膜保存稳定性和操作稳定性均显著提高.
2)实验对两种酶基抗生物粘泥复合膜进行了性能评价.首先,固定化酶的加入对PMMA材料本身的物理性质影响不明显;其次,GO-Enzyme-PMMA和MWNTs-Enzyme-PMMA膜与不含酶的PMMA膜相比,前两者抗蛋白质吸附能力是后者的4倍.而在抗菌实验中,含固定化酶的复合膜表面细胞吸附个数少于不含酶的膜1~2个数量级.
与直接将生物酶溶解在水系统中去除生物粘泥的方法相比,酶基抗生物粘泥复合膜具有良好的稳定性,可在一段较长的时间内起到减少生物粘泥对材料表面附着的作用,解决了游离酶不利于回收,不可重复使用等问题.综上所述,GO-Enzyme-PMMA和MWNTs-Enzyme-PMMA复合膜能够有效的对抗生物粘泥的吸附,具有较好的应用前景.
[1]夏璐,刘芳,薛松,等.复合型杀菌剂对生物粘泥处理效果的研究 [J].环境工程学报,2011,5(10):2215-2220.
[2]Cloete TE,BrozelV S,Holy AV.Practi calaspects of biofouling controlin industrialwatersystems[J].IntBiodeteriorBiodegrad,1992,29:299-341.
[3]刘稚红,董滨.循环冷却水系统中生物粘泥的控制途径 [J].中国给水排水,2008,24:22-26.
[4]苏腾,陈中兴.酶法处理工业循环水中生物粘泥的研究 [J].中国给水排水,2002,18:5-8.
[5]Olsen SM,Pedersen L T,Laursen M H,etal.Enzyme-based antifouling coatings:a review[J].Biofouling,2007,23(5):369-383.
[6]Dinu C Z,ZhuG Y,Bale S S,et al.Enzyme-Based nanoscale composites for use as active decontamination surfaces [J].Adv FunctMater,2009,19:1-7.
[7]Hamade K R,Yamammori T N.Method for controlled release of compounds having antimicrobial activity and coating composition:US,6150146[P].2000-11-21.
[8]Kim J,Delio R,Dordick J S.Protease-containing silicates as active antifouling materials [J].Biotechnol Progr,2002,18:551-555.
[9]McDaniel C S,WalesME,Carvajal J C.Enzymatic antimicrobial and antifouling coating and polymericmaterial:US,0238811 [P].2009-09-24.
[10]Bonaventura C,Bonaventura J,Hooper I R.Antifouling methods using enzyme coatings:US,5998200 [P].1999-12-07.
[11]11]KimY D,Dordick J S,ClarkD S.Siloxane-based biocatalytic films and paints for use as reactive coatings [J].Biotechnol Bioeng,2001,72:475-482.
[12]马光辉,王平,苏志国.纳米科学与酶 [J].中国基础科学,2009,5:49-54.
[13]Almeida A J,Runge S,Muller RH.Peptide-loaded solid lipid nanoparticles(SLN):influence of production parameters [J].Int J Pharm,1997,149(2):255-265.
[14]Jia H F,Zhu G Y,Wang P.Catalytic behaviors of enzyme attached to nanoparticles:the effect of particlemobility [J].Biotechnol Bioeng,2003,84(4):406-414.
[15]VertegelA A,Siegel RW,Dordick J S.Silica nanoparticle size influences the structure and enzymatic activity of adsorbed lysozyme [J].Langmuir,2004,20:6800-6807.
[16]Kim J,Grate J W.Single-enzyme nanoparticles armored by a nanometer-scale organic/inorganic network [J].Nano lett,2003,3:1219-1222.
[17]Abatemarco T,Stickel J,Belfort J,etal.Fractionation ofmultiwalled carbon nanotubesby cascademembranem icrofiltration[J].JPhysChem B,1999,103(18):3534-3538.
[18]TansSJ,Verschueren AR,DekkerC.Room temperature transistorbased onasinglecar bonnanotube[J].Nature,1998,393(6680):49-52.
[19]Collins PG,Bradley K,IshigamiM,et al.Extreme oxygen sensitivity of electronic properties of carbon nanotubes[J].Science,2000,287(5459):1801-1804.
[20]Balandin A A,Ghosh S,BaoW Z,etal.Superior thermal conductivity of single-layer graphene[J].Nano Lett,2008,8(3):902-907.
[21]Zhang J L,Zhang F,Yang H,et al.Graphene oxide as a matrix for enzyme immobilization [J].Langmuir,2010,26(9):6083-6085.
[22]Karajanagi S S,Vertegel A A,Kane R S,et al.Structure and function of enzymes adsorbed onto single-walled carbon nanotubes [J].Langmuir,2004,20:11594-11599.
[23]Rege K,Raravikar N R,KimD Y,et al.Enzyme-polymer-single walled carbon nanotube composites as biocatalytic films [J].Nano Lett,2003,3(6):829-832.
[24]Asuri P,Karajanagi S S,Kane R S,et al.Polymer-nanotube-enzyme composites as active antifouling films [J].Small,2007,3(1):50-53.
[25]KreinerM,Moore BD,ParkerMC.Enzyme-coated micro-crystals:a 1-step method for high activity biocatalyst preparation [J].ChemCommun,2001,12:1096-1097.
[26]AndrewsR,Jacques D,M inotM,etal.Fabrication of carbonmulti walled nanotube/polymer compositesby shearm ixing[J].MacromolMater and Eng,2002,287(6):395-403.
[27]Verdeio R,Barroso-BujansF,Rodriguez-PerezM A,etal.Functionalized graphenesheetfilled silicone foam nanocomposites[J].JMaterChem,2008,18(19):2221-2226.
[28]Regina V R,Sohoel H,Lokanathan A R,etal.Entrapmentof subtilisin in ceram ic sol-gel coating for antifouling applications[J].ApplMater Interfaces,2012,4(11):5915-5921.
