固相反应法制备纳米ZnO及其晶粒生长动力学
2014-10-11张帅国米杰尚素利上官炬武蒙蒙
张帅国,米杰,尚素利,上官炬,武蒙蒙
(太原理工大学煤科学与技术教育部和山西省重点实验室,山西 太原 030024)
纳米氧化锌作为一种新型的无机非金属材料,近年来受到了广泛的关注。广泛应用于压敏电阻[1]、气敏元件[2]、太阳能电池[3]和煤气脱硫剂[4]等诸多领域。氧化锌作为中高温煤气脱硫剂的活性组分,其粒子的大小是影响性能的主要因素,而它的制备过程决定了ZnO粒子的化学、物理性质及其微观形态[5]。通过改变制备方法获得粒径小的纳米颗粒是获得性能优异的煤气脱硫剂的关键。目前,纳米氧化锌的制备方法有很多,主要包括溶胶-凝胶法[5]、直接沉淀法[6]、微乳液法[7]、均匀沉淀法[8-9]等。但是这些方法都存在某些不足,水溶液沉淀法可以批量制备氧化锌粉体,但是产物易团聚,多用于制备氧化锌催化剂;均匀沉淀法可以制备单分散的纳米氧化锌,但成本高;溶胶-凝胶法多用于制备纳米氧化锌膜;微乳液技术的特点是粒子小、较为集中、成本高、副产物难以分离[10]。低热固相合成法[11]是近几年来发展起来的一种价廉简易的方法,具有无需溶剂、产率高、反应条件易掌握等优点[12],能够克服传统制备方法的一些缺点。本文采用固相合成法制备纳米氧化锌前体,分别通过马弗炉和微波两种焙烧方式得到纳米氧化锌,并通过改变焙烧温度和焙烧时间来考察晶粒的生长过程并进一步研究得出这两种焙烧方式制备的纳米氧化锌晶粒生长动力学规律。
1 实验部分
1.1 样品的制备
以1∶1的摩尔比准确称量乙酸锌和草酸,预先研磨均匀后放在行星式球磨机中研磨2 h后取出,分别放入微波炉(MKX-M1,青岛迈威微波化学设备有限公司)和马弗炉(XL-1,天津市通达实验电炉厂)中焙烧,焙烧温度为450 ℃、500 ℃、550 ℃、600 ℃,待温度上升至预设温度时计时,每隔 1 h取一次样,分别取4个样。
1.2 样品的表征
采用德国German NETZSCH-STA409C型综合热分析仪表征草酸锌的热分解过程。其中,升温速率β=10 ℃/min,氮气流量为 40 cm3/min,样品质量为10 mg,最终温度为600 ℃。采用日本Rigaku公司的D/MAX2500型XRD,使用CuKα射线,波长λ=0.154056 nm的辐射源,石墨单色管,管电压为40 kV ,管电流为100 mA。扫描范围2θ为20°~80°表征样品。纳米氧化锌的平均粒径(直径)可由衍射峰的半峰宽根据谢乐公式D=0.89λ/βcosθ计算得到,并使用日本电子株式会社 JEM-1011型透射电子显微镜对粒子形态进行表征。采用日本岛津公司生产的傅立叶变换红外光谱仪 FTIR-8400s对前体草酸锌的结构进行测定,测定波数范围为4000~400 cm−1。
2 结果与讨论
2.1 前体的结构分析
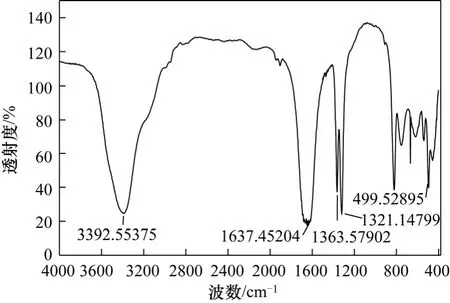
图1 前体的红外光谱图
图1给出了纳米氧化锌前体的红外谱图,其中,3392.55 cm−1波数处是典型的结晶水—OH 的伸展振动吸收峰; 1363.58 cm−1和1321.14 cm−1处的两个连续的峰为 C2O42−的对称伸缩振动吸收峰;1637.45 cm−1处的强峰为 C2O42−的面内伸缩振动峰或面内变形吸收峰,499.53 cm−1处的吸收峰为Zn—O的伸缩振动峰结合。综上所述,该物质为二水合草酸锌,与Yang等[13]报道的ZnC2O4·2H2O红外光谱图一致。结合红外分析可以推测球磨过程发生反应如式(1)。
2.2 前体的热分析
图2为前体的热重与差热分析(TG/DTA) 曲线。在从室温到600 ℃的温度范围内,二水合草酸锌的热分解过程分为两个步骤:在大约90~171 ℃范围内失重百分比为 19.1%,这与一个水合草酸锌分子脱去2个水分子理论值19.04%相对应,与此对应的是一个脱水的吸热峰;在 325~413 ℃范围内失重率为 36.6%,这与前体草酸锌分子同时脱去CO、CO2分子的理论失重率 38.09%相吻合,可以看出,在 350 ℃左右草酸锌已经开始分解。在400 ℃之后热重曲线基本平缓,说明在此温度下分解过程已经完成。由此推断前体水合草酸锌的热分解过程为式(2)~式(3)。

图2 前体草酸锌的TG-DTA 曲线

2.3 纳米ZnO晶粒的晶体结构分析
图3所示为微波和马弗炉不同温度下焙烧3 h后样品氧化锌的 XRD谱图。由于草酸锌的分解温度在350 ℃左右,因此当焙烧温度在450 ℃时,前体已经分解完全,此时,纳米氧化锌的结晶度也较大。可以看出两种加热方式下样品的结晶度均随着加热温度的升高而变大,相同温度下,与马弗炉加热相比,由微波加热的样品峰形更加尖锐,说明微波焙烧可以促使晶粒更快的生长并且完全发育,结晶度更高。这可能是由微波的特殊加热[14]引起的。在微波加热下,500 ℃时峰形已经尖锐对称,故使用微波煅烧纳米氧化锌时,可以在更低的温度下进行,需要更短的焙烧时间。用谢乐公式计算样品的晶粒直径,得到数据如表1所示。可以看出,微波焙烧的纳米氧化锌粒径明显大于马弗炉焙烧,这再次证明微波焙烧能够加快晶粒的生长速率。图4是600 ℃时两种加热方式下加热2 h的透射电镜图。可以看出颗粒粒径分布均匀,与 XRD计算结果基本吻合。微波焙烧粒径明显大于马弗炉焙烧样品粒径。
2.4 纳米氧化锌的晶粒生长动力学
草酸锌煅烧过程中,晶粒生长的过程动力学可采用式(4)[15]来描述。
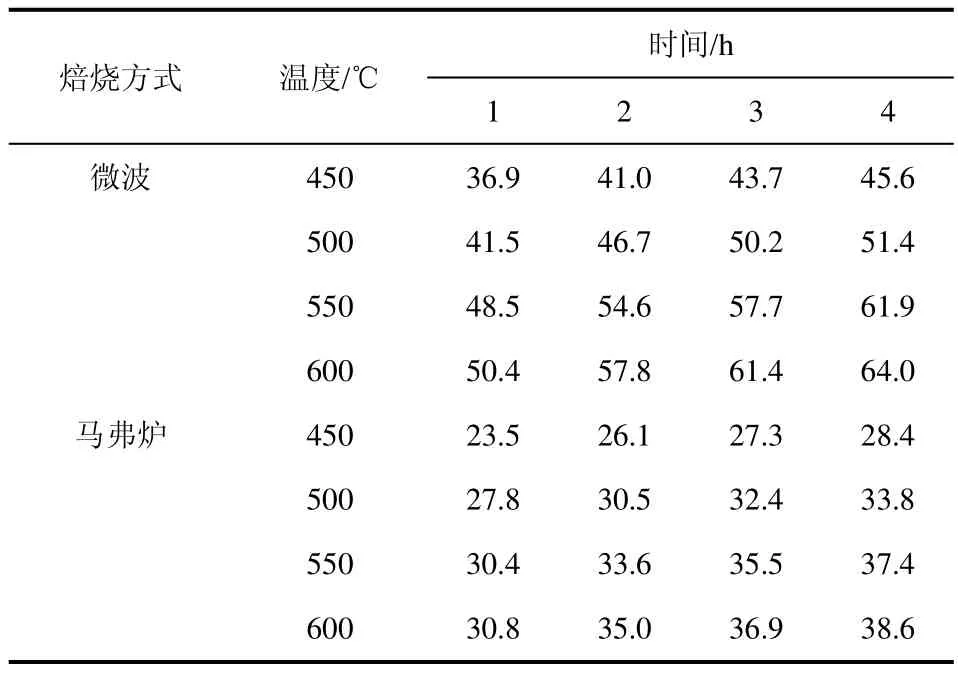
表1 不同温度和时间下两种加热方式处理所得样品的平均粒径 单位:nm
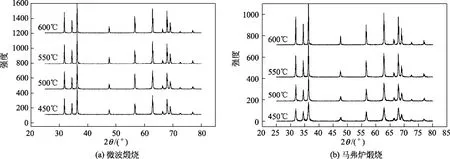
图3 不同温度下煅烧3 h样品的XRD谱图

图4 马弗炉和微波焙烧方式下制备的纳米氧化锌的TEM图片
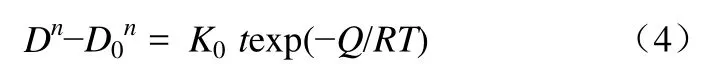
式中,D为平均晶粒大小;n为晶粒生长动力学指数,在一定程度上反映了晶粒生长过程的传质机理,不同的n对应不同的传质机理;t为焙烧时间,h;D0为起始晶粒大小;K0为常数;Q为晶粒长大激活能,kJ/mol;R为气体常数;T为绝对温度,K。
由于煅烧过程中D>>D0,所以式(4)可以简化为式(5)。

当温度T一定时,K0为常数,对式(5)两边取对数,得式(6)。
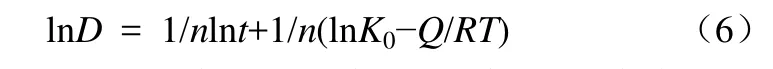
由式(6)可以看出,纳米氧化锌的晶粒生长动力学指数n可由lnD~lnt的关系曲线得出。根据表1数据,773 K下对两种加热方式下,不同焙烧时间样品的lnD~lnt进行线性拟合,得到晶粒生长动力学结果如表2所示;对式(6)变形可得式(7)。
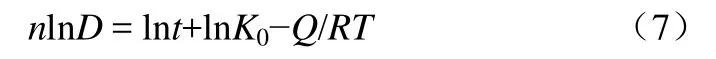
对lnD-1/T作图,根据lnD-1/T的直线关系,由斜率求得不同焙烧时间下的晶粒生长激活能,如表3所示。

表2 ! 不同温度下两种焙烧方式晶粒生长动力学指数

表3 不同时间下两种焙烧方式的晶粒生长激活能
对于前体的煅烧过程,由表2数据可以得出,微波和马弗炉两种加热方式下的晶粒平均生长指数分别为6.114和6.858。微波焙烧方式下的晶粒生长动力学指数小于常规加热方式,说明微波加热下晶粒生长速率更大。微波加热下晶粒生长机理与马弗炉焙烧下不同,但是差别不大,这可能与氧化锌的微波弱吸收性能有关。根据表3,微波焙烧时晶粒生长平均活化能和常规加热方法下平均活化能分别是70.67 kJ/mol和52.13 kJ/mol。这可能是微波的促进扩散作用[16]和 “非热效应”的影响[17],也有可能是由于微波焙烧下,由于焙烧前期是晶粒迅速生长、晶格发育完整阶段,而后期晶粒生长较为困难,这就导致其表观活化能大于常规方法。根据表中数据,煅烧开始时晶粒粒径都不大,表面活性均较高,且小粒子晶格发育不完整、缺陷较多,生长阻力相对较小,这就导致粒子容易通过表面扩散生长。因此推测,纳米ZnO在常压焙烧时晶粒生长机制主要受表面和晶界扩散控制,反应控制影响较小。随着焙烧温度的升高颗粒长大,表面活性降低,晶格发育趋于完整。晶粒生长速率变小,活化能有变大的趋势。
3 结 论
在微波和马弗炉两种加热方式下进行了氧化锌晶粒生长动力学研究。相同温度、时间下,微波煅烧晶粒尺寸明显大于常规煅烧方式;微波和常规煅烧的晶粒生长的平均动力学指数分别是 6.858和5.773,晶粒生长的平均活化能分别为70.67 kJ/mol和52.13 kJ/mol,两种焙烧方式下晶粒生长传质机理不同;由于微波较快的升温速率以及加热过程均匀的特性使其在低温固相化学反应法制备 ZnO粉体在焙烧温度及时间上应该小于常规方法,是一种无溶剂、能耗低的绿色化学制备方法。
[1]Liu H Y,Kong H,Ma X M,et a1.Microstructure and electrical properties of ZnO-based varistors prepared by high-energy ball milling[J].Journal of Materials Science,2007,42(8):2637-2642.
[2]沈茹娟,贾殿赠,梁凯,等.纳米氧化锌的固相合成及其气敏特性[J].无机化学学报,2000,16(6):906-910.
[3]Lin C F,Lin H,Li J B,et a1.Electrodeposition preparation of ZnO nanobelt array films and application to dye-sensitized solar cells[J].Journal of Alloys and Compounds,2008,462(1-2):175-180.
[4]Sun J, Modi S,Liu K,et a1.Kinetics of zinc oxide sulfidation for packed-bed desulfurizer modeling[J].Energy﹠Fuels,2007,21(4):1863-1871.
[5]Ristic M,Music S,Ivanda M,et a1.Sol-gel synthesis and characterization of nanocrystalline ZnO powders[J].Journal of Alloys and Compounds,2005,397(1-2):L1-L4.
[6]丁士文,张绍岩,刘淑娟,等.直接沉淀法制备纳米ZnO及其光催化性能[J].无机材料学报,2002,18(10):1015-1019.
[7]Yıldırım O A,Durucan C.Synthesis of zinc oxide nanoparticles elaborated by microemulsion method[J].Journal of Alloys and Compounds,2010,506(2):944-949.
[8]汤皎宁,龚晓钟,李均钦.均匀沉淀法制备纳米氧化锌的研究[J].无机材料学报,2006,21(1):65-69.
[9]王金敏,高濂.纳米ZnO的沉淀法制备、表征及影响因素分析[J].无机材料学报,2003,18(6):1357-1361.
[10]胡泽善,汤敏,丁社光,等.纳米氧化锌的化学制备技术及其进展[J].材料导报,2008,22(S2):69-73.
[11]周益明,忻新泉.低热固相合成化学[J].无机化学学报,1999,15(3):273-292.
[12]张永康,刘建本,易保华,等.常温固相反应合成纳米氧化锌[J].精细化工,2000,17(6):343-344.
[13]Yang L,Wang G Z,Tang C J,et a1.Synthesis and photoluminescence of corn-like ZnO nanostructures under solvothermal-assisted heat treatment[J].Chemical Physics Letters,2005,409(4-6):337-341.
[14]王辉,朱俊杰.液相微波介电加热法制备纳米粒子的研究进展[J].无机材料学报,2002,18(4):329-334.
[15]Han J,Mantas P Q,Senos A M R.Grain growth in Mn-doped ZnO[J].Journal of the European Ceramic Society,2000,20(16):2753-2758.
[16]Whittaker A G.Difusion in microwave-heated ceramics[J].Chemistry of Materials,2005,17(13):3426-3432.
[17]Janney M A,Kimrey H D,Allen W R,et a1.Enhanced diffusion in sapphire during microwave heating[J].Journal of Materials Science,1997,32(5):1347-1355.
