银杏外种皮提取物对植物种子萌发及幼苗生长的影响
2014-10-10赵东亚唐进根陈利红曹福亮
赵东亚,唐进根,陈利红,曹福亮
(南京林业大学,江苏省有害生物入侵预防与控制重点实验室,江苏 南京 210037)
我国银杏资源丰富,约占全世界的70%以上,干银杏外种皮每年至少有1.2万t。但银杏外种皮常作为废弃物被丢弃,既浪费了资源,又污染了环境[1]。因此,开发利用银杏外种皮对综合利用银杏资源、保护生态环境具有重要意义。
银杏外种皮中含有黄酮类、内酯类、多糖类、酚酸类等多种有效成分,具有多方面的活性[2-6]。目前对银杏外种皮的研究多集中在药理作用及防治病虫害方面,银杏外种皮对植物种子萌发、幼苗生长影响的研究鲜有报道。魏艳等[7]发现银杏外种皮中黄酮类物质具有除草活性。郁万文等[8]研究了银杏外种皮汁液浸种对小麦种子萌发的影响,发现低浓度的汁液促进种子萌发及生长。以上研究表明银杏外种皮对植物的生长有一定影响。
植物激素是植物体内天然存在的一种微量信号物质,对植物的生长和发育起着重要的调节作用。除了传统公认的5大类植物激素外,近年越来越多的植物激素类物质被发现,研究表明它们对植物生长发育也具有调节作用,如茉莉酸(JA)和水杨酸(SA)[9],这些物质被称为植物生长调节剂。银杏外种皮能否对植物生长起到调节剂的作用?本文对此作了初步探讨。
1 材料与方法
1.1 试验材料与仪器
试验材料:银杏外种皮(江苏省泰兴市);α-萘乙酸、萝卜、黄瓜种子均为市售。
试验仪器:电热恒温干燥箱(上海跃进医疗器械厂);微型植物粉碎机(FZ102,天津市泰斯特有限公司);旋转蒸发仪(R系列,上海申生科技有限公司)。
1.2 试验方法
1.2.1 银杏外种皮提取物制备 将收集到的银杏外种皮置于阴凉处晾干,然后烘箱内烘干至发脆,用微型植物粉碎机粉碎。称取银杏外种皮粉末80g,75%乙醇作为提取溶剂,料液比为1∶4(g/v),45℃的温度下震荡提取4 h,提取2次,合并2次的提取物溶液,3 800 r/min离心30min,4℃。离心后将提取液放入旋转蒸发仪中浓缩至膏状取出备用[10]。

图1 银杏外种皮提取物制备流程
1.2.2 溶液配制 用于测定萝卜种子的溶液配制:将银杏外种皮提取物配制成质量浓度分别为0.1,1,4,20 g/L和 100 g/L;ɑ-萘乙酸配制成质量浓度0.1,0.01,0.001 g/L。蒸馏水为空白对照,ɑ-萘乙酸为药剂对照。
用于测定黄瓜种子溶液配制:将银杏外种皮提取物配制成质量浓度分别为 0.02,0.1,1 ,5,25 g/L;ɑ-萘乙酸配制成质量浓度0.000 1,0.002,0.01,0.1,1 g/L。蒸馏水为空白对照,ɑ-萘乙酸为药剂对照。
1.2.3 发芽测定方法
(1)浸种。挑选饱满的、大小一致的种子,先用清水把种子冲洗干净,再用吸水纸吸干种子表面的水分。将萝卜种子每120粒为1组,黄瓜种子每90粒为1组,放入1个培养皿中,加入预先配好的银杏外种皮提取物溶液和ɑ-萘乙酸溶液,浸泡24 h,溶液没过种子。蒸馏水浸泡作为空白对照,放于25℃光照培养箱中暗培养[11]。
(2)发芽测定。每个处理组种子浸泡后捞起来用清水冲洗,放在分别垫有2层滤纸的培养皿中,用蒸馏水浸湿。萝卜种子每个培养皿中放40粒,黄瓜种子每个培养皿中放30粒,每个质量浓度设置重复3个。在此期间,要注意补充水分,保持滤纸湿润。每天观察种子萌发情况,统计记录3d的种子发芽率。发芽后进行光照培养,幼苗根和茎的长度长到一定程度后用游标卡尺测量。
(3)计算公式。发芽率=[发芽总粒数/试验总粒数]×100%[12]。
1.3 数据分析
instat3.0进行差异显著性分析。
2 结果与分析
2.1 银杏外种皮提取物溶液对萝卜种子萌发及幼苗生长的影响
2.1.1 银杏外种皮提取物溶液对萝卜种子发芽率的影响 结果见表1。从表1中看出,空白对照试验中,种子发芽率最高。银杏外种皮提取物溶液质量浓度为100 g/L时处理的种子发芽率为0,20 g/L时显著抑制种子发芽。0.1~4 g/L质量浓度处理的种子发芽率与空白对照相比差异不显著。ɑ-萘乙酸溶液质量浓度0.001~0.01 g/L处理的种子第3d发芽率与空白对照相比无差异,0.1 g/L处理显著抑制种子萌发。由此看出,ɑ-萘乙酸溶液0.1 g/L时对种子发芽就有抑制作用,与ɑ-萘乙酸相比,只有较高质量浓度的银杏外种皮提取物溶液对萝卜种子发芽具有抑制作用。

表1 银杏外种皮提取物溶液对萝卜种子发芽率的影响
2.1.2 银杏外种皮提取物溶液对萝卜根、茎长的影响 结果见表2。从表2可知,空白对照组幼苗的根、茎最长。ɑ-萘乙酸溶液质量浓度0.001~0.01 g/L和银杏外种皮提取物溶质量浓度0.1~20 g/L显著抑制根生长。ɑ-萘乙酸质量浓度0.01 g/L和银杏外种皮溶液质量浓度0.1~4 g/L显著抑制茎生长。ɑ-萘乙酸质量浓度0.01 g/L和银杏外种皮溶液质量浓度0.1 g/L对茎长影响效果相当,差异不显著。
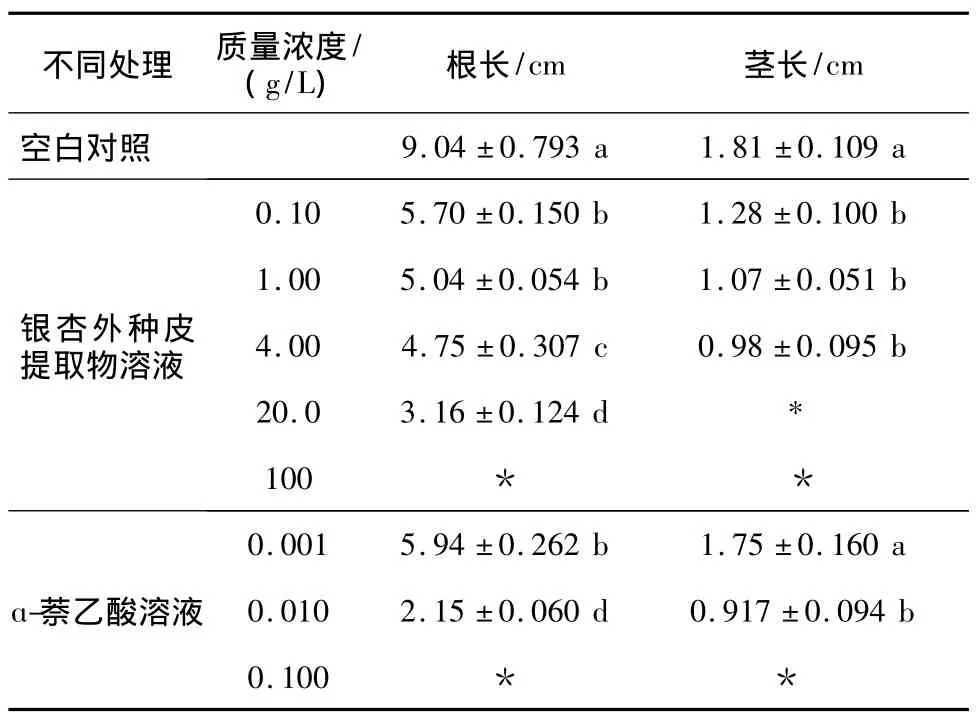
表2 银杏外种皮提取物溶液对萝卜根和茎长的影响
2.1.3 银杏外种皮提取物溶液对黄瓜发芽率和根长的影响 结果见表3。从表3可以看出,ɑ-萘乙酸质量浓度0.000 1~0.1 g/L时对种子的萌发具有显著抑制作用,0.002~1 g/L处理时种子没生根,0.000 1 g/L时显著抑制种子生根。银杏外种皮提取物溶液质量浓度0.02~5 g/L时显著抑制种子萌发,0.02~1 g/L时显著抑制根生长,5~25 g/L时没有生根。ɑ-萘乙酸质量浓度0.000 1 g/L和银杏外种皮质量浓度0.02 g/L时抑制黄瓜种子萌发和生根效果相当。
3 结论与讨论
萘乙酸(NAA)是一种生长素类植物生长调节剂,对植物具有两重性,既有促进发芽、生根、加速生长、提早成熟、增加产量等作用,又能抑制生长。对同一浓度的生长素,不同植物对其反应不相同,同一植物不同器官对其反应也不相同。诸多研究报道了萘乙酸对植物具有生长调节作用。宋朝玉等研究表明低质量浓度的α-萘乙酸浸种对黄瓜幼苗生长有促进作用,高质量浓度时则会严重抑制种子的萌发和幼苗的正常生长[13]。崔辉梅等发现萘乙酸对胡萝卜种子发芽势和发芽率都有抑制作用,并且质量浓度越大其抑制作用越强[14]。本文选用α-萘乙酸处理作为药剂对照,旨在探索银杏外种皮提取物溶液中的成分对植物生长是否也存在类似植物调节剂的作用、效应用量以及与实际生长调节剂相比效果有多大差别。

表3 银杏外种皮提取物溶液对黄瓜种子发芽率和根长的影响
通过本实验可以看出,一定质量浓度银杏外种皮提取成分对植物种子萌发、生长存在抑制作用。当质量浓度20~100 g/L时对萝卜种子萌发具有显著的抑制作用,质量浓度20 g/L时与ɑ-萘乙酸质量浓度0.001 g/L时处理效果相当;当0.1~100 g/L时对萝卜种子根、茎生长显著抑制,质量浓度0.1 g/L时与ɑ-萘乙酸质量浓度0.001 g/L时对根处理效果相当,质量浓度0.1 g/L时与ɑ-萘乙酸质量浓度0.01 g/L时对茎处理效果相当。当银杏外种皮提取物溶液浓度0.02~25 g/L时对黄瓜种子萌发、生根具有显著的抑制作用,质量浓度0.02 g/L时与ɑ-萘乙酸质量浓度0.000 1 g/L时处理效果相当。
目前,多个研究表明植物提取物中的黄酮类、酚酸类、生物碱类物质具有抑制植物生长的作用。赵晓萌等研究发现骆驼蓬提取物中生物碱类物质抑制了小麦、玉米种子的萌发和生长[15]。Tang等研究Bigalta Limpograss根系分泌物的化感作用时指出,根系分泌物中生长抑制剂主要是酚类化合物[16]。魏艳等从银杏外种皮中提取了黄酮类物质,认为黄酮类物质抑制了反枝苋种子生长[7]。植物活性物质对植物生长发育的影响主要是改变许多酶的合成及功能,改变代谢途径;改变植物细胞膜的通透性;抑制细胞分裂、伸长;影响呼吸作用;影响蛋白质合成和基因表达;改变植物体内激素水平等方面的作用[17]。植物生长过程是一个复杂的,多种物质共同作用的过程。任何一种作用的表达都是综合效应的表现,针对植物体某种特定的生理生化反应,到底是由一类特定的物质引起还是多种物质协同作用的结果,都需要结构化学方面的研究给出进一步的实验论证。本试验银杏外种皮提取物是含有多种成分的混合物,包括双黄酮类、萜内酯类、酚酸类等多种活性物质。银杏外种皮对植物种子萌发和生长发育抑制的生物活性物质具体是什么,目前尚不清楚,需要从粗提物中分离、提取,纯化活性成分,鉴定其化学结构,搞清其作用机理等。
[1]吴向阳,仰榴青,陈 钧,等.银杏外种皮综合利用的研究现状与发展[J].农业机械学报,2003,34(6):164-166.
[2]唐于平,楼凤昌.银杏外种皮的化学成分和药理作用[J].药学进展,2000(3):152-155.
[3]Hideji I,Nobuo T,Keisuke N,et al.Antitumor principles from Ginkgo biloba L.[J].Chemical Pharmaceutical Bulletin,1987,35(7):3016-3020.
[4]张洪泉,许丽丽,金以秀,等.银杏外种皮水溶性成分的抗过敏作用[J].中国中药志,1990,15(8):36-37.
[5]王 杰,祝树德,余碧钰,等.银杏外种皮提取物对菜青虫抑制生长与拒食活性的研究[J].扬州大学学报:农业与生命科学版,2002,23(1):72-75.
[6]徐立春,顾维戎,孙 云,等.银杏外种皮总提取物对真菌抑制效应的初步研究[J].中成药研究,1989(9):43.
[7]魏 艳,陈 茎,郝双红,等.银杏外种皮提取物除草作用初步研究[J].陕西农业科学,2008,54(1):53-55.
[8]郁万文,曹福亮.银杏外种皮汁液浸种对小麦萌发和幼苗生长的影响[J].林业科技开发,2011,25(5):75-77.
[9]张宗俭,李 斌.植物生长调节剂卷[M].北京:化学工业出版社,2011.
[10]赵东亚,唐进根,陈利红,等.银杏外种皮提取银杏酸工艺的优化试验[J].林业科技开发,2012,26(5):79-82.
[11]唐为萍,陈树思,陈丹生,等.萘乙酸对黄瓜根、芽生长的影响[J].长江蔬菜,2008(11):39-41.
[12]颜启传.种子检验的原理和技术[M].北京:北京农业出版社,1992:207.
[13]宋朝玉,孙兆法,张淑霞.α-萘乙酸浸种对黄瓜幼苗影响的初步研究[J].山东农业科学,2009(4):90-91.
[14]崔辉梅,樊新民,张永先.几种外源激素浸种对胡萝卜种子发芽的影响[J].中国种业,2006(11):31-32.
[15]赵晓萌,刘悦萍,曾召海.骆驼蓬提取物对小麦玉米种子萌发及幼苗生长的影响[J].中国农学通报,2005,21(6):94-96.
[16]Tang C S,Young C C.Collection and indentification of allelopathic compounds from the undisturbed root system of Bigalta limpograss(Hemarthria altissima)[J].Plant Physoiogy,1982(69):155-160.
[17]杨期和,叶万辉,廖富林,等.植物化感物质对种子萌发的影响[J].生态学杂志,2005,24(12):1459-1465.
