TGF-β1对诱导肾间质成纤维细胞活化并表达MMP-9及TIMP-1的影响
2014-10-09陈香美刘述文
周 瑾,陈香美,刘述文,傅 博,冯 哲,洪 权
解放军总医院 肾病中心暨国家重点实验室,北京 100853
TGF-β1对诱导肾间质成纤维细胞活化并表达MMP-9及TIMP-1的影响
周 瑾,陈香美,刘述文,傅 博,冯 哲,洪 权
解放军总医院 肾病中心暨国家重点实验室,北京 100853
目的研究转化生长因子-β1(transforming growth factor beta-1,TGF-β1)诱导的肾间质成纤维细胞(NRK-49F)发生表型转化时基质金属降解酶MMP-9及其抑制因子TIMP-1表达的变化及对分泌纤维连接蛋白(fibronectin,FN)的影响。方法以不同浓度hTGF-β1(0 ng/ml、0.5 ng/ml、1 ng/ml、2 ng/ml、5 ng/ml、10 ng/ml)刺激NRK-49F细胞48 h,分别应用ELISA法检测细胞上清FN的浓度,免疫荧光检测细胞表型标记物α-SMA、Vimentin的表达,Western blot、Northern blotting方法检测MMP-9、TIMP-1的基因及蛋白质表达。结果0.5 ~ 10 ng/ml TGF-β1随刺激浓度增高NRK-49F细胞表达α-SMA明显增多、Vimentin明显减少,细胞上清中FN的含量显著增加(P<0.05或P<0.01);同时,TGF-β1浓度>2 ng/ml时显著上调TIMP-1 mRNA及蛋白表达水平(P<0.05或P<0.01);以上效应均呈浓度依赖性,但对细胞MMP-9 mRNA及蛋白表达无明显影响(P>0.05)。结论TGF-β1能诱导肾间质成纤维细胞活化,使FN的分泌增多,该作用可能与TGF-β1上调了TIMP-1基因及蛋白质水平,进而减少细胞外基质(extracellular matrix,ECM)的降解有关。
转化生长因子-β1;肾间质成纤维细胞;表型转化α-平滑肌肌动蛋白;纤维连接蛋白;基质金属蛋白酶9;组织金属蛋白酶抑制剂1
肾中肌成纤维细胞(myofibroblast,MFB)的产生、积聚与肾间质纤维化的发生发展密切相关,是肾间质纤维化的重要机制之一,其主要源于肾间质成纤维细胞[1-3]。TGF-β1是目前公认最强的致纤维化因子,在损伤、炎症等情况下参与了肾间质成纤维细胞的活化及细胞外基质(extracellular matrix,ECM)的大量积聚过程,而ECM的降解与重建在体内受多种蛋白溶解酶及其抑制物的调节[4-6]。研究发现,TGF-β1对肾细胞外基质代谢酶基质金属蛋白酶(MMPs)及其抑制因子(TIMPs)的表达有调控作用,并与肾间质纤维化的程度密切相关[7-8]。但MMPs或TIMPs在肾间质成纤维细胞被激活后对细胞外基质过度积聚的影响目前研究较少。本文首先观察TGF-β1体外对大鼠肾间质成纤维细胞表型及分泌FN的影响,在此基础上进一步研究TGF-β1对肾间质成纤维细胞表达MMP-9及TIMP-1的影响,以期揭示TGF-β1体外促进ECM积聚的内在机制。
材料和方法
1 材料 正常大鼠肾间质成纤维细胞株NRK-49F(ATCC 公司 ),hTGF-β1(Promega公司 ),小鼠抗α-SMA(clone 1A4)(Sigma公司),小鼠抗-Vimenin单克隆抗体(clong V9)(北京中山生物技术公司),anti-mouse IgG-FITC抗 体、Fibronectin(ELISA)测定试剂盒(上海太阳生物技术公司),羊抗Actin(I-19)抗体、羊抗MMP-9、兔抗TIMP-1抗体(Santa Cruz公司 ),DMEM/F12 培养基 (GIBCO 公司 ),[α-32P]dCTP(北京亚辉生物医学工程公司),Antimouse IgG/HRP、ECL显色试剂(北京中山生物技术公司)。MCO-15AC型CO2培养箱(SANYO Electric Co.,Ltd.Japan),超净工作台(北京半导体设备一厂),Olympus K10型倒置荧光显微镜(Olympus Co.,Ltd.Japan),电泳槽、电泳仪、蛋白转膜仪、干胶机、Radiance-2000系统激光共聚焦显微镜(均为美国Bio-RAD公司),Model 2000杂交箱、杂交桶及紫外交联仪(均为Robbins scientific公司),AlphalmagerTM2200凝胶成像及分析系统(Pharmega公司 )。
2 细胞培养及分组 NRK-49F细胞株用含10%胎牛血清(fetal bovine serum,FBS)DMEM/F12培养基培养在6孔板(预铺有盖玻片)或75 cm2的培养瓶中,细胞融合达60% ~ 70%,换含1% FBS的DMEM/F12同步24 h后分6组给予刺激:TGF-β1按照 0 ng/ml、0.5 ng/ml、1 ng/ml、2 ng/ml、5 ng/ml、10 ng/ml 6个不同浓度组分别加入无血清培养基中,其中0 ng/ml组以20 mmol/L PBS(pH6.8)代替,37℃,5% CO2培养48 h后中止,收获细胞进行检测。
3 α-SMA、Vimentin免疫荧光染色 按文献[9]方法进行间接免疫荧光染色:接种在6孔板中的细胞用预冷的PBS洗2次,立即用甲醇:丙酮(1∶1)-20℃固定,PBS洗3次,用含0.2% TritonX-100和1.5%BSA/PBS在4℃透化5 min,用含1.5% BSA/PBS洗3次,加入小鼠抗α-SMA、抗Vimentin单抗(均1∶50稀释),37℃湿盒中孵育1 ~ 2 h,用1.5% BSA/PBS洗3次,加入抗Mouse-IgG-FITC(1∶200稀释),37℃湿盒中避光孵育1 h,再用含1.5% BSA/PBS洗3次,RNAase(100 μg/ml)37℃湿盒中避光20 min,PBS洗 3次,50 μg/ml PI染核 2 min,PBS洗 弃,激光共聚焦显微镜下观察、扫描,胞质呈丝状绿色荧光为阳性表达,并用LaserPix 4.0图像分析软件定量分析单位细胞质的平均荧光强度,用平均灰度值表示(A),反映NRK-49F细胞阳性表达的强度。
4 ELISA法测定细胞上清FN含量 收集细胞上清液,离心取上清,以间接竞争抑制ELISA法测定FN含量(按试剂盒说明操作),每组设6个复孔。
5 Western blot检测MMP-9、TIMP-1的蛋白表达细胞接种在75 cm2培养瓶中,刺激结束时用1×RIPA裂解缓冲液(0.05 mol/L Tris pH7.4,0.15 mol/L NaCl,1% NP-40,1 mmol/L EDTA) 及 100 μg/ml PMSF,2 μg/ml Pepstatin A,2 μg/ml Leupeptin 提取细胞总蛋白,BCA蛋白试剂盒测定蛋白浓度。用等体积的2×SDS凝胶加样缓冲液100℃变性蛋白,进行12% SDS-PAGE电泳,采用电转印方法将蛋白从聚丙烯酰胺凝胶转移至硝酸纤维素膜上,室温封闭1 h,加羊抗MMP-9抗体、兔抗TIMP-1抗体(分别为1∶100、1∶100、1∶200稀释)4℃过夜,充分洗膜后,加HP标记的二抗(1∶1 000稀释)室温45 min,洗膜后用ECL系统显色,显影胶片扫描并用AlphalmagerTM2200图像分析系统进行灰度分析。
6 Northern blotting检 测 MMP-9、TIMP-1 mRNA的表达 细胞接种在75 cm2培养瓶中,培养终止时用0.1% DEPC/PBS洗细胞2次,采用Trizol试剂(Gibco公司)一步法提取细胞总RNA,20 μg总RNA在1%琼脂糖凝胶中电泳后,转移至尼龙膜,用[α-32P]dCTP标记的cDNA探针42℃杂交过夜,洗膜,放射自显影,显影胶片扫描并用AlphalmagerTM2200图像分析系统进行灰度分析。以28sRNA为参照校正取样量。MMP-9、TIMP-1的cDNA探针为Glassmilk纯化的RT-PCR反应产物,其中各引物序列、产物片段及PCR扩增退火温度见表1。
结 果
1 不同浓度TGF-β1对细胞Vimentin、α-SMA免疫荧光表达的影响 激光共聚焦显微镜下观察,正常NRK-49F细胞α-SMA的表达基本呈阴性,而Vimentin的表达呈强阳性,0.5 ng/ml TGF-β1刺激48 h后,细胞质中Vimentin的荧光强度下降并随着TGF-β1刺激浓度的升高,Vimentin表达下降显著,在10 ng/ml浓度时Vimentin的表达几乎全部消失。同时,0.5 ng/ml TGF-β1刺激NRK-49F细胞48 h时细胞质中可见绿色荧光呈丝状,为α-SMA的阳性表达,并随着TGF-β1刺激浓度逐渐升高,细胞质中出现大量纤维丝状甚至集结成束状的α-SMA,荧光强度也逐渐增强。0.5 ng/ml以上TGF-β1刺激各组细胞Vimentin表达与0 ng/ml组比较差异均有统计学意义(P<0.05或P<0.01)。图1、图2及表2。

表1 PCR引物序列、产物片段及退火温度Tab. 1 PCR primers, product sizes, and annealing temperatures
表2 不同浓度TGF-β1刺激48 h NRK-49F表达Vimentin、α-SMA的平均荧光强度Tab. 2 Vimentin, α-SMA average fl uorescence intensity in NRK-49F after TGF-β1 stimulus ()

表2 不同浓度TGF-β1刺激48 h NRK-49F表达Vimentin、α-SMA的平均荧光强度Tab. 2 Vimentin, α-SMA average fl uorescence intensity in NRK-49F after TGF-β1 stimulus ()
aP<0.05, bP<0.01, vs control group (0 ng/ml)
0.5 1 2 5 10 Vimentin 107.0±23.38 62.48±5.94a 39.70±7.91b 30.55±2.6b 26.56±3.38b 16.37±3.28b α-SMA 9.40±4.62 13.96±2.67a 21.67±2.67b 40.05±5.67b 71.67±4.12b 109.3±29.67b TGF-β1(ng/ml)0
2 细胞上清FN浓度 在>1 ng/ml浓度TGF-β1刺激下,NRK-49F细胞上清FN的浓度显著升高(P均<0.01)。并且,细胞上清FN的含量与TGF-β1的刺激浓度呈正相关(R=0.966,P<0.01)。见表3。
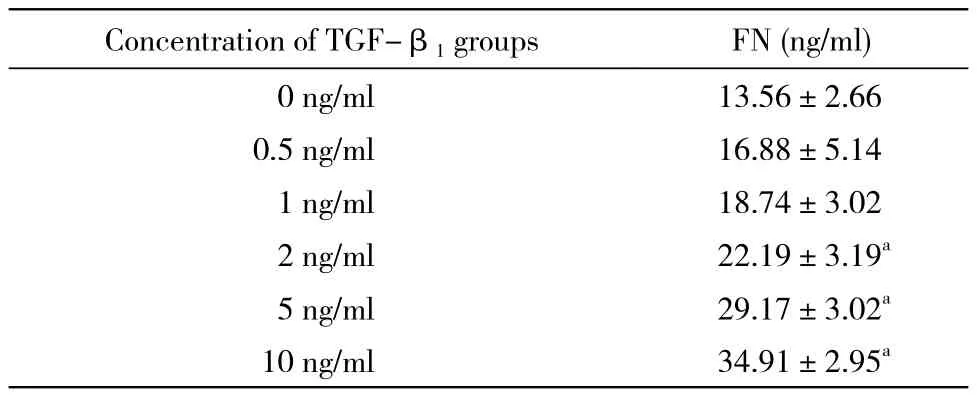
表3 不同浓度TGF-β1刺激NRK-49F细胞上清FN含量Tab. 3 Concentration of FN in supernatant after TGF-β1 stimulus
3 不同浓度TGF-β1对细胞MMP-9表达的影响应用Western blot方法,检测TGF-β1刺激48 h各组细胞MMP-9蛋白表达水平,正常NRK-49F细胞有基础的MMP-9表达,加入<2 ng/ml浓度TGF-β1刺激后,细胞MMP-9蛋白表达无明显改变。以>5 ng/ml浓度刺激时,MMP-9表达有下降的趋势,但各组间比较差异无统计学意义(P>0.05)。见图3。Northern blotting检测各组细胞MMP-9 mRNA的表达,正常细胞有基础的MMP-9表达,当0.5 ng/ml、1 ng/ml、2 ng/ml TGF-β1刺激后,其表达有所升高,但>5 ng/ml刺激浓度组,MMP-9表达逐渐减少,10 ng/ml时最低(较0 ng/ml组约下降10%),但各组之间差异也无统计学意义(P>0.05)。见图4。
4 不同浓度TGF-β1对细胞TIMP-1表达的影响Western blot检测TGF-β1刺激48 h各组细胞TIMP-1的蛋白表达,NRK-49F细胞TIMP-1蛋白表达量呈浓度相关性(R=0.9673,P<0.05)。浓度>2 ng/ml的刺激剂量,其表达量分别是0 ng/ml组的1.33、1.5、1.79倍(P<0.05或P<0.01)。见图5。Northern blotting检测各组细胞TIMP-1 mRNA表达,正常细胞有一定的TIMP-1 mRNA的表达,随着TGF-β1刺激浓度的增加,TIMP-1 mRNA的表达逐渐增多,在2 ng/ml、5 ng/ml、10 ng/ml 3种浓度刺激下,其表达分别与0 ng/ml组比较差异有统计学意义(P<0.05),10 ng/ml较0 ng/ml组差异有统计学意义(P<0.01)。见图6。
讨 论
肾间质纤维化是终末期肾功能衰竭的共同病理表现,其主要特征是间质成纤维细胞的异常增殖和细胞外基质的过度积聚[9]。FBS是肾间质的固有细胞,生理状态下数量较少,约占肾组织细胞总数的12%,而在纤维化状态下比例可增加到30%甚至达60%[10-11]。成纤维细胞持续激活转化为肌成纤维细胞是导致肾间质纤维化重要环节[12]。有文献报道,激活的MFB可以产生永久的促增殖活性和促ECM的合成能力,因此,MFB数量的多少与间质纤维化轻重程度密切相关[13-14]。MFB形态上是一类同时具有平滑肌和成纤维细胞特性的细胞,具有强于FBS数倍的增殖能力和合成ECM如胶原、糖蛋白和蛋白多糖等的能力,在病理状态下,是产生细胞外基质的主要来源细胞,分化增殖后的成纤维细胞首先分泌出纤维连接蛋白,为其他ECM的形成提供一个支架。
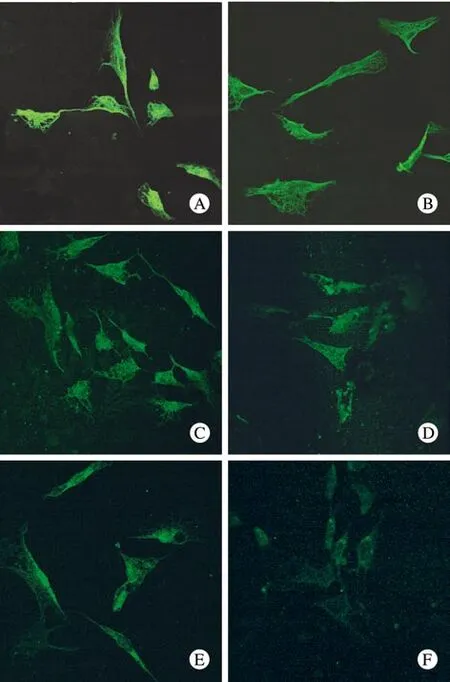
图 1 不同浓度TGF-β1对NRK-49F表达Vimentin的影响(×600)Fig. 1 Vimentin fluorescence stained in NRK-49F after TGF-β1 stimulus(×600)
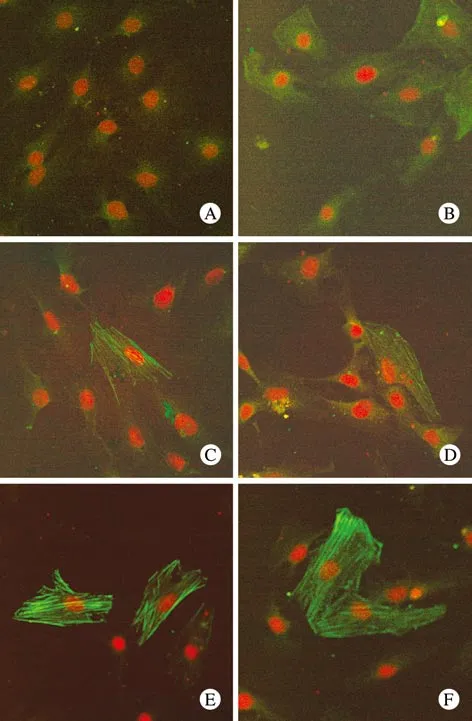
图 2 不同浓度TGF-β1对NRK-49F表达α-SMA的影响(×600)Fig. 2 α-SMA fluorescence stained in NRK-49F after TGF-β1 stimulus(×600)

图 3 不同浓度TGF-β1刺激49F细胞表达MMP-9蛋白印迹结果A为MMP-9的Western blot结果;B为MMP-9蛋白表达的相对水平(MMP-9/β-actin的吸光度比值)Fig. 3 Expressions of MMP-1 after TGF-β1 stimulus A: Westernblot showing MMP-9 B: MMP-9/β-actina:0 ng/ml group; b:0.5 ng/ml group; c:1 ng/ml group;d:2 ng/ml group; e:5 ng/ml group; f:10 ng/ml group
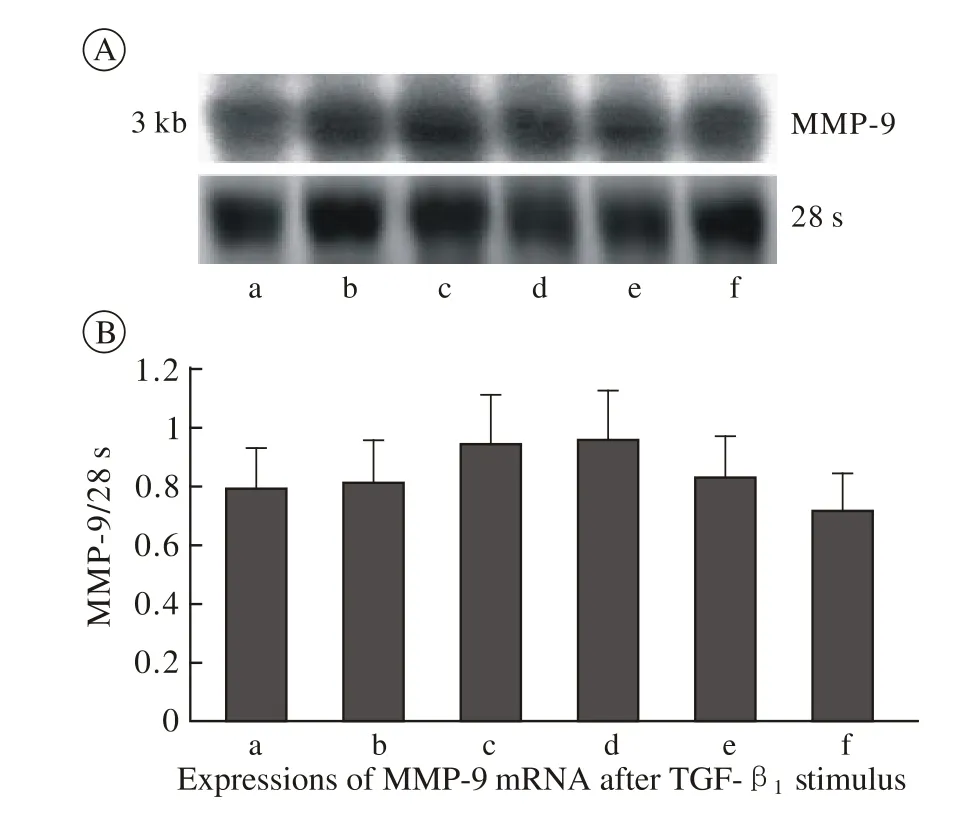
图 4 不同浓度TGF-β1刺激49F细胞表达MMP-9mRNA的结果A为MMP-9的Northern blotting;B为MMP-9表达的相对灰度值(MMP-9/28s吸光度比值)Fig. 4 Expressions of MMP-9 mRNA after TGF-β1 stimulusA: Northern blot showing MMP-9 B: MMP-9/28sa:0 ng/ml group; b:0.5 ng/ml group; c:1 ng/ml group;d:2 ng/ml group; e:5 ng/ml group; f:10 ng/ml group
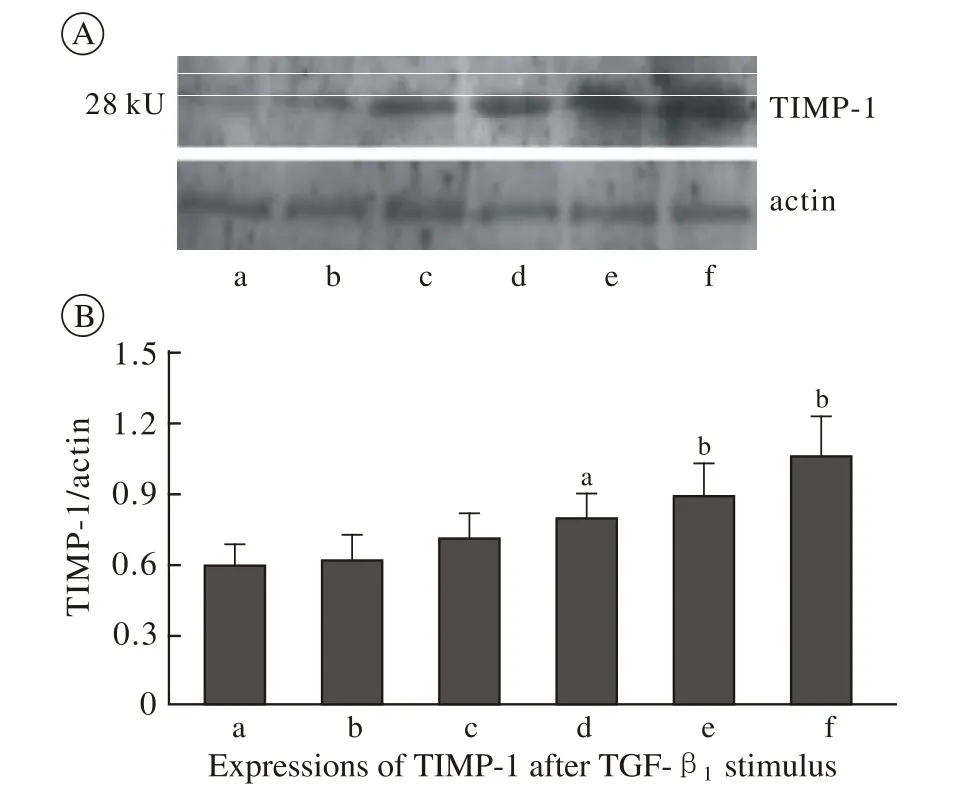
图 5 不同浓度TGF-β1刺激49F细胞表达TIMP-1蛋白印迹结果A为TIMP-1的Western blot;B为TIMP-1蛋白表达的相对灰度值(TIMP-1/β-actin吸光度比值)Fig. 5 Expressions of TIMP-1 after TGF-β1 stimulus A: Western blot showing TIMP-1; B: TIMP-1/β-actin a:0 ng/ml group;b:0.5 ng/ml group;c:1 ng/ml group;d:2 ng/ml group;e:5 ng/ml group;f:10 ng/ml group

图 6 不同浓度TGF-β1刺激49F细胞表达TIMP-1 mRNA的结果A为TIMP-1的Northern blotting;B为TIMP-1表达的相对灰度值(TIMP-1/28s吸光度比值)Fig. 6 Expressions of TIMP-1 mRNA after TGF-β1 stimulusA: Northern blot showing TIMP-1; B: TIMP-1/28sa:0 ng/ml group;b:0.5 ng/ml group;c:1 ng/ml group;d:2 ng/ml group;e:5 ng/ml group;f:10 ng/ml group
与Yang等[15]报道一致,本实验发现,对体外培养的大鼠肾间质成纤维细胞给予不同浓度的TGF-β1刺激,随着TGF-β1刺激浓度的逐渐升高(0.5 ~ 10 ng/ml),成纤维细胞原表型标记物Vimentin表达迅速下降,在10 ng/ml浓度时Vimentin的表达几乎全部消失;而与之相反,肌成纤维细胞表型标志α-SMA表达逐渐增多。实验证实了TGF-β1体外确能诱导大鼠肾间质成纤维细胞激活发生表型转化,其被激活的程度依赖TGF-β1的刺激浓度。同时,与细胞表达α-SMA的水平上调同步,随着TGF-β1刺激浓度的增高,细胞分泌FN逐渐增多,与刺激浓度呈正相关。说明TGF-β1刺激肾间质成纤维细胞的激活后,随着转变为肌成纤维细胞的增多,其合成、分泌细胞外基质也增加。
已知调控细胞外基质代谢的酶类MMPs/TIMPs系统对ECM的降解起着极为重要的作用[16]。其中明胶酶B主要由成纤维细胞、单核-巨嗜细胞等产生,在体内外能降解包括纤维连接蛋白、胶原、明胶在内的多种ECM蛋白成分。MMP-9的降解潜能受内源性特异性TIMP-1的抑制。目前发现TGF-β1能调控MMPs及TIMPs的基因表达,从而调节ECM的降解与重建[4]。但TGF-β1对不同的细胞MMPs及TIMPs的调控效应不同:如在人表皮成纤维细胞中加入TGF-β1刺激MMP-9的表达,对人羊膜细胞则抑制MMP-9、促进TIMP-1的表达,但目前对肾间质成纤维细胞的影响研究较少[17-18]。
本实验结果表明,TGF-β1在体外显著上调TIMP-1的基因转录水平及蛋白质的合成,而对MMP-9表达的影响并不明显。虽然Martin等[19]发现TGF-β1体外同时上调了人肾小球上皮细胞的MMP-2、MMP-9和TIMP-1的表达,但MMP-9/TIMP-1的比值降低与本实验结果一致。我们分析认为,细胞外基质FN的增多可能与TGF-β1激活间质成纤维细胞并显著上调了TIMP-1的表达,导致FN降解减少有关。
1 Meran S, Steadman R. Fibroblasts and myofibroblasts in renal fibrosis[J]. Int J Exp Pathol, 2011,92(3):158-167.
2 Boor P, Floege J. The renal (myo-)fibroblast: a heterogeneous group of cells[J]. Nephrol Dial Transplant, 2012,27(8):3027-3236.
3 LeBleu VS, Taduri G, O’Connell J, et al. Origin and function of myofibroblasts in kidney fibrosis[J]. Nat Med, 2013,19(8):1047-1053.
4 López-Hernández FJ, López-Novoa JM. Role of TGF-β in chronic kidney disease : an integration of tubular, glomerular and vascular effects[J]. Cell Tissue Res, 2012,347(1):141-154.
5 Grande MT, López-Novoa JM. Fibroblast activation and myofibroblast Generation in obstructive nephropathy[J]. Nat Rev Nephrol, 2009, 5(6): 319-328.
6 Grupp C, Troche I, Klass C, et al. A novel model to study renal myofibroblast formation in vitro[J]. Kidney Int, 2001,59(2):543-553.
7 Eddy AA. Molecular basis of renal fibrosis[J]. Pediatr Nephrol,2000, 15(3/4): 290-301.
8 薛痕,陈亮,樊均明,等.MMP-9与TIMP-1在肾小管上皮细胞转分化中的作用[J].四川大学学报:医学版,2008,39(1):34-38.
9 Farris AB, Colvin RB. Renal interstitial fibrosis: mechanisms and evaluation[J]. Curr Opin Nephrol Hypertens, 2012,21(3):289-300.
10 Grimm PC, Nickerson P, Jeffery J, et al. Neointimal and tubulointerstitial infiltration by recipient mesenchymal cells in chronic renal-allograft rejection[J]. N Engl J Med, 2001, 345(2): 93-97.
11 于国华.曹灵,孙兴旺.肾间质纤维化中成纤维细胞增殖调控的研究进展[J].沪州医学院学报,2005,28(5):462-464.
12 Liu Y. Cellular and molecular mechanisms of renal fibrosis[J]. Nat Rev Nephrol, 2011,7(12):684-696.
13 Bechtel W, Mcgoohan S, Zeisberg EM, et al. Methylation determines fibroblast activation and fibrogenesis in the kidney[J]. Nat Med,2010, 16(5): 544-550.
14 Boukhalfa G, Desmoulière A, Rondeau E, et al. Relationship between alpha-smooth muscle actin expression and fibrotic changes in human kidney[J]. Exp Nephrol, 1997, 4(4): 241-247.
15 Yang J, Dai C, Liu Y. Hepatocyte growth factor suppresses renal interstitial myofibroblast activation and intercepts Smad signal transduction[J]. Am J Pathol, 2003, 163(2): 621-632.
16 Reynolds JJ. Collagenases and tissue inhibitors of metalloproteinases:a functional balance in tissue degradation[J]. Oral Dis, 1996,2(1):70-76.
17 Han YP, Tuan TL, Hughes M, et al. Transforming growth factorbeta - and tumor necrosis factor-alpha -mediated induction and proteolytic activation of MMP-9 in human skin[J]. J Biol Chem,2001,276(25):22341-22350.
18 范明松,姜子燕,邹明芬,等. 转化生长因子β1 对羊膜细胞中基质金属蛋白酶9及其组织抑制物1表达的影响[J]. 中华妇产科杂志, 2013, 48(1): 29-33.
19 Martin J, Steadman R, Knowlden J, et al. Differential regulation of matrix metalloproteinases and their inhibitors in human glomerular epithelial cells in vitro[J]. J Am Soc Nephrol, 1998, 9(9):1629-1637.
Effects of TGF-β1activating renal interstitial fibroblast cells on MMP-9 and TIMP-1 expression
ZHOU Jin , CHEN Xiang-mei, LIU Shu-wen, FU Bo, FENG Zhe, HONG Quan
Department of Nephrology, Kidney Institute of Chinese PLA General Hospital, State Key Laboratory of Kidney Disease, Beijing 100853, China
The fi rst author: ZHOU Jin. Email: wangy631@126.com
Objective To study the changes on MMP-9 and TMP-1 expression when renal interstitial fibroblast cells (NRK-49F)occurred phenotypic transform induced by transforming growth factor beta-1 (TGF-β1), and its effects on the secretion of fibronectin(FN).MethodsRenal interstitial fi broblast cells (NRK-49F) of rats were stimulated by hTGF-β1at different concentrations of 0 ng/ml,0.5 ng/ml, 1 ng/ml, 2 ng/ml, 5ng/ml, 10 ng/ml. Immune fl uorescence was used to measure the expression of cell phenotype sign α-SMA and Vimentin, and ELISA was used to detect the concentration of FN in supernatant, while Western Blot and Northern Blotting technique was used to measure the expression of MMP-9 and TIMP-1. Results TGF-β1at the concentration of 0.5 ng/ml -10 ng/ml induced the expression of α-SMA which represented myo fi broblast appearance, with increasing concentration of TGF-β1, the expression of α-SMA gradually increased and Vimentin decreased signi fi cantly, furthermore FN secretion were driven up greatly (P<0.05 or P<0.01), while TGF-β1 at the concentration of 2 ng/ml markly drove up the expression of TIMP-1 mRNA and protein(P<0.05 or P<0.01) , those effects showed concentration-dependent form. However, TGF-β1at above concentration had no remarkable effect on MMP-9 mRNA and protein expression (P> 0.05). Conclusion TGF-β1can induce renal interstitial fi broblast activation to be myo fi broblast, and promote fi bronectin secretion, whose effects may be related to up-regulation of TIMP-1 expression so as to restrain ECM decompounded.
TGF-β1; renal interstitional fi broblast; phenotype-differentiation α-smooth muscle actin; fi bronectin; MMP-9; TIMP-1
R 34
A
2095-5227(2014)05-0449-06
10.3969/j.issn.2095-5227.2014.05.015
时间:2014-03-20 09:16
http://www.cnki.net/kcms/detail/11.3275.R.20140320.0916.004.html
2014-02-10
国家自然科学基金项目(30130220;30873345)
Supported by the National Natural Science Foundation of China(30930092;30873345)
周瑾,女,博士,出站博士后,副主任医师。研究方向:肾脏病的中西医结合临床及基础研究。Email: wangy631@126.com
