回流法制备MnFe2O4纳米晶及磁性能
2014-10-09钟诚,李波,赖欣*,毕剑
钟 诚, 李 波, 赖 欣*, 毕 剑
(1.达州职业技术学院,四川达州635001; 2.四川师范大学化学与材料科学学院,四川成都610066)
尖晶石型MFe2O4(M=Mn,Co,Ni,Cu,Zn等)具有优异的磁、光、电和催化性能,可广泛应用于磁共振成像(MRI)[1-3]、磁流体技术[4]、生物医药载体[5]、环境治理[6]和高密度磁记录[7]等诸多领域,是一类重要的磁性功能材料.MnFe2O4具有高磁导率和高电阻,其相关研究引起了广泛的关注[8-10].目前,有关MnFe2O4纳米粒子的制备,常采用氧化物直接合成法[11]、水热法、微乳液法、溶胶-凝胶法等方法,尽管这些制备方法能够获得MnFe2O4纳米晶,但是这些方法存在能耗大、效率低、过程复杂、晶粒分布不均等缺点.最近,一种借鉴有机物的制备和提纯的回流法发展起来,用于制备氧化物纳米材料[12-14].与上述制备方法相比,该方法具有工艺简单、原料便宜、反应温度较低、反应时间较短、无需高温煅烧,合成的氧化物纳米晶粒径小、活性高等优点.此外,回流法能耗低,容易实现工业化生产,是一种具有很好应用前景的制备纳米晶的工艺.本文通过低温回流法制备了MnFe2O4纳米晶,重点讨论了反应温度对MnFe2O4纳米晶的晶粒大小、晶相结构和磁性能的影响.与文献报道的其他方法制备的Mn-Fe2O4纳米晶相比,该工艺所获得的MnFe2O4纳米晶形貌和尺寸可控,磁学性能优异.
1 实验
1.1 样品的制备实验原料为MnSO4·H2O(分析纯99%)、FeSO4·7H2O(分析纯 99%)和 NaOH(分析纯96%),实验的详细工艺流程如图1所示.将2 mmol的MnSO4·H2O和4 mmol的FeSO4·7H2O溶于100 mL的蒸馏水中并搅拌均匀,加入2 mol/L的NaOH调节pH=11;在搅拌10 min后,转入250 mL的圆底烧瓶,在保持搅拌速率不变的条件下,分别在50~90℃下回流反应2 h后,使其溶液自然冷却到室温并离心收集,然后分别用蒸馏水和乙醇清洗几次直到SO2-4完全去除(用Ba2+离子检测),最后在60℃下干燥12 h即得到MnFe2O4纳米晶.

1.2 样品的表征样品的物相用XRD(XD-2,北京)衍射仪确定,选用 CuKα射线(λ=0.154 06 nm),扫描速度为4(°)/min,扫描范围为20°~70°;样品的形貌、大小和微观结构用SEM(JSM-5900,Japan)和FESEM(INSPECTF)确定;样品的红外光谱图由NEXUS670FT-IR红外光谱仪得到;样品的磁性质用BHV-525型振动样品磁强计(VSM)测定,应用磁场范围为±6 kOe.
2 结果与讨论
2.1 XRD、SEM、FESEM分析图2表示不同回流温度下所制备的MnFe2O4纳米晶的XRD图谱.由图2可知,所有样品各XRD衍射峰的位置和相对强度与MnFe2O4的标准衍射图谱(JCPS为73-1964)非常吻合,表明在所有选定的回流温度下都获得了纯尖晶石相的MnFe2O4纳米晶.随着回流温度的升高,所得MnFe2O4样品的XRD衍射峰变尖锐且强度逐渐增加,表明其结晶性不断提高.XRD测试结果表明在50℃回流反应就可得到纯尖晶石相的 MnFe2O4纳米晶,回流反应温度越高,Mn-Fe2O4纳米晶生长速度越快,尤其是回流温度超过70℃后更明显.所有MnFe2O4样品的X射线衍射峰显著地宽化则表明所得MnFe2O4为纳米粒子.由XRD图谱中最强峰(311)的半高宽,利用谢乐公式[14]可得

式中,λ为X射线的波长,θ为布拉格峰衍射角,B为半高宽.计算的晶粒平均粒径大小列于表1.
由表1可知,随着回流温度升高,样品的平均粒径尺寸从10.4 nm增大到了22.1 nm.通过最小二乘法估算的层间距,晶格常数很接近文献报道值0.851 5 nm(JCPS为73-1964).晶格常数随温度的升高而增大,可能的原因是纳米晶表面张力因晶粒尺寸的增大而减小所引起的.
图3为不同温度条件下所制备的MnFe2O4纳米晶的SEM和FESEM图.可以看出,样品基本上是球形颗粒的纳米晶,存在部分团聚.样品存在部分团聚的可能原因是为了减小纳米颗粒高表面积所带来的高表面能,通过颗粒间范德华力和偶极子的相互作用而发生团聚.
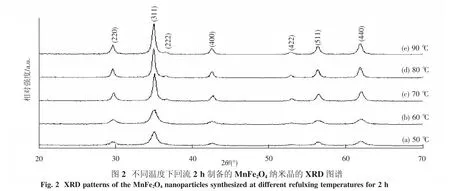

表1 MnFe2O4纳米晶尺寸与磁性能受回流温度的影响Table 1 The influence of reaction temperature on the crystallite size and magnetic properties of the MnFe2O4nanocrystals

根据Coble's理论[15-16],可根据以下Arrhenius方程计算晶体生长的活化能

式中,R为理想气体常数,Q为活化能,k为反应速率常数,T为绝对温度.Bolen等发现了颗粒尺寸与反应速率常数有直接关系,并积分方程(2)得
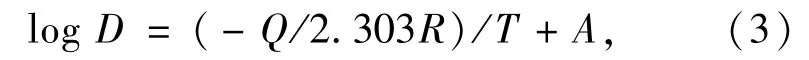
式中,D为颗粒尺寸,A为一常数.
根据方程(3),以1/T和logD分别为横纵坐标绘图,将获得斜率为-Q/2.303R的直线.依据该直线的斜率,可以推算出颗粒生长反应的活化能.图4为回流法获得的MnFe2O4纳米晶的颗粒尺寸对数logD与回流反应温度的倒数1/T的关系图.据此计算MnFe2O4纳米晶颗粒生长反应的活化能为21.89 kJ/mol.可见回流法制备MnFe2O4只需要相对较低能量、较低反应温度即可获得单相的MnFe2O4纳米晶.
2.2 红外分析图5为90℃回流温度下所制备的MnFe2O4纳米晶的红外谱图.由图5可见,在400~800 cm-1区间出现了2个谱带v1和v2,v1谱带的波数为616 cm-1,v2谱带劈裂为双峰,波数分别为446和416 cm-1.红外光谱中吸收峰劈裂的原因,可以认为是由于纳米晶体的准零级范畴,以及表面上“不完整分子”的低配位的原子比例增多,缺陷离子数增加,纳米晶对称性降低,导致谱带宽化乃至多重劈裂[17],这也正是超细粒子的小尺寸效应和表面与界面效应的体现.红外分析结果进一步证实了所获得的MnFe2O4纳米晶为尖晶石单相结构.

2.3 磁性分析为了探究回流反应温度对制备的MnFe2O4纳米晶磁性能的影响,分别对50、70和90℃条件下所制备的MnFe2O4纳米晶进行了VSM表征分析,所得结果如图6所示.

图6表明,在矫顽场为50~90 Oe区间,Mn-Fe2O4纳米晶表现出铁磁性行为.图7表示了饱和磁化强度、剩磁和矫顽力与回流温度的关系.如图7所示,随着回流温度的降低,所得MnFe2O4纳米晶的饱和磁化强度相应减小,其中90℃回流得到的MnFe2O4纳米晶的Ms为50.64 emu/g,而50℃回流得到MnFe2O4纳米晶的Ms仅为35.67 emu/g,远小于理论值80 emu/g[18].此外,MnFe2O4纳米晶的Hc随着回流温度的升高而增大,而Mr基本不变.材料磁性受颗粒结构、形貌、尺寸等一系列因素的影响,如图8所示.矫顽力和饱和磁化强度随回流温度的降低而变小,可归因于颗粒尺寸减小.其可能原因是MnFe2O4纳米晶颗粒的尺寸极小,表面张力与表面能较高,这会引起尖晶石晶格中阳离子的择位变化并致使反位缺陷程度升高,导致MnFe2O4纳米晶的磁性变小[19-21].不同回流温度条件下获得的MnFe2O4纳米晶的饱和磁化强度、剩磁比和矫顽力数据列于表1中.
3 结论
采用回流法在较低温度(50~90℃)条件下制备了MnFe2O4纳米晶.回流反应温度对MnFe2O4纳米晶的颗粒大小、晶相结构和磁性能有显著的影响.随着回流温度的升高,MnFe2O4纳米晶颗粒尺寸增大、结晶性增强,饱和磁化强度和矫顽力相应增大.根据回流温度推算出MnFe2O4纳米晶生长反应的活化能仅为21.89 kJ/mol.
[1]Tang Z X,Sorensen C M,Klabunde K J,et al.Size-dependent Curie temperature in nanoscale MnFe2O4particles[J].Phys Rev Lett,1992,67(25):3602-3605.
[2]Kulkarni G U,Kannan K R,Arunarkavalli T,et al.Particle-size effects on the value of Tc of MnFe2O4:evidence for finitesize scaling[J].Phys Rev,1994,B49(1):724-727.
[3]Gillot B,Laarj M,Kacim S.Reactivity towards oxygen and cation distribution of manganese ironspinel Mn3-xFexO4(0≤x≤3)fine powders studied by thermogravimetry and IR spectroscopy[J].J Mater Chem,1997,7:827-831.
[4]Anton I,de Sabata I,Vékás L.Application orientated researches on magnetic fluids[J].J Magn Magn Mater,1990,85(1/2/3):219-226.
[5]Gupta A K,Gupta M.Cytotoxicity suppression and cellular uptake enhancement of surface modified magnetic nanoparticles[J].Biomaterials,2005,26(13):1565-1573.
[6]Liu C W,Lin C H,Fu Y P.Characterization of Mn-Zn ferrite prepared by a hydrothermal process from used dry batteries and waste steel pickling liquor[J].J Am Ceram Soc,2007,90(10):3349-3352.
[7]Teng X W,Yang H.Effects of surfactants and synthetic conditions on the sizes and self-assembly of monodisperse iron oxide nanoparticles[J].J Mate Chem,2004,14(4):774-779.
[8]Masala O,Seshadri R.Magnetic properties of capped,soluble MnFe2O4nanoparticles[J].Chem Phys Lett,2005,402(1/2/3):160-164.
[9]Popa M,Bruna P,Crespo D,et al.Single-phase MnFe2O4powders obtained by the polymerized complex method[J].J Am Ceram Soc,2008,91(8):2488-2494.
[10]Wang Y Q,Cheng R M,Wen Z,et al.Synthesis and characterization of single-crystalline MnFe2O4ferrite nanocrystals and their possible application in water treatment Europe[J].J Inorg Chem,2011,2011(19):2942-2947.
[11]Nasr-Allah M D,El-shobaky G A.Solid-solid interaction between ferric oxide and manganese carbonate as influenced by lithium oxide doping[J].Thermochimica Acta,2001,375(1/2):137-145.
[12]Zhang J W,Wang W,Zhu P,et al.Synthesis of small diameter ZnO nanorods via refluxing route in alcohol-water mixing solution containing zinc salt and urea[J].Mater Lett,2007,61(2):592-594.
[13]Jiang J,Yang Y M,Li L C.Surfactant-assisted synthesis of nanostructured NiFe2O4via a refluxing route[J].Mater Lett,2008,62(12/13):1973-1975.
[14]Giri J,Sriharsha T,Bahadur D.Optimization of parameters for the synthesis of nano-sized Co1-xZnxFe2O4(0≤x≤0.8)by microwave refluxing[J].J Mater Chem,2004,14:875-880.
[15]Jiang H G,Rühle M,Lavernia E J.On the applicability of the X-ray diffraction line profile analysis in extracting grain size and microstrain in nanocrystalline materials[J].J Mater Res,1999,14(2):549-559.
[16]Coble R L.Sintering crystalline solids:intermediate and final state diffusion models[J].J Appl Phys,1961,32(5):787.
[17]杨桦,宋利珠,裘晓辉,等.ZnFe2O4纳米晶的性能[J].材料研究学报,1994,8(3):242-244.
[18]Zheng M,Wu X C,Zou B S,et al.Magnetic properties of nanosized MnFe2O4particles[J].J Magn Magn Mater,1998,183:152.
[19]Jarcho M,Bolen C H.Hydroxyapatite synthesis and characterization in dense polycrystalline form[J].Mater Sci,1976,11(2):227-235.
[20]Calvin S,Carpenter E E,Ravel B,et al.Multiedge refinement of extended X-ray absorption fine structure of manganese zinc ferrite nanoparticles[J].Phys Rev,2002,B66:224405.
[21]Fatemi D J,Harris V G,Browning V M,et al.Processing and cation redistribution of MnZn ferrites via high-energy ball milling[J].J Appl Phys,1998,83:6867.
