多系统萎缩68例临床特征分析
2014-10-09张博爱
程 锋,张博爱
(郑州大学第一附属医院神经内科 河南郑州 450052)
多系统萎缩(multiple system atrophy,MSA)是一组病因不详,成年期发病,进行性的多个系统受累的神经变性疾病,临床表型主要有自主神经功能障碍、帕金森综合征、小脑性共济失调和锥体系统功能障碍等。MSA目前诊断主要分为两个亚型:以帕金森综合征为突出表现称为MSA-P亚型及以小脑性共济失调为突出表现称为MSA-C亚型。而自主神经功能障碍在各亚型均有表现。鉴于该病临床症状较复杂,现对郑州大学第一附属医院神经内科收治的68例拟诊MSA患者的临床特点进行回顾性分析,并结合文献复习,提高对该病临床诊断的认识。
1 对象和方法
1.1 对象 收集郑州大学第一附属医院神经内科2010年1月至2013年6月收治的68例患者,发病年龄为45~70岁,平均年龄(58.3±8.5)岁。发病至确诊时间1 ~10.0 a,平均(4.9 ±3.8)a。本组患者均为成年人(>30岁)、缓慢进展、散发的病例。
1.2 方法 经详细询问病史、系统体格检查及行头颅MRI检查、卧立位血压测定等辅助检查。依据2008年Gilman等[1]提出的MSA诊断标准,可将该病临床表现分为MSA-C和 MSA-P两个亚型。以符合“拟诊MSA”的标准收集病例资料,记录并分析各病例的临床特点及辅助检查等资料。
2 结果
2.1 临床特征 本组研究中68例MSA患者中MSAP亚型23例(33.8%),MSA-C 亚型 45例(66.2%)。其中57例自主神经功能障碍存在于MSA-P亚型及MSA-C亚型中,分别占有 18例(78.3%)、39例(86.7%)。MSA-P亚型及MSA-C亚型主要临床症状及主要体征见表1、表2。
2.2 头颅磁共振成像(MRI)检查 本研究中68例患者均行MRI检查,其中90%以上MSA患者MRI存在异常改变。现收集MSA-P亚型23例,MSA-C亚型45例,以T2信号改变的典型特征汇总见表3。
本研究MSA患者MRI的T2信号改变除了发现MSA典型特征:壳核背外侧条带样低信号、外侧缘裂隙样高信号、小脑萎缩、小脑中脚高信号、脑桥基底部“十字征”,还发现延髓腹侧面萎缩,侧脑室、第三脑室、第四脑室、桥延池、枕大池等不同程度扩大,这些改变多在MSA晚期发现。其中2例发现大脑皮质萎缩,表现为痴呆样症状,3例表现为双侧额顶叶白质脱髓鞘,基底节区缺血灶。
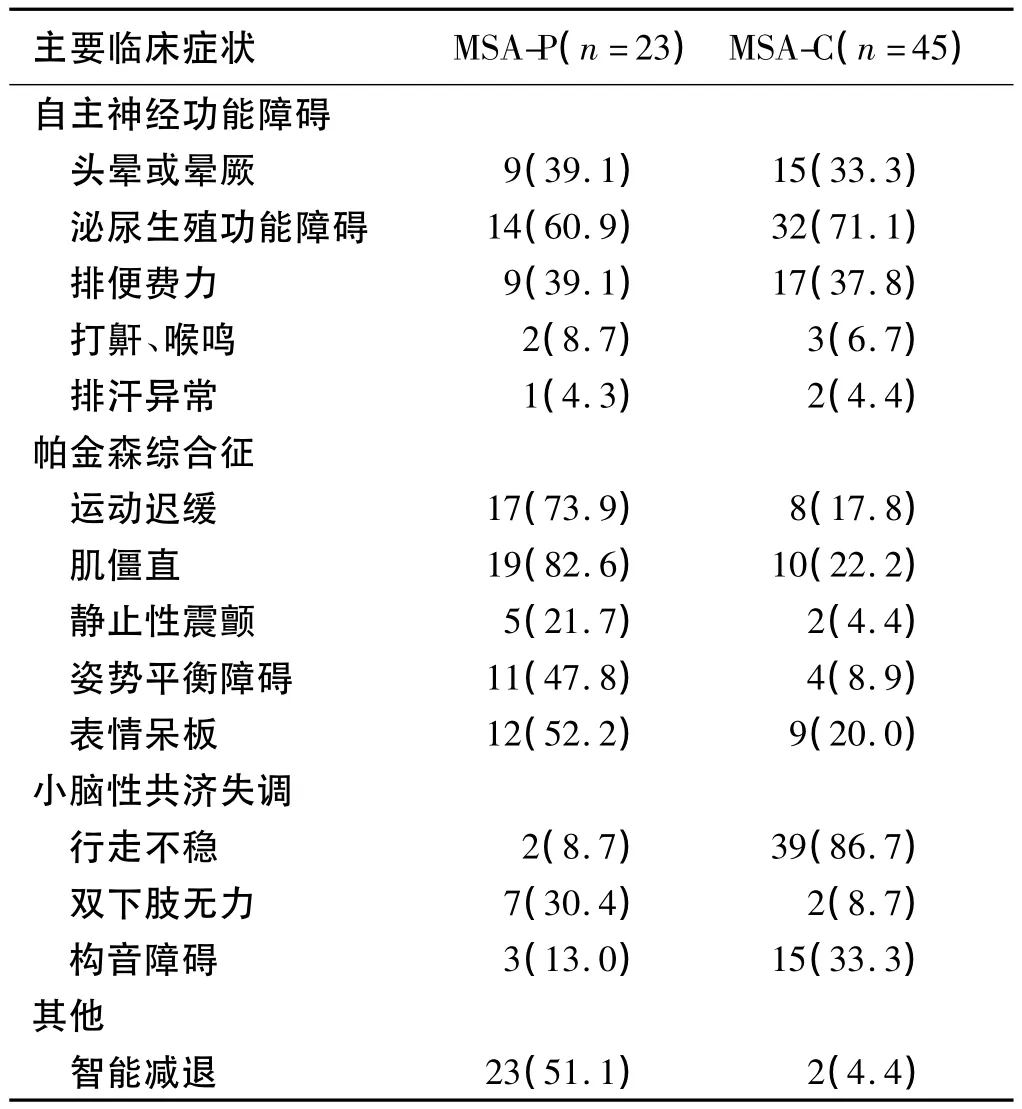
表1 MSA-C亚型与MSA-P亚型的主要临床症状[n,(%)]
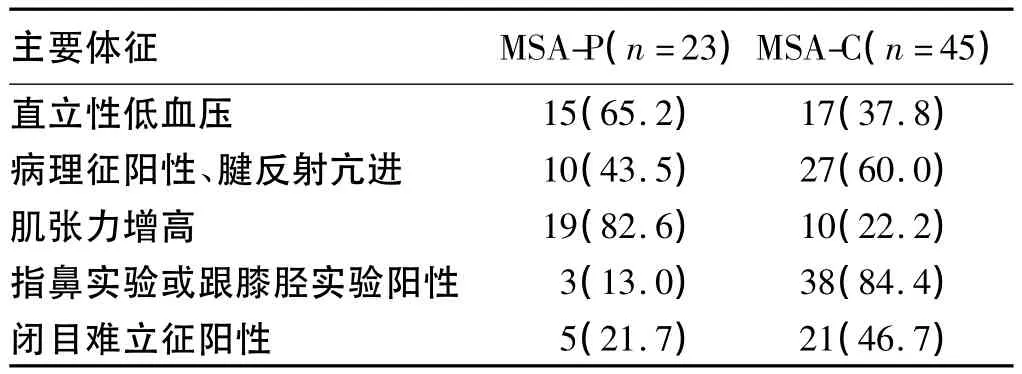
表2 MSA-C和MSA-P两亚型的主要体征[n,(%)]

表3 MSA-P亚型与MSA-C亚型MRI的T2信号改变典型特征[n,(%)]
3 讨论
MSA为一种发病原因尚不明确的进行性神经多系统变性疾病,其确诊必要条件是靠病理组织学在神经胶质细胞浆内发现嗜酸性包涵体,其包涵体核心成分为α-突触蛋白,其他病理改变还有发现小脑蒲肯野细胞脱失和壳核胶质细胞增生、神经元减少等。患者主要出现锥体外系统、小脑系统、自主神经系统、锥体系统损害等症状,部分患者还会出现认知功能障碍等。
3.1 临床表现 根据2008年Gilman等修订的MSA诊断标准,认为MSA为散发的、进展性、大于30岁的成人发病的神经变性疾病,其临床特征主要包括:①自主神经功能障碍:本研究中自主神经功能障碍57例(83.8%),其中46例(67.6%)表现泌尿生殖功能障碍。文献研究报道MSA患者出现自主神经功能障碍症状中泌尿功能异常发生率较高,占55% ~96%[2]。MSA患者自主神经功能障碍常发生在锥体外系或小脑受累症状之前或者伴行,这有利于早期MSA与单纯自主神经功能障碍(PAF)的鉴别。吸气性喘鸣、手足凉、新发或进展性打鼾等症状是MSA红旗征[3]的组成部分,对于早期出现这些症状可能进展为MSA的患者,应予以重视。②帕金森综合征:本研究中MSA-P亚型患者23例(33.8%)。本研究中未发现帕金森病典型的“搓丸”样震颤,且MSA-P亚型大部分患者长期治疗中对左旋多巴反应差,部分短期治疗有效。MSA患者并无进行性核上性麻痹(PSP)的垂直性核上性凝视麻痹及明显的垂直扫视缓慢症状,临床上可行水平和垂直性眼动分析鉴别二者。③小脑性共济失调:在本研究中MSA-C亚型占66.1%,其中行走不稳最常见,占总数60.3%。该临床表现多从双下肢开始,体格检查可发现下肢受累较重的小脑病损体征,但当合并锥体外系和锥体束症状时常干扰对小脑体征的发现。该亚型中小脑受累症状需与多种遗传性和非遗传性小脑共济失调相鉴别,Geser等[4]提出该亚型若在4 a内出现自主神经功能障碍或帕金森综合征,易与其他特发性小脑共济失调鉴别。④其他症状:本研究中2例出现智能减退,符合Kim等[5]报道的MSA患者痴呆,主要表现为注意力、视空间功能、语言功能下降,影像学上发现患者脑皮质厚度减少。
3.2 辅助检查 根据MSA诊断标准可知确诊MSA需病理学上证实,鉴于当前国内各种原因限制尚不能完成,普遍以MRI为主要辅助手段,并借以其他辅助手段以达到诊断目的。本研究中MSA患者行MRI检查主要出现T2WI壳核萎缩、外侧缘裂隙样高信号、小脑中脚高信号、小脑萎缩及脑桥基底部“十字征”。随着临床研究进展,新的MRI技术也涌现出来。根据文献报道,MR平面测量、结构体积测量、磁化传递成像(MTI)、弥散加权成像(DWI)、扩散张量成像(DTI)、磁敏感加权成像(SWI)、磁共振波谱(MRS)已广泛应用到对MSA的鉴别与诊断,并得到研究验证[6]。Mat等[7]研究发现在3.0TMRI的T1加权成像中运用比率(SLC-SPT)/SPT,其中SLC代表蓝斑的信号强度,SPT代表脑桥背侧部的信号强度,MSA患者蓝斑信号强度比率明显低于PD,且蓝斑的信号强度比率可以作为一个生物标记用来评估MSA的病程进展程度。
3.3 治疗及预后 目前MSA尚无特效治疗方法,该病进展快,平均病程为8~9 a,多数预后不良,现治疗主要针对延缓病情进展,多采用保护及营养神经、对症支持治疗、康复锻炼等综合治疗方法。近期文献研究报道伴发呼吸睡眠暂停综合征的MSA患者,可使用佐匹克隆或褪黑激素作为替代氯硝西泮减少治疗风险[8]。有研究者提出运用中医辨证与辨病相结合方法治疗MSA,但只能改善部分症状,长期的疗效仍需进一步探索研究[9]。目前干细胞移植技术已应用于治疗MSA患者,但治疗效果仍处于临床观察阶段。近期文献研究报道应用免疫球蛋白治疗MSA患者获得一定的效果,但样本量少,我们仍需要大量研究给予验证[10]。
本研究采用回顾性研究分析,收集的病例资料的完整性及准确性可能存在局限性,但仍能反映当前MSA患者的临床特征。通过对以往及近期的文献查阅,发现对MSA患者的诊断,不管是诊断标准还是诊断技术、辅助工具都在不断的更新。这些新技术和新标准为我们对MSA的认识和诊断提供依据。由于该病累及多个系统,临床表现复杂多样,对其治疗效果都不理想,因此对其早期临床表现准确诊断,并早治疗能够延缓该病进展。近期涌现一批利用干细胞移植技术及免疫球蛋白等技术治疗MSA患者,并取得一定的疗效。若这些技术获得大量的临床研究验证,将不失为临床治疗MSA的一次突破。
[1]Gilman S,Wenning G K,Low P A.Second consensus statement on the diagnosis of multiple system atrophy[J].Neurology,2008,71(9):670-676.
[2]王珧,张颖冬.多系统萎缩的自主神经功能表现研究进展[J].国际神经病学神经外科学杂志,2012,39(4):339-343.
[3]Hensperger M,Geser F,Seppi K,et al.Red flags for multiple system atrophy[J].Mov Disord,2008,23(8):1093-1099.
[4]Geser F,wenning G K,Seppi K,et al.Progression of multiple system atrophy(MSA):aprospectivenalural history by the European MSA study Group(EMSA SG)[J].Mov Disord,2006,21(2):179-186.
[5]Kim H J,Jeon B S,Kim Y E.Clinical and imaging characteristics of dementia in multiple system atrophy[J].Parkinsonism Relat Disord,2013,19(6):617-621.
[6]向小爽,孙占芳,邝岚琼.多系统萎缩影像学研究进展[J].中华临床医师杂志,2012,6(7):87-89.
[7]Matsuura K,Maeda M,Yata K.Neuromelanin magnetic resonance imaging in parkinson’s disease and multiple system atrophy[J].Eur Neurol,2013,70(2):70-77.
[8]Ferini-Strambi L,Marelli S.Sleep dysfunction in multiple system atrophy[J].Curr Treat Options Neurol,2012,14(5):464-473.
[9]顾卫红.多系统萎缩的诊断与治疗[J].中国现代神经疾病杂志,2012,12(3):257-260.
[10]Novak P,Williams A,Ravin P.Treatment of multiple system atrophy using intravenous immunoglobulin[J].BMC Neurol,2012,12(1):131-137.
