南极普里兹湾及邻近海域沉积物微生物多样性与生理生化研究*
2014-10-08丁新彪丛柏林靳永轩王能飞黄晓航
丁新彪,丛柏林,张 扬,靳永轩,祝 茜,王能飞,黄晓航
(1.山东大学(威海)海洋学院,山东 威海 264209;2.国家海洋局 第一海洋研究所 海洋生物活性物质重点实验室,山东 青岛 266061)
南极大陆为地球上最冷最干的地区,常年被冰雪覆盖,具有酷寒、烈风、干燥、强辐射等极端气候环境。普里兹湾是南极大陆印度洋扇形区中最大的海湾,是除威德尔海和罗斯海之外的第三大海湾,地处世界最大的兰伯特冰川所占据的地堑末端的冰川入海处,形成了广阔的埃默里冰架,其下为一个具有不同深度、温度、压力、盐度的沉积环境[1]。由于深海沉积物亿万年的沉积作用,不仅地质条件复杂,所含矿物成分繁复,而且是最复杂的微生物栖息地[2],形成集化学物质和微生物于一体的特殊生态环境[3]。研究海洋沉积物微生物多样性不仅可以为开发利用微生物资源提供重要的参考依据,甚至还可以为人类了解生命起源和进化提供重要的线索[4]。同时有研究证明这些低温微生物在南极自然环境下的物质循环、生物地球化学过程以及南极生态与环境系统中担负着重要作用[5-6]。
酷寒等极端环境使南极成为一个重要的微生物资源库,南极不仅是微生物新物种的生存繁衍地,更是产生如特殊酶类、多糖等新型生物活性物质和先导化合物菌株的潜在种源地[7]。南极深海沉积物中的微生物经历长时间演变,已经形成了适应恶劣环境的独特机制[8]。近年来对南极微生物多样性、特殊生理生化特性、产低温酶等研究已成为许多专家学者的重点研究方向[9-10]。Bowman等[11]通过构建16SrRNA文库分别对南极大陆架不同深度沉积物中的细菌多样性进行了研究,肖昌松等[12]对南极半岛及舍得兰群岛海底沉积物的低温菌进行了鉴定分析,这些研究都证实了南极深海沉积物中具有较丰富的微生物多样性。但是目前,对南极普里兹湾深海沉积物中微生物多样性研究还鲜见报道。
南极微生物低温酶有独特的动力学和分子学特征,低温催化能力强,催化效率高。其低温热稳定性在工业应用中具有高生长速率、高酶活力及高催化效率、生产过程可在0~20℃低温和室温下进行,尤其是南极低温蛋白酶、脂肪酶、淀粉酶和纤维素酶等更具有广阔的生物工程应用前景,已受到人们广泛的关注[13-15]。Vazquez等[16]在南极乔治王岛土壤中分离到了3株产胞外蛋白酶的低温假单胞菌,发现其在20℃时具有最高的蛋白水解活性;钱文佳等[17]在南极海冰中筛选得到了一株产纤维素酶的假交替单胞菌,该菌株在0~10℃范围内均有较高的产酶能力;Ray等[18]从南极Schirmacher Oasis土壤中筛选到一株分泌酸性蛋白酶的耐冷型酵母Candidahumicola,其在低温条件下具有较高的产酶能力,最适酶活温度为37℃。
本研究以中国第29次南极科学考察采自南极普里兹湾及邻近海域25个站位的海洋沉积物样品为研究对象,通过细菌16SrRNA基因和真菌ITS基因序列扩增进行系统进化分析,初步揭示了南极普里兹湾及邻近海域沉积物中少量可培养微生物的多样性,对分离培养的细菌、真菌进行了初步的生理生化特性研究,筛选了一批具有产酶(蛋白酶、脂肪酶、淀粉酶和纤维素酶等)特性的低温微生物,为进一步研究和实际应用奠定了基础。
1 材料与方法
1.1 采集站位
沉积物样品来自中国第29次南极科学考察,考察区域位于普里兹湾及邻近海域。用地质箱式沉积物采样器取样,样品采至甲板上,用无菌药匙从样品表面取样10~20g,置于无菌离心管中4℃保存,备日后筛选培养。采集站位见表1。
1.2 培养基
1.2.1 细菌培养
2216E培养基:蛋白胨5g,酵母粉1g,琼脂18g,海水1 000mL,121℃(98.1kPa)高压灭菌20min,加终浓度为100μg/mL制霉菌素以抑制真菌生长。
1.2.2 真菌培养
土豆培养基(PDA):土豆200g,葡萄糖10g,琼脂17g,121℃下高压湿热灭菌20min,蒸馏水1L,用于南极真菌的培养。
酶活性测定培养基[19]:
(1)淀粉酶:淀粉20g,KNO31g,K2HPO40.5g,MgSO4·7H2O 0.5g,FeSO4·7H2O 0.01g,琼脂17g,蒸馏水1L。
(2)酪蛋白酶:酪蛋白4g,KNO31g,K2HPO40.5g,MgSO4·7H2O 0.5g,FeSO4·7H2O 0.01g,琼脂17g,蒸馏水1L。
(3)木质素酶:在PDA培养基中加0.05%的苯胺蓝后灭菌,产木质素酶菌株可使苯胺蓝褪色周围有透明圈。
(4)纤维素酶:在PDA培养基中加0.05%的刚果红后灭菌,产木质素酶菌株可使刚果红褪色周围有透明圈。
(5)卡拉胶酶:卡拉胶2g,FeSO4·7H2O 0.000 2g,硫酸铵5g,海水1L。
1.3 菌株筛选纯化及保存
1.3.1 细菌筛选纯化及保存
称取约1g采集的沉积物样品置于10mL海水中,振荡混匀后静置过夜。将预处理后的样品悬液系列稀释至10-1、10-2,分别取100μL涂布2216E培养基平板,于12℃培养。培养4~7d后,根据菌落形态、色素、干燥等特征,挑取形态差异较大的细菌进行划线纯化。挑取纯化后的单菌,于-80℃下用25%甘油保种。
1.3.2 真菌筛选纯化及保存
将采集的沉积物样品在8℃冰箱中自然晾干后,称取约1g置于10mL无菌海水中,振荡混匀后静置过夜。将预处理后的样品悬液系列稀释至10-1、10-2,分别取100μL涂布PDA培养基平板,于12℃培养。培养1~2周后,根据菌落形态、色素、干燥等特征,挑取形态差异较大的真菌和放线菌进行划线纯化。挑取纯化后的单菌,置于-80℃下用20%甘油保种。
1.4 分子鉴定及系统发育分析
1.4.1 细菌16SrRNA扩增
细菌总DNA的提取按Tiangen细菌总DNA提取试剂盒操作说明进行。按照Tiangen 2×Taq PCR MasterMix说明书,采用通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′及1492R:5′-GGTTACCTTGTTACGACTT-3′[20],进行16SrRNA 基因的扩增。扩增程序为:94℃预变性5min;94℃变性30s,55℃退火30s,72℃延伸1min 30s,共30个循环;72℃延伸10min。
1.4.2 真菌ITS基因序列扩增
将筛选纯化的真菌在PDA培养基上培养一周后,刮取约50mg菌苔,于研钵中液氮研磨,参照Tiangen植物基因组DNA提取试剂盒操作说明提取真菌DNA。按照Tiangen 2×Taq PCR MasterMix说明书,采用引物ITS1:5′-TCCGTAGGTGAACCTGCGG-3′和ITS4:5′-TCCTCCGCTTATTGATATGC-3′[21]进行ITS基因序列的扩增。扩增程序为:94℃DNA双链预变性5min;94℃变性30s,55℃退火30s,72℃延伸40s,共30个循环;72℃延伸10min。
1.4.3 系统发育树的构建
以上PCR扩增产物用1%琼脂糖凝胶电泳检测后,送至上海桑尼生物科技有限公司测序。将细菌16S rRNA和真菌ITS基因序列测序结果提交至 GenBank数据库(http://www.ncbi.nlm.nih.gov/blast/blast.cgi)进行Blast相似性比较分析,选取与实验菌株亲缘关系较近的菌株及南极常见菌株用BioEdit软件的Clustal W法进行多序列比对(multiple alignment),并用 Mega5.1软件的邻接法(neighbor-joining method)构建系统进化树。
1.5 菌株生理生化特性分析
1.5.1 细菌 API 20NE鉴定
采用API 20NE鉴定条(法国梅里埃公司)对分离培养的细菌进行生理生化指标测定,培养温度设为12℃,判读结果时间为48h,具体操作按API 20NE说明进行。
1.5.2 真菌产胞外酶活性
参照靳永轩[19]使用酶活性测定培养基的方法,筛选产胞外酶活性的真菌菌株。
(1)淀粉酶:在菌落周围滴加碘液数分钟后,遇到碘液不变为蓝色,证明有淀粉酶产生形成者为阳性,透明圈的大小表示淀粉酶活性强弱;(2)酪蛋白酶:在长出菌落的培养基上覆盖40%的Cl3CCOOH,10~15min后倒去Cl3CCOOH溶液,菌落周围出现透明圈者为阳性;(3)产木质素酶菌株可使苯胺蓝褪色,周围有透明圈者为阳性;(4)产纤维素酶菌株可使刚果红褪色,周围产生透明圈者为阳性;(5)产卡拉胶酶菌株可在以卡拉胶为唯一碳源的培养基中生长者为阳性。
2 结 果
2.1 分子鉴定与系统进化分析
从25份沉积物样品中共获得912株细菌和293株真菌,选取菌落形态、颜色、大小等特征差异较明显的53株细菌和31株真菌分别进行16SrRNA和ITS鉴定,共鉴定得到12个属的28株细菌和7个属的10株真菌(表2、表3),根据细菌16SrRNA和真菌ITS基因序列构建了菌株系统进化树(图1)。28株细菌分别属于革兰氏阳性菌的放线菌门(Actinobacteria,1株)、厚壁菌门(Firmicutes,2株);γ-变形菌(γ-proteobacteria,23株);α-变形菌(α-proteobacteria,1株)和拟杆菌门(Bacteroidetes,1株)。γ-proteobacteria中属假交替单胞菌属(Pseudoalteromonas)最多,有8株。一般16SrRNA序列同源性<98%则可认为属于不同种[22-23],菌株P7-9-1的16SrRNA序列最高同源性为97%,推测其可能是一个新种。真菌鉴定结果表明筛选得到的真菌属于4个纲7个属,分别为散囊菌纲(Eurotiomycetes)的青霉属(Penicillium)和曲霉属(Aspergillus)、座囊菌纲(Dothideomycetes)的枝孢属(Cladosporium)、粪壳菌纲(Sordariomycetes)的帚霉属(Scopulariopsis)和Geosmithiapallida、微球黑粉菌纲(Microbotryomycetes)的红酵母属(Rhodotorula)和Glaciozyma,其中菌株P7-16-7与Geosmithiapallida(HF546256)最高同源性仅为88%,因此推测其可能为一个新种。综上可知,南极普里兹湾及邻近海域沉积物中存在较丰富的微生物多样性。
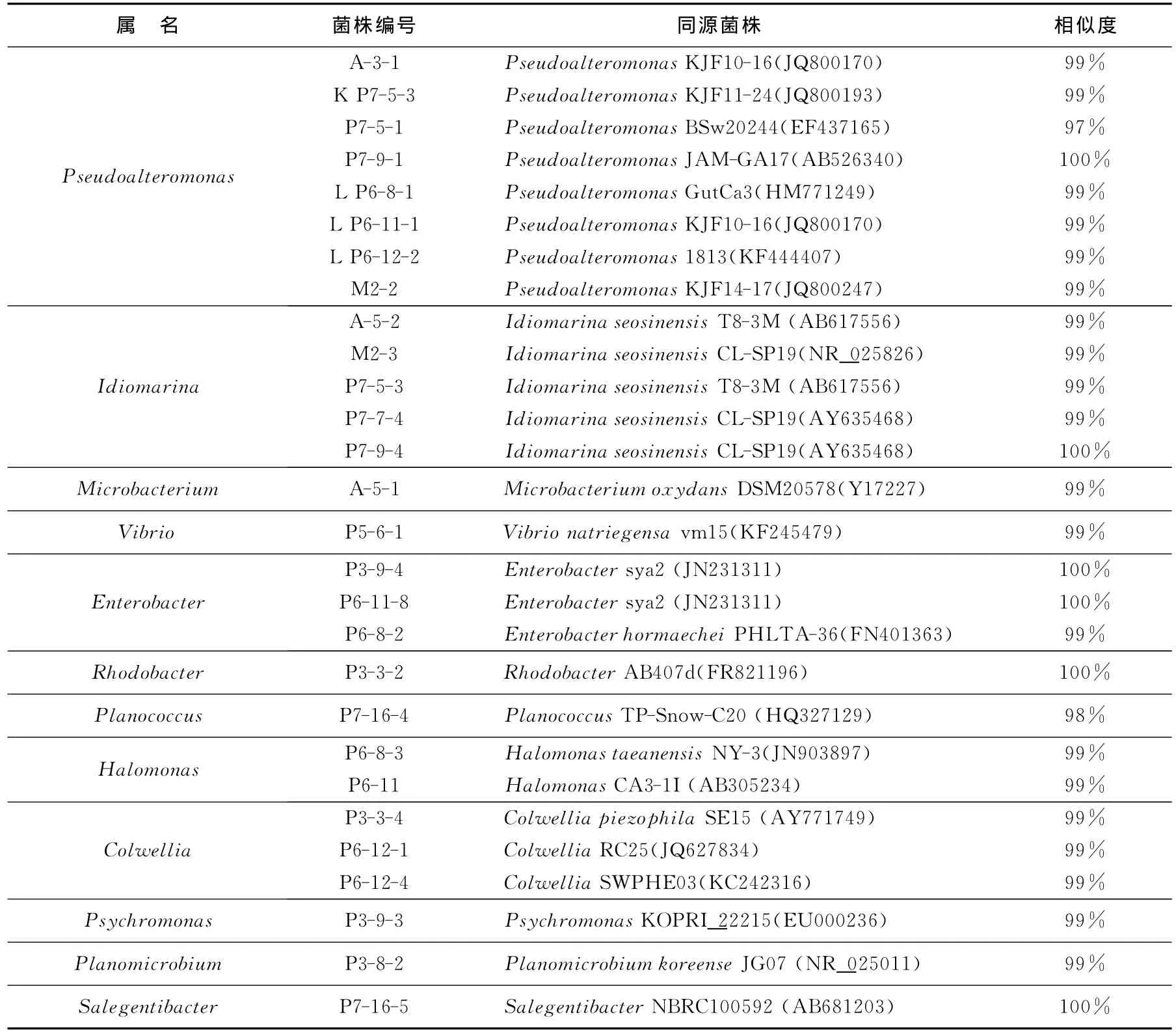
表2 普里兹湾及邻近海域沉积物中细菌的分离鉴定Table 2 Identification of bacteria isolated from the sediments of Prydz Bay and vicinity areas
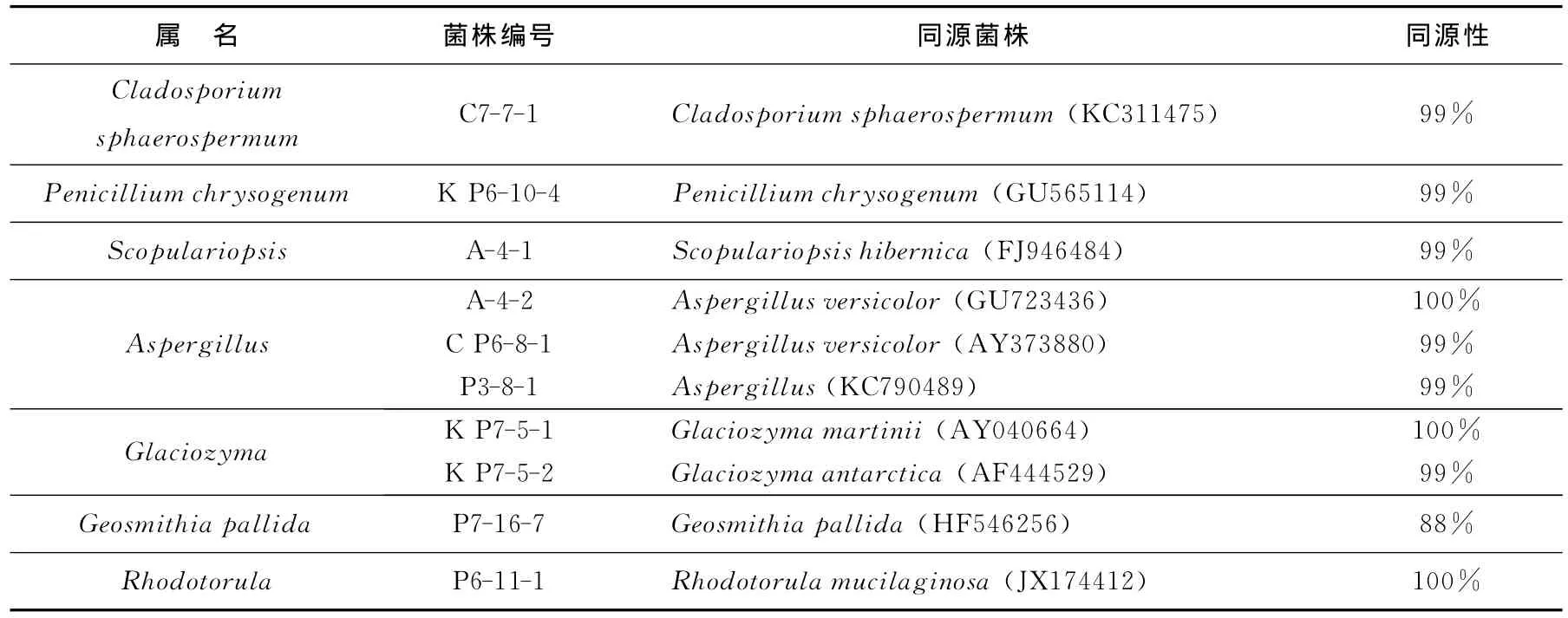
表3 普里兹湾及邻近海域沉积物中真菌的分离鉴定Table 3 Identification of fungi isolated from the sediments of Prydz Bay and vicinity areas
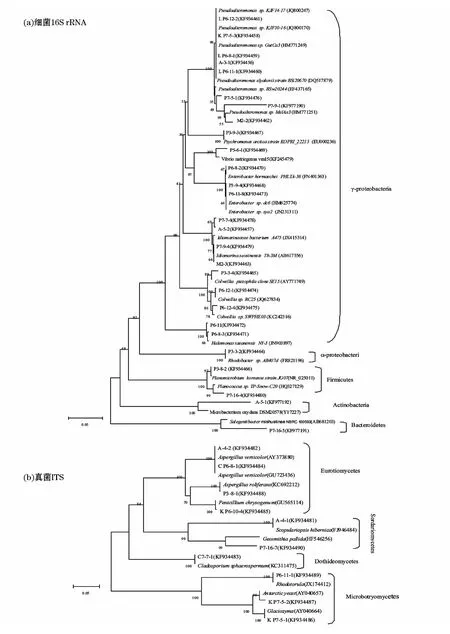
图1 细菌16SrRNA和真菌ITS基因序列构建的菌株系统进化树Fig.1 Phylogenetic trees of bacterial 16SrRNA and fungi ITS sequences.The numbers at the nodes indicate the bootstrap values based on neighbour-joining analyses of 1000data sets,brackets are GenBank accession number
2.2 菌株的生理生化特性
用API 20NE试条对分离纯化的28株细菌进行了8个传统生化及酶反应指标鉴定,检测结果见表4。其中67.8%的菌株可产生蛋白酶,2株产β-半乳糖苷酶,5株产β-葡萄糖苷酶。利用酶活性培养基对10株真菌进行产胞外酶活性筛选,测定结果见表5。杂色曲霉AspergillusversicolorC P6-8-1、球孢枝孢菌CladosporiumsphaerospermumC7-7-1可产生纤维素酶,产黄青霉PenicilliumchrysogenumK P6-10-4和南极酵母GlaciozymaK P7-5-1、K P7-5-2可产生卡拉胶酶。
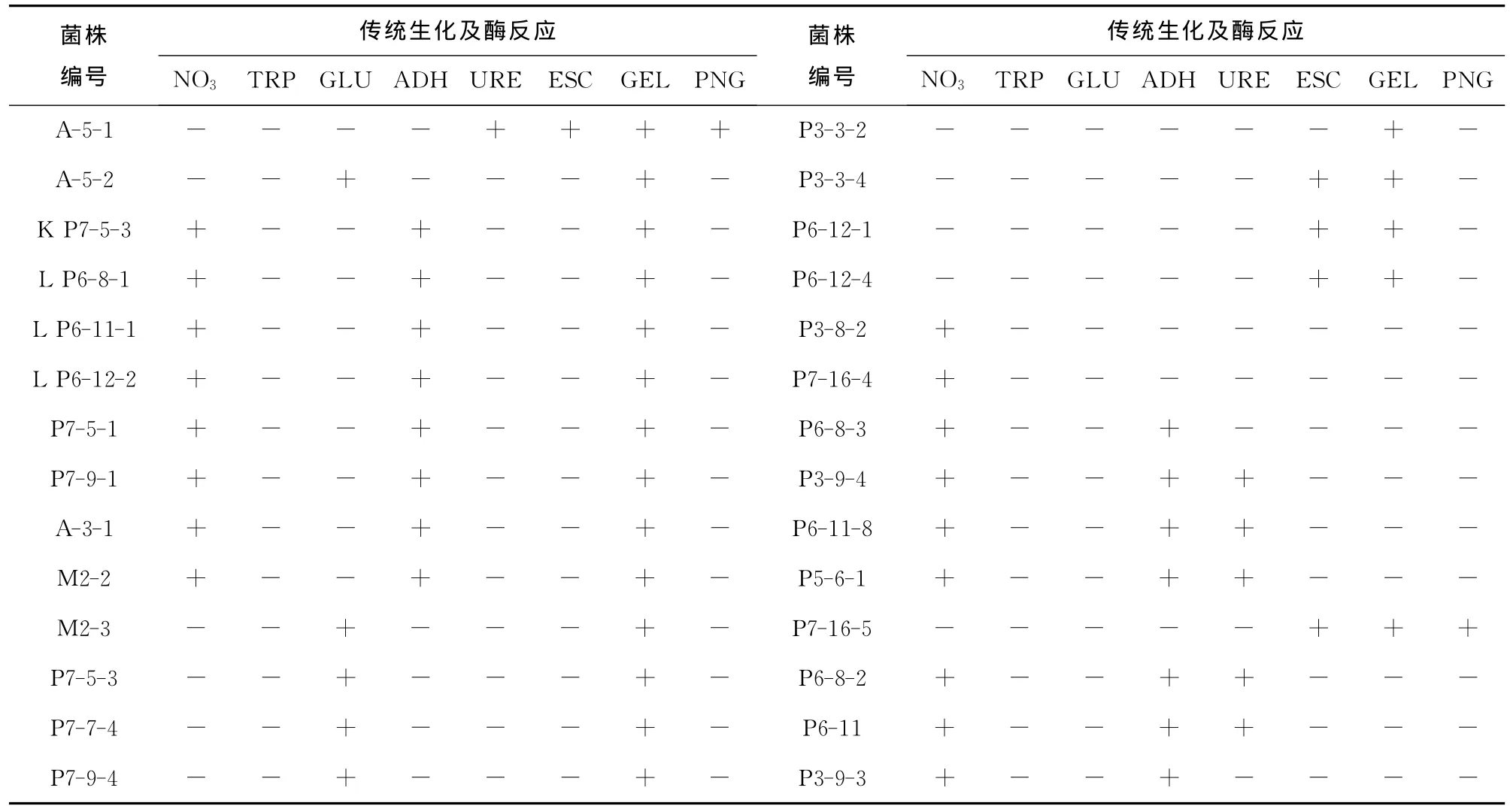
表4 普里兹湾及邻近海域细菌API生理生化测定结果Table 4 API physiological and biochemical characterization of bacteria isolated from the sediments of Prydz Bay and vicinity areas

表5 普里兹湾及邻近海域真菌产胞外酶活性测定结果Table 5 Extracellular enzyme activity of fungi isolated from the sediments of Prydz Bay and vicinity areas
3 讨 论
普里兹湾及其毗连陆架水体较为稳定且富含有机质成分[24-25],为普里兹湾海底沉积物中微生物提供了很好的营养环境。以往对南极不同地区海底沉积物的研究表明,细菌主要包括变形菌、厚壁菌、放线菌、拟杆菌等多种类群[26-27],本研究对采自普里兹湾海底沉积物的样品筛选获得的可培养细菌的鉴定,与之前在南极其它地区海底沉积物样品所得到的结果基本相同。
在南极细菌研究方面,Zhang等[28]对普里兹湾深海沉积物中产淀粉酶细菌研究中发现γ-proteobacteria为优势菌群,其次为革兰氏阳性菌;马吉飞等[29]在研究南极普利兹湾夏季海冰中细菌群落丰度及组成中也发现γ-proteobacteria为优势类群。本研究在验证了上述研究结果的同时,发现从普里兹湾及邻近水域分离培养的细菌中,γ-proteobacteria不仅为绝对优势菌群,且以假交替单胞菌属Pseudoalteromonas居多。在南极真菌研究方面,目前该类研究还相对较少且大都集中于对南极土壤中真菌的研究方面。孔华忠等[30]、靳永轩等[31]、陈皓文等[32]分离出南极不同岛屿土壤中的真菌类群,鉴定出有青霉、曲霉、枝孢霉、金孢霉、出芽短梗霉、散囊菌等,本研究在普利兹湾深海沉积物样品中分离得到了枝孢霉属、青霉属、曲霉属、帚霉属、红酵母属(Rhodotorula)、Glaciozyma和Geosmithiapallida的菌株,但并未分离得到金孢霉和出芽短梗霉,分离得到菌株的不同可能与样品来自土壤和水体等不同栖息环境有关,也可能与采样地点的不同有关。
迄今为止,各国的科学家从极地冰芯、水样、土壤、沉积物和岩石等发现了数量和种类繁多的微生物种群,而且发现了许多嗜冷、适冷微生物可以产生多种低温降解酶类。纤维素是植物秸秆的主要成分,是地球表面数量最大的可再生生物能源,如能低温条件下有效降解纤维素并对植物秸秆加以利用,将对当代环境保护和可持续的经济发展都有着重要的研究价值和广阔的应用前景。能将纤维素降解的酶是一个酶系,纤维素的降解是多种酶共同作用的结果,其中β-葡萄糖苷键的水解是制约纤维素彻底降解为单糖的瓶颈[33],本项研究筛选获得了5株产β-葡萄糖苷酶的南极低温细菌和2株产纤维素酶的真菌(杂色曲霉A.versicolorC P6-8-1和球孢枝孢菌C.sphaerospermumC7-7-1),这些能产生与纤维素降解相关的菌株,在工业发酵中将可能有潜在的应用价值。本研究还得到了2株产β-半乳糖苷酶的南极细菌。Turkiewicz等[34]2003年从南极磷虾的消化道内分离出一株产β-半乳糖苷酶的海洋菌Pseudoalteromonassp.22b,该菌可在低温下快速降解乳糖并能排除在较高温度下中温微生物的污染,因此获得产β-半乳糖苷酶的南极细菌同样可能有潜在的应用价值。综上所述,通过对普里兹湾及邻近海域25个站位的沉积物样品中可培养微生物的多样性与生理生化进行初步研究,筛选获得了一批具有产酶特性的低温微生物,为进一步的应用研究奠定了基础。
(References):
[1] LI H Y,YU Y,ZENG Y X,et al.Phylogenetic analysis of bacterial diversity in Pacific Arctic sediment[J].Acta Microbiologica Sinica,2006,46(2):177-183.李会荣,俞勇,曾胤新,等.北极太平洋扇区海洋沉积物细菌多样性的系统发育分析[J].微生物学报,2006,46(2):177-183.
[2] LIU X,XIAO T,ZHANG W Y,et al.Diversity of bacterial community in sediments of Jiaozhou Bay[J].Marine Sciences,2010,34(10):1-6.刘欣,肖天,张文燕,等.胶州湾海域表层沉积物细菌多样性[J].海洋科学,2010,34(10):1-6.
[3] WOBUS A,BLEUL C,MAASSEN S,et al.Microbial diversity and functional characterization of sedments from reservoirs of different trophic state[J].FEMS Microbiology Ecology,2003,46:331-347.
[4] LIU P,WANG H M.The investigation of microbial diversity in marine sediments[J].Journal of Anhui Agri,2009,37(10):4569-4571.刘璞,王红梅.海洋沉积物微生物多样性研究[J].安徽农业科学,2009,37(10):4569-4571.
[5] VINCENT W F.Microbial ecosystem of Antarctica[M].Cambridge:Cambridge University,1988.
[6] ZENG Y X,CHEN B.Progress and application prospects in the study on Antarctic cold-adapted microorganisms[J].Chinese Journal of Polar Research,1999,11(2):143-152.曾胤新,陈波.南极低温微生物研究及其应用前景[J].极地研究,1999,11(2):143-152.
[11] BOWMAN J P,MCCUAIG R D.Biodiversity,community structural shifts,and biogeography of prokaryotes within Antarctic continen-tal shelf sediment[J].Applied and Environmental Microbiology,2003,69:2463-2483.
[12] XIAO C S,ZHOU P J,WANG T Z.Identifications and growth temperature characteristics of psychrotrophiles from Antarctic sediments[J].Acta Microbiologica Sinica,1990,30(4):233-242.肖昌松,周培瑾,王太珍.南极地区海底沉积物中低温菌的鉴定与生长温度特征[J].微生物学报,1990,30(4):233-242.
[13] ZHENG Z,MIAO J L,LI G Y.Progress in the study of peculiar enzymes of Antarctic microor-ganlsms[J].Chinese Journal of Marine Drugs,2005,24(4):49-55.郑洲,缪锦来,李光友.南极微生物中特殊酶类的研究进展[J].中国海洋药物杂志,2005,24(4):49-55.
[14] ZHANG S,ZHANG C S,TIAN X P,et al.The study of diversities of marine microbes in China[J].Biodiversity Conservation,2010,25(6):651-658.张偲,张长生,田新朋,等.中国海洋微生物多样性研究[J].生物多样性保护,2010,25(6):651-658.
[15] LIN X Z,HOU X G,LI G Y.Advances in research of cold-adapted enzymes from Antarctic bacteria[J].Marine Science,2002,26(10):38-42.林学政,侯旭光,李光友.南极微生物低温酶的研究进展[J].海洋科学,2002,26(10):38-42.
[16] VAZQUEZ S C,RIOS-MERINO L N,MACCORMACK W P,et al.Protease-production psychrotrophic bacteria isolated from Antarctica[J].Polar Biology,1995,15(2):131-135.
[17] QIAN W J,KAN G F,XU Z,et al.Screening and growth of antarctic bacterium producing cold-active cellulose and its enzymatic characterization[J].Food Science and Technology,2010,35(1):15-18.钱文佳,阚光锋,徐仲,等.产低温纤维素酶南极细菌的筛选、生长特性及酶学性质的初步研究[J].食品科技,2010,35(1):15-18.
[18] RAY M K,DEVI K U,KUMAR G S,et al.Extracellular protease from the antarctic yeast Candida humicola[J].Applied and Environmental Microbiology,1992,58(6):1918-1923.
[19] JIN Y X.Screening of Antarctic lignocellulose enzyme-producing fungi and lignin-degrading fungus Aspergillus sydowii MS-19transcriptome sequencing[D].Qingdao:First Institute of Oceanography,2013.靳永轩.产木质纤维素酶南极真菌的筛选与木质素降解菌Aspergillus sydowii MS-19转录组测序分析[D].青岛:国家海洋局第一海洋研究所,2013.
[20] LANE D J.16S/23SrRNA sequencing.In:Stackebrandt E,Goodfellow M (eds)Nucleic acid techniques in bacterial systematics.Wiley,Chichester,1991:115-175.
[21] GARDES M,BRUNS T D.ITS primers with enhanced specificity for basidiomycetes-application to the identification of mycorrhizae and rusts[J].Molecular Ecology,1993,2(2):113-118.
[22] DEVEREUX R,HE S H,DOYLE C L,et al.Diversity and origin ofDesulfovibriospecies:phylogenetic definition of a family[J].Journal of Bacteriology,1990,172(7):3609-3619.
[23] FRY N K,WARWICK S,SAUNDERS N A,et al.The use of 16Sribosomal RNA analyses to investigate the phylogeny of the familyLegionellaceae[J].Journal of General Virology,1991,137(5):1215-1222.
[24] NING X R,LIU Z L,SHI J X,et al.Standing crop and productivity of phytoplankton and poc in Prydz Bay and the adjacent waters[J].Antarctic Research(Chinese Edition),1993,5(4):50-62.宁修仁,刘子琳,史君贤,等.南极普里兹湾及其邻近海域浮游植物粒度分级生物量和初级生产力[J].南极研究(中文版),1993,5(4):50-62.
[25] ZHANG H S,HU C Y,PAN J M,et al.Seasonal variability in deep ocean particle fluxes in the north open sea of Prydz Bay[J].GEOCHIMICA,2003,32(4):358-362.张海生,扈传昱,潘建明,等.南极普里兹湾北部深海沉降颗粒物通量的季节性变化[J].地球化学,2003,32(4):358-362.
[26] LI S,XIAO X,YIN X,et al.Bacterial community along a historic lake sediment core Ardley Island,west Antarctica[J].Extremophiles,2006,10(5):461-467.
[27] SJÖLING S,COWAN D A.High 16SrDNA bacterial diversity in glacial meltwater lake sediment,Bratina Island,Antarctica[J].Extremophiles,2003,7(4):275-282.
[28] ZHANG J W,ZENG R Y.Psychrotrophic amylolytic bacteria from deep sea sediment of Prydz Bay,Antarctic:diversity and characterization of amylases[J].World Journal of Microbiology and Biotechnology,2007,23(11):1551-1557.
[29] MA J F,DU Z J,LUO W,et al.Bacterial diversity within different sections of summer seaice samples from the Prydz Bay,Antarctica[J].Acta Microbiologica Sinica,2013,53(2):185-196.马吉飞,杜宗军,罗玮,等.南极普利兹湾夏季海冰不同层次细菌丰度及多样性[J].微生物学报,2013,53(2):185-196.
[30] KONG H Z,QI Z T.Some filamentous fungi isolated from the materials of King George Island in Antarctica[J].Acta Mycologica Sinica,1991,10(1):57-60.孔华忠,齐祖同.南极乔治王岛的丝状真菌[J].菌物学报,1991,10(1):57-60.
[31] JIN Y X,CONG B L,WANG N F,et al.Isolation and preliminary identification of microfungi in samples collected from Ardley Island,Antarctica[J].Chinese Journal of Polar Research,2013,25(1):71-77.靳永轩,丛柏林,王能飞,等.南极阿德雷岛不同基底中真菌的分离培养及初步鉴定[J].极地研究,2013,25(1):71-77.
[32] CHEN H W,YUAN J F,CAO J J,et al.Estimation on environmental microbial content in the area of Fildes Peninsula,Antarctica[J].Journal of Oceanography of Huanghai &Bohai Seas,2001,19(1):49-54.陈皓文,袁峻峰,曹俊杰,等.南极菲尔德斯半岛环境微生物含量估计[J].黄渤海海洋,2001,19(1):49-54.
[33] MENG X W,SONG X H,CHEN L J,et al.Advances in research ofβ-Glucosidase[J].China Dairy,2009,10:42-44.孟宪文,宋小红,陈历俊,等.β-葡萄糖苷酶的研究进展[J].中国乳业,2009,10:42-44.
[34] TURKIEWICA M,KUR J,BIALKOWSKA A,et a1.Antarctic marine bacteriumPseudoalteromonassp.22bas a source of cold-adapted β-galactosidase[J].Biomolecular Engineering,2003,20(4-6):317-324.
