0号柴油分散液对马粪海胆GSH含量影响的研究*
2014-10-08杨柏林丁光辉熊德琪
高 翔,杨柏林,丁光辉,熊德琪
(大连海事大学 环境科学与工程学院,辽宁 大连 116026)
随着石油工业和海上运输业的发展,各类溢油事故频发[1],大量石油烃通过各种途径进入海洋。溢油污染已经严重损害了海洋生态环境[2],并给我国海洋渔业,海洋生物资源造成了极大损失[3-6]。溢油污染使得海底环境油污染程度日益增高,破坏了底栖生物的生存环境,对底栖生物的生长、繁殖产生不同程度的影响[7]。更为严重的是,石油烃会通过生物摄取进入食物链,进而在人体中富集,而它在人体内的持久存在会对人类健康产生极大的负面影响[8-11]。因此,石油烃污染对海洋生物产生的毒性效应以及海洋环境的石油烃污染监测亟待人们深入研究。
目前,国内外研究人员已经开展了大量关于石油烃污染对海洋生物毒性效应方面的研究[12-17],但大部分研究主要针对原油对海洋浮游植物及鱼贝类的毒性效应[18-21]。前人的研究发现石油烃污染会造成鱼贝类氧化胁迫,抑制其酶活性,产生遗传毒性和生物蓄积作用[22-24],而其对海洋底栖生物的毒性效应和致毒机理尚不完全明确。大量实验结果表明,当海水中石油的质量浓度为1mg/L或溶于水的石油烃的质量浓度为1μg/L时,就能对敏感生物产生危害[25]。国内外许多研究也已经证实轻质燃油的毒性较其它油品更大[26-28]。谷胱甘肽(GSH)作为生物体内抗氧化系统的一部分,对污染物的胁迫十分敏感,其活性变化可为污染物胁迫下机体的氧化应激反应提供敏感信息。因此,GSH被作为分子生物标志物广泛用于环境污染的早期预警。综上,本研究选取国内常用的船用轻质燃油——0号柴油作为受试油品,以国内常见的海洋底栖生物——马粪海胆作为受试生物,考察了石油烃污染对海胆体内GSH含量的影响,为评估溢油污染对海洋底栖生物的毒性效应并寻找适合检测石油烃污染的生物标志物提供一定依据。
1 实验材料和方法
1.1 受试生物
本实验采用的马粪海胆(Hemicentrotuspulcherrimus)购于大连碧龙海珍品养殖公司。在水温18±2℃、盐度31.4的实验室条件下暂养3个月后,选择健康、反应灵活、大小一致的海胆进行实验。实验用海胆直径6±0.2cm、体重67.2±4.6g、30个月龄左右。
1.2 主要仪器与试剂
主要仪器:JDS-109U红外测油仪(吉林市北光分析仪器厂);JB-3型磁力搅拌器(上海市悦丰仪器仪表有限公司);Beckman J2-MC型高速冷冻离心机(BECKMAN美国公司);BS210S万分之一电子天平 (北京赛多利斯天平公司)。
主要试剂:GSH检测试剂盒(南京建成生物工程研究所);考马斯亮蓝蛋白测定试剂盒(南京建成生物工程研究所);红外测油专用四氯化碳(天津光复精细化工研究所)。
1.3 受试液的制备
1.3.1 过滤海水
砂滤海水取自大连市星海湾,其盐度为31.35,电导率为47.3ms/cm,pH值为8.130。
1.3.2 0号柴油分散液(WAFs)的制备
本研究所用0号柴油由大连市海事局提供。将0号柴油与过滤海水按体积比1∶9混合,磁力搅拌器低速搅拌24h,静置4h后,分离下层水相即为母液。将母液置于4℃环境中避光保存,实验前稀释至所需质量浓度。
1.3.3 0号柴油分散液(WAFs)石油烃质量浓度的测定
本实验参照GB/T16488-1996《水质石油类和动植油的测定》所介绍的红外光度法测定母液中的石油烃质量浓度:1)用CCl4分两次萃取水体中的石油烃;2)将萃取液通过特定活性的硅酸镁吸附,脱除动植物油等极性化合物;3)将其置于红外测油仪中,分别于波数为2 930,2 960和3 030cm-1谱带处测得吸光度A2930、A2960和A3030,并进行计算。计算公式为:
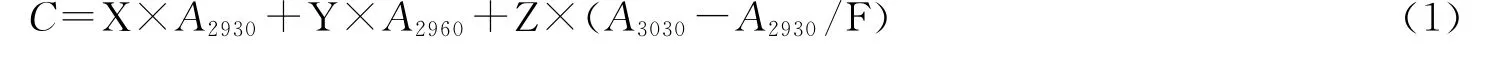
式中,C为溶剂中石油烃质量浓度;X、Y、Z为各波长对应的校正系数;F为脂肪烃对芳烃的影响校正因子。
1.4 暴露实验
暴露实验按照0号柴油分散液的质量浓度差异设置为低质量浓度组(5mg/L)、中质量浓度组(20mg/L)、高质量浓度组(50mg/L)。每组随机选取马粪海胆5只(不区分雌雄),置于32cm×16.5cm×24cm玻璃缸中采用静水法避光暴露,暴露溶液总体积为6 500mL。实验期间每隔12h换受试液一次,并投入一定的饵料。暴露时长为13d,之后为恢复期。分别于暴露1、5、9、13和24d后进行海胆体内GSH含量的分析和测定。
1.5 GSH含量测定
用电子天平准确称量一定质量的海胆组织(肠和性腺)。用4℃预冷的灭菌注射器准确抽取一定体积(80μL)的海胆体液,分别置于1mL离心管中。然后加入pH为7.8的磷酸缓冲液或生理盐水稀释9倍后,用匀浆仪冲捣制成10%的组织匀浆液,转移至1.5mL离心管中(冰上操作)。将离心管置于高速冷冻离心机中,以9 000r/min(约为9 257.14g)的转速离心20min,取上清液,置于4℃环境中保存。GSH及蛋白质含量(考马斯亮蓝法)的测定均按照试剂盒方法进行操作。
测定组织中GSH含量时,所采用单位为:U/mgprot,表示每mg蛋白质中的活力单位。测定体现中GSH含量时所用单位为U/mL,表示每mL液体中的活力单位。
1.6 数据处理
1.6.1 数据统计分析
本研究采用SPSS 19.0数据分析软件,对数据进行单因素方差分析:当P≤0.05时认为差异显著;P≤0.01时认为差异极显著。
1.6.2 诱导率及抑制率计算方法
1)诱导率计算公式:
式中,Ni为实验组受诱导后GSH含量;N为对照组GSH含量。
2)抑制率计算公式:

式中,Ns为实验组受抑制后GSH含量;N为对照组GSH含量。
2 实验结果与分析
2.1 马粪海胆体内GSH含量的组织分布
将正常生理条件下马粪海胆体内的GSH含量加以统计(表1),由表1可见,在正常条件下海胆的肠、体液和生殖腺中GSH含量有明显差异。

表1 马粪海胆GSH含量在各组织中的分布情况Table 1 The tissue distributions of GSH content in Hemicentrotus Pulcherrimus
2.2 0号柴油分散液对马粪海胆肠道GSH含量的影响
0号柴油分散液对海胆肠道GSH含量影响的实验结果如图1所示。整个实验周期内海水对照组的GSH含量基本稳定。低质量浓度组GSH含量呈现先上升后下降的趋势,在9d时GSH含量达到峰值;中质量浓度组GSH合成在5d时受到诱导,含量较1d时有显著上升,暴露9d时GSH含量较5d时变化不大,13d时含量则大幅降低;高质量浓度组GSH合成在1d时即受到诱导,含量明显上升,并在此后几天持续下降。3个质量浓度组肠道GSH含量随时间的变化基本上遵循先升高后降低的规律,而高质量浓度组GSH含量在1d时即达到峰值,为对照组的152%,时间-剂量效应十分显著。当24d完成恢复实验时,3个质量浓度组之间GSH含量基本趋于一致,无明显差异。
2.3 0号柴油分散液对马粪海胆体液GSH含量的影响
0号柴油分散液对海胆体液中GSH含量影响实验结果如图2所示。整个实验周期中海水对照组GSH含量基本不变。由图2可知:低浓度组在暴露5d时GSH含量开始升高并在9d时达到最大值,在13d时GSH含量回落,且下降幅度较大;中浓度组在暴露1d时GSH含量较对照组明显偏低,在暴露5d后GSH合成受到诱导而上升,并在9d时达到峰值,13d时GSH含量回落;高浓度组在暴露1d时GSH含量偏高并持续上升,在5d时达到最大值,暴露9d时GSH含量显著下降,13d时含量与9d时基本持平。3个浓度组体液GSH含量随时间的变化基本上遵循先升高后降低的规律,时间-剂量效应明显。当24d完成恢复实验时,3个质量浓度组之间GSH含量基本恢复,与对照组无显著差异。
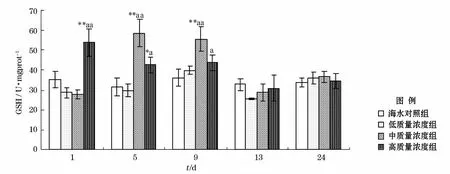
图1 0号柴油分散液影响马粪海胆肠道GSH含量的时间-效应曲线Fig.1 The time-effect responses of GSH content in intestine of Hemicentrotus pulcherrimus
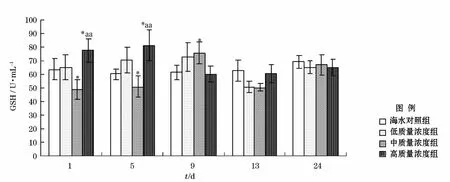
图2 0号柴油分散液影响马粪海胆体液GSH含量的时间-效应曲线Fig.2 The time-effect responses of GSH content in coelomic fluid of Hemicentrotus pulcherrimus
2.4 0号柴油分散液对马粪海胆生殖腺GSH含量的影响
0号柴油分散液对海胆生殖腺GSH含量影响实验结果如图3所示。暴露1d时,低、中、高质量浓度组GSH含量均有所上升,且上升幅度与分散液浓度呈线性关系,组间差异较大;低质量浓度组GSH含量在暴露5d时继续上升且到达峰值,在9、13d时GSH含量持续下降;中质量浓度组在暴露1d时GSH含量即达到最大值,并在5、9、13d时依次下降;高质量浓度组所呈现趋势与中质量浓度组基本一致,即GSH含量在1d时达到最大值,并在此后呈现下降趋势。由实验结果可知,3个质量浓度组生殖腺中GSH含量随时间延长,呈现先升高后降低的趋势,时间-效应关系明显。当24d完成恢复实验时,3个质量浓度组之间GSH含量已趋于一致。
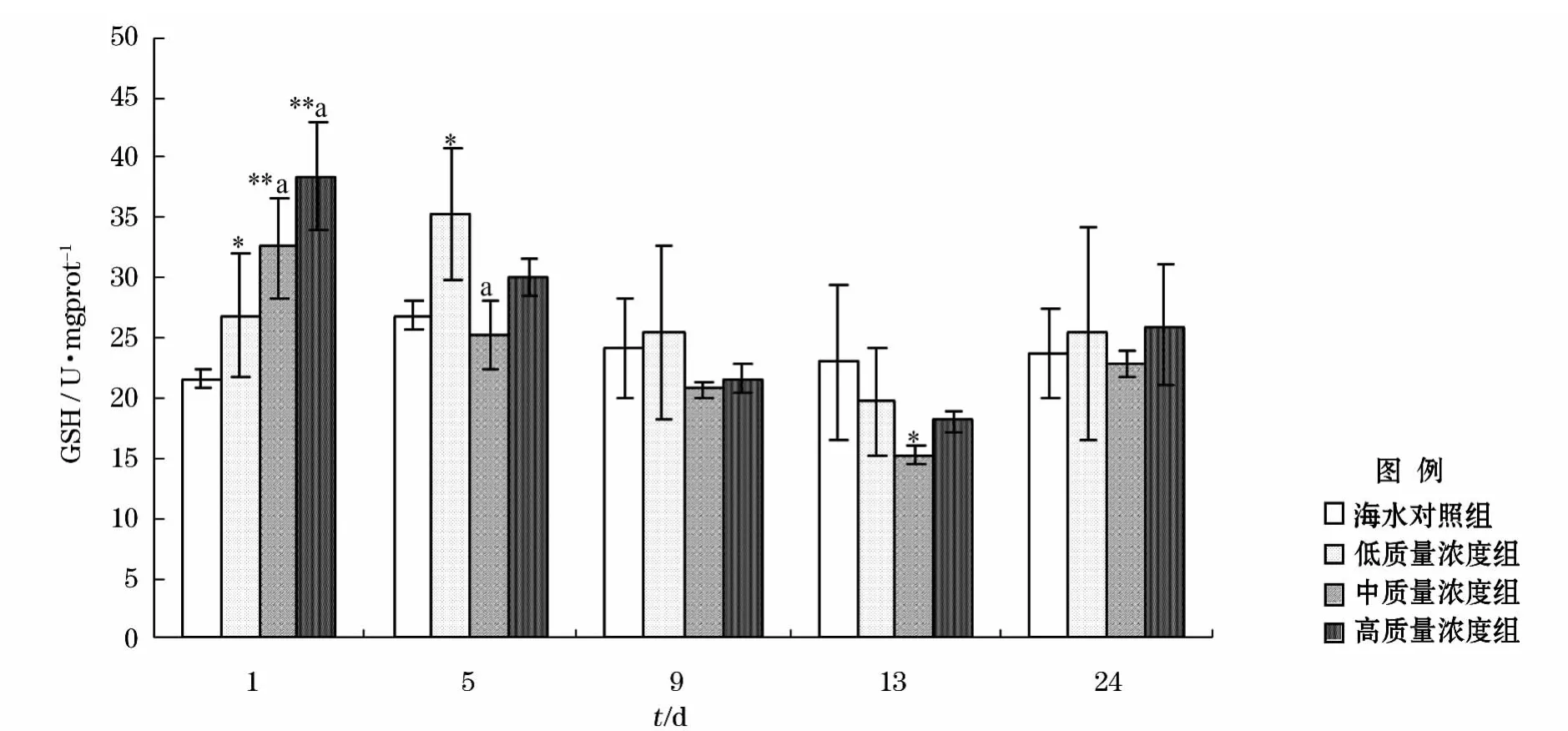
图3 0号柴油分散液影响马粪海胆生殖腺GSH含量的时间-效应曲线Fig.3 The time-effect responses of GSH content in gonad of Hemicentrotus pulcherrimus
2.5 0号柴油分散液暴露下GSH含量的变化规律比较
为了直观地说明0号柴油分散液对马粪海胆GSH含量的影响,将暴露期间海胆体内GSH含量变化情况列于表2中。
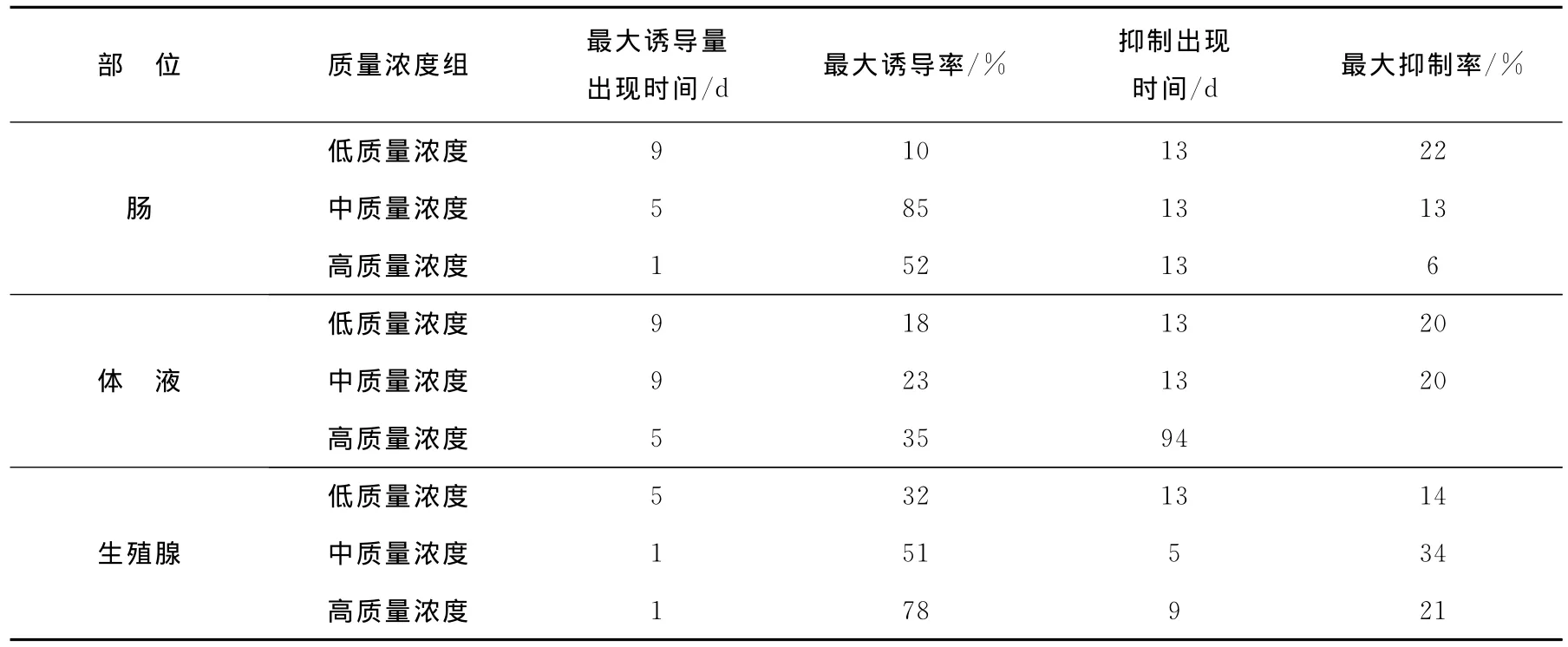
表2 不同质量浓度0号柴油分散液对GSH含量影响比较Table 2 Effects of concentration of WAFs on GSH content
由表2可见:
1)当海胆暴露于0号柴油分散液后,体内GSH含量会发生明显变化:GSH作为生物体内一种重要的抗氧化剂,可以有效地清除体内过多的活性氧。结合GSH含量的变化可知:暴露初期,海胆受到石油烃胁迫后,体内活性氧含量增加,使机体处于氧化应激状态,从而产生适应性诱导反应,导致GSH含量上升。随着时间的延长,当石油烃持续作用产生的氧化胁迫超出了机体适应性反应的抵御能力时,会使生物体产生中毒反应,进而抑制GSH的合成,导致体内GSH含量降低。
GSH最大诱导量的高低与暴露时间的长短及柴油分散液质量浓度有关。实验前期各组织中GSH含量基本呈现上升趋势。说明在暴露前期GSH含量会受分散液影响,诱导其合成,且最大诱导量随分散液质量浓度升高呈现上升趋势。这与陈荣等[29]所研究的石油暴露对僧帽牡蛎谷胱甘肽含量的影响的实验结果相一致。随着暴露时间延长,GSH受毒性作用影响合成受到抑制,其含量开始下降,且中低质量浓度组抑制率普遍较高浓度组高。Richardson等[30]研究多环芳烃暴露下的贻贝体内GSH含量的变化、郑微云等[31]及罗朝晖等[32]分别研究0号柴油水溶性成分对真鲷、褐菖鲉脏器组织中GSH含量的影响、Cheung等[33]研究苯并[a]芘暴露对贻贝的GSH含量的影响,都得到了相似的结论。
2)马粪海胆在正常生理条件下,体内GSH含量存在组织差异性,这与不同组织的生理结构和功能有关。其中体液中GSH的含量高于组织,而组织中GSH含量的大小顺序为肠>生殖腺。通过比较暴露实验数据可知:在受到诱导时,组织中GSH变化量的大小表现为组织>体液,而在组织中肠的变化量>生殖腺。这可能是由于海胆体内GSH主要来源是肠,而体液中的GSH则是外源性的。
高质量浓度组GSH最大诱导量出现时间早于低质量浓度组,是由于高质量浓度污染产生的诱导信号较强,由此海胆的适应性诱导反应较中、低质量浓度组更为显著。结合Steadman等[34]及汪美珍等[35]分别对虹鳟鱼和黑斑蛙的研究结果,发现较低质量浓度下,在未被诱导合成的污染初期,GSH作为抗氧化剂被大量消耗,而诱导在时间上又有一定的滞后性,因此GSH含量变化表现出诱导期的延后。
3 结 论
本文研究了0号柴油分散液对马粪海胆体内各组织中GSH含量的影响,得到如下结论:
(1)海胆暴露后各组织中GSH含量随暴露时间的延长呈现先诱导后抑制的趋势。说明机体既可在石油烃暴露下产生适应性诱导反应(GSH含量上升),也可由于其毒性作用而产生中毒反应,导致GSH含量下降。
(2)GSH最大诱导量出现的时间随分散液质量浓度的降低而有所延后。分散液质量浓度与最大诱导量呈现正相关关系,而与抑制率呈现负相关关系。
(3)马粪海胆体内GSH含量在暴露前后都呈现出组织差异性,表现为暴露前体液>肠>生殖腺,而当GSH受到诱导时,其变化量则表现为肠>生殖腺>体液。
(4)0号柴油分散液暴露后,海胆体内GSH含量变化的剂量-效应和时间-效应关系显著。证明GSH含量对石油烃暴露较为敏感,适合作为监测石油烃污染的生物标志物。
(References):
[1] KO J Y,DAY J W.A review of ecological impacts of oil and gas development on coastal ecosystems in the Mississippi Delta[J].Ocean &Coastal Management,2004,47(11-12):597-623.
[2] TIAN L J,ZHANG R A.The effect of offshore oil pollution on marine ecological environment[J].Transactions of Oceanology and Limnology,1999,23(2):15-19.田立杰,张瑞安.海洋油污染对海洋生态环境的影响[J].海洋湖沼通报,1999,23(2):15-19.
[3] JIA X P,LIN Q,CAI W G,et al.Toxicity of crude oil and fuel oils to important mariculture and multiplication organisms of South China Sea[J].Journal of Fisheries of China,1999,24(1):32-36.贾晓平,林钦,蔡文贵,等.原油和燃油对南海重要海水增养殖生物的急性毒性试验[J].水产学报,1999,24(1):32-36.
[4] WANG X W,LI C H,SHEN N N.Effect of oil pollution on marine organism[J].South China Fisheries Science,2006,2(2):76-80.王晓伟,李纯厚,沈南南.石油污染对海洋生物的影响[J].南方水产,2006,2(2):76-80.
[5] CUI Y,CHEN B J,SONG Y L,et al.The influence of oil pollutants along coast of Huanghua,Hebei province on the petroleum hydrocarbon contents in the marine organisms[J].Journal of Oceanography of Huanghai &Bohai Seas,2000,18(2):66-71.崔毅,陈碧鹃,宋云利,等.河北黄骅近岸石油污染对海洋生物体内石油烃含量的影响[J].黄渤海海洋,2000,18(2):66-71.
[6] ZHANG W H,WANG J T,TAN L J.Petroleum pollution condition in seawater and animals offshore southern Shandong peninsula[J].Marine Environmental Science,2010,29(3):378-380.张文浩,王江涛,谭丽菊.山东半岛南部近海海水及动物石油烃污染状况[J].海洋环境科学,2010,29(3):378-380.
[7] WU H Q,HU J X,FANG K,et al.The influence of the offshore oil exploration and exploitation on marine organisms and the prevention countermeasures[J].China Water Transport,2011,11(3):131-132.吴慧琴,胡家项,方昆,等.海洋石油勘探开发对海洋生物的影响及防治对策[J].中国水运,2011,11(3):131-132.
[8] PÉREZ-CADAHÍA B,LAFUENTE A,CABALEIRO T,et al.Initial study on the effects of Prestige oil on human health[J].Environment International,2007,33(2):176-185.
[9] PÉREZ-CADAHÍA B,LAFFON B,PÁSARO E,et al.Genetic damage induced by accidental environmental pollutants[J].The Scientific World Journal,2006,6:1221-1237.
[10] ZOCK J P,RODRÍGUEZ-TRIGO G,POZO-RODRÍGUEZ F,et al.Prolonged respiratory symptoms in clean-up workers of the prestige oil spill[J].American Journal of Respiratory and Critical Care Medicine,2007,176:610-616.
[11] LEE J,KIM M,HA M,et al.Urinary metabolic profiling of volatile organic compounds in acute exposed volunteers after an oil spill in Republic of Korea[J].Biomedical Chromatography,2010,24(5):562-568.
[12] XIONG D Q,GANG M,LV F R.Effects of No.0diesel oil dispersion liquid on CAT activity ofHemicentrotuspulcherrimus[J].Journal of Dalian Maritime University,2010,36(3):112-115.熊德琪,刚锰,吕福荣.0#柴油分散液对马粪海胆CAT活性的影响[J].大连海事大学学报,2010,36(3):112-115.
[13] LU G C,WANG C,ZHU Z.The dose-response relationships for EROD and GST induced by polyaromatic hydrocarbons inCarassiusauratus[J].Bulletin of Environmental Contamination and Toxicology,2009,82(2):194.
[14] LIU R Z,ZHENG R H,WANG C G.Effects of benzo(a)pyrene,tributyltin and their mixture on activities of phenoloxidase inSebastiscusmarmoratus[J].Marine Environmental Science,2007,26(4):305-308.刘睿智,郑榕辉,王重刚.苯并(a)芘、三丁基锡及其混合物对褐菖鲉酚氧化酶活力的影响[J].海洋环境科学,2007,26(4):305-308.
[15] SHI Q F,CAO W R.The overview on superoxide dismutase(SOD)[J].Livestock and Poultry Industry,2009,(4):66-68.时沁峰,曹威荣.超氧化物歧化酶(SOD)的研究概况[J].畜禽业,2009,(4):66-68.
[16] MIDDAUGH D P,CHAMPMAN P J,SHELTEM M E.Responses of embryonic and larval inland silversides,Menidiaberyllina,to a water-soluble friction formed during biodegradation of artificially weathered Alaska North Slope crude oil[J].Archives of Environmental Contamination and Toxicology,1996,31:410-419.
[17] WANG J L,LIU C G,FENG J F,et al.Literature review of the effects of petroleum hydrocarbons on marinePhytoplankton[J].Environmental Pollution and Control,2011,33(4):81-86.王君丽,刘春光,冯剑丰,等.石油烃对海洋浮游植物生长的影响研究进展[J].环境污染与防治,2011,33(4):81-86.
[18] HUANG Y J,JIANG Z B,ZENG J N,et al.Short-term toxic effects of crude oil pollution on marinePhytoplanktoncommunity[J].Chinese Journal of Plant Ecology,2010,34(9):1095–1106.黄逸君,江志兵,曾江宁,等.石油烃污染对海洋浮游植物群落的短期毒性效应[J].植物生态学报,2010,34(9):1095–1106.
[19] GAN J L,JIA X P.The region distribution and its main reasons on petroleum hydrocarbons in marine fish from northern South China Sea[J].Journal of Zhanjiang Ocean University,1998,18(1):29-32.甘居利,贾晓平.南海北部鱼类石油烃含量地理差异原因浅析[J].湛江海洋大学学报,1998,18(1):29-32.
[20] SONG Y L,SUN Y.Determination of petroleum hydrocarbons in shellfish body with capillary gas chromatography[J].Marine Fisheries Research,1997,18(1):67-72.宋云利,孙耀.毛细管气相色谱法测定海洋贝类体内的石油烃[J].海洋水产研究,1997,18(1):67-72.
[21] WEN Z Z.Investigation of petroleum hydrocarbon concentration in the shellfishes from the main shellfish culture areas in the middle and east of Fujian coastal areas[J].Journal of Fujian fisheries,2005,2:28-32.翁蓁洲.福建中、东部沿海主要养殖贝类体内石油烃含量调查分析[J].福建水产,2005,2:28-32.
[22] THOMAS R E,LINDEBERG M,HARRIS P M,et al.Induction of DNA strand breaks in the mussel(Mytilustrossulus)and clam(Protothacastaminea)following chronic field exposure to polycyclic aromatic hydrocarbons from the Exxon Valdez spill[J].Marine Pollution Bulletin,2007,54(6):726-732.
[23] HELLOU J,LEONARD J,COLLIER T K,et al.Assessing PAH exposure in feral finfish from the Northwest Atlantic[J].Marine Pollution Bulletin,2006,52(4):433-441.
[24] MARTÍNEZ-GÓMEZ C,FERNÁNDEZ B,VALDÉS J A,et al.Evaluation of three-year monitoring with biomarkers in fish following thePrestigeoil spill(N Spain)[J].Chemosphere,2009,74(5):613-620.
[25] SUN Y M,LIU H L.The chemical pollutants and their harms in the ocean[J].Chemical Education,2001,7~8:1-4.孙云明,刘会峦.海洋中的主要化学污染物及其危害[J].化学教育,2001,7~8:1-4.
[26] ANDERSON J W,NEFF J M,COX B A.Characteristics of dispersions and water-soluble extracts of crude oil and refined oils and their toxicity to estuarine crustaceans and fish[J].Marine Biology,1974,27:75-78.
[27] TATEM H E,COX B A,ANDERSON J W.The toxicity of oil and petroleum hydrocarbons to estuarine crustaceans[J].Estuarine Coastal Marine Science,1978,6(3):365-373.
[28] JIA X P,LIN Q.Toxicity of Nanhai crude oil and fuel oils to larval shrimps and larval fishes[J].Tropic Oceanology,1998,17(1):93-98.贾晓平,林钦.南海原油和燃料油对仔虾和仔鱼的急性毒性试验[J].热带海洋学报,1998,17(1):93-98.
[29] CHEN R,ZHENG W Y,YU Q,et al.Effect of oil pollution on glutathione and relative enzyme in oyster(Saccostreacucullata)[J].Acta Oceanologica Sinica,2003,25(2):226-230.陈荣,郑微云,余群,等.石油污染对僧帽牡蛎谷胱甘肽含量及相关酶活性的影响[J].海洋学报,2003,25(2):226-230.
[30] RICHARDSON B J,MAK E,DE LUCA-ABBOTT S B,et al.Antioxidant responses to polycyclic aromatic hydrocarbons and organochlorine pesticides in green-lipped mussels(Pernaviridis):do mussels"integrate"biomarker responses?[J].Marine Pollutution Bulletin.2008,57(6-12):503-514.
[31] ZHENG W Y,WENG Y,YU Q,et al.Effects of water soluble fraction of NO.0diesel oil on content of reduced glutathione in visceral tissues ofPagrosomusmajor larvae[J].Journal of Fisheries of China,1999,23:64-68.郑微云,翁妍,余群,等.0号柴油水溶性成分对真鲷幼体脏器组织中还原型谷胱甘肽含量的影响[J].水产学报,1999,23:64-68.
[32] LUO C H.Study on effects of No.0diesel oil water-soluble fraction on antioxidant defense systems in liver,spleen and kidney ofSebastiscusmarmoratus[D].Fujian:Xiamen University,2008.罗朝晖.0号柴油水溶性成分对褐菖鲉肝脏、脾脏和肾脏抗氧化防御系统影响的研究[D].福建:厦门大学,2008.
[33] CHEUNG C C,SIU W H,RICHARDSON B J,et al.Antioxidant responses to benzo[a]pyrene and Aroclor1254exposure in the greenlipped mussels,Pernaviridis[J].Environment Pollutution.2004,128(3):393-403.
[34] STEADMAN B L,FARAG A M,BERGMAN H L.Exposure-related patterns of biochemical indicators in rainbow trout exposed to No.2fuel oil[J].Environmental Toxicology and Chemistry,1991,10(3):365-374.
[35] WANG M Z,JIA X Y,DONG A H,et al.Effects of Cadmium on oxidative stress and antioxidative ability in the Frog(Rananigromaculata)under a long-term exposure[J].Acta Ecologica Sinica,2006,26(6):1718-1724.汪美贞,贾秀英,董爱华,等.镉长期暴露对黑斑蛙的氧化胁迫和抗氧化能力的影响[J].生态学报,2006,26(6):1718-1724.
