短串联重复序列基因座与肺癌发病风险的相关性研究
2014-09-28刘小龙黄海嵘刘灿辉
张 雷,强 勇,刘小龙,黄海嵘,刘灿辉,申 翼
0 引 言
肺癌是最常见且预后较差的恶性肿瘤之一,5年生存率低于15%[1],是我国发病率、死亡率最高的恶性肿瘤[2-3]。研究和阐明肺癌的发生机制、寻找新的早期诊断指标以降低其发病率非常重要[4-5]。目前许多相关研究都致力于寻找与肺癌发生机制相关的易感因素或抗性因素,特别是在流行病学方面已开展了广泛的研究,并取得了显著的进展。近年来,国内外学者已针对肺癌与 P450[6]、XRCC4[7]、M1[8]、HLA[9]、HSP70[10]、溶酶体相关 4次跨膜蛋白质 β 基因[11]、N-乙酰基转移酶基因[12]、血管内皮生长因子基因[13]等基因多态性之间的关系进行了大量研究。虽然研究范围很广泛,但肺癌的发生机制仍未明确,促使我们寻找更多新的遗传标记作为研究手段,例如在群体遗传学研究中应用最为广泛的短串联重复序列(short tandem repeat,STR)在肿瘤发病机制方面的应用仍处于起步阶段。已有原发性胃腺癌[14]、食管癌[15]与STR 基因座相关性的研究报道,但在肺癌的发病风险方面报道不多。
本研究将 D8S1179、D21S11、D7S820、CSF1PO、D3S1358、TH01、D13S317、D16S539、D2S1338、D19S433、vWA、TPOX、D18S51、D5S818、FGA 共 15 个 STR 基因座应用于肺癌发病风险的研究,通过病例组与对照组在15个STR基因座的等位基因频率分布的差异性来推断与肺癌发生相关的易感因素或抗性因素,为肺癌发生机制的研究提供一种新的途径。
1 资料与方法
1.1 标本来源 病例组为2010年至2012年在我院门诊就诊及住院治疗、经病理切片证实、且取材前均未经放射或者化学治疗的120例肺癌患者,其中鳞癌63例,腺癌57例,年龄43~71岁,平均年龄(56.9±10.4)岁。对照组为南京及其周边地区156例健康个体(经细胞学检查证实无异常,无肺癌及癌前病变,同时排除其他遗传疾病),所有研究对象均知情同意本项研究。分别采集病例组与对照组的外周静脉血作为标本,置于-80℃冰箱内保存。
1.2 主要仪器和试剂 鼎永4800型扩增仪、Gene-Amp PCR System 9700扩增仪、ABI PRISM 3130XL遗传分析仪、5%Chelex-100、Identifiler Plus®试剂盒。
1.3 方法
1.3.1 基因组DNA提取 参照 Walsh等[16]的方法,用5%Chelex-100提取病例组和对照组标本的基因组DNA。
1.3.2 PCR扩增 PCR试剂盒由美国Life Technologies公司提供。在同一反应管中对15个基因座进行复合扩增。反应体系为10 μL,其中 Mix预混液4μL,Primer set 2μL,dH2O 3μL,DNA 模板1μL。扩增条件:95℃预变性11 min,然后94℃变性20 s,59℃退火3 min,共28个循环,最后60℃延伸10min,4℃备用。
1.3.3 扩增产物的电泳与检测 采用ABI 3130XL遗传分析仪对扩增产物进行自动毛细管电泳,Data Collection 2.1软件收集电泳数据,GeneMapperID v3.2软件分析扩增产物片段长度并对等位基因进行分型命名。
1.4 统计学分析 应用Powerstats软件(http://www.promega.com/geneticidtools/powerstats)计算病例组和对照组在15个STR基因座上的等位基因频率和基因型频率,并对病例组和对照组在15个STR基因座的基因型分布进行Hardy-Weinberg平衡检验。同时计算杂和度(heterozygosity,H)、多态信息含量(polymorphism information contents,PIC)、个体识别能力(power of discrimination,PD)、非父排除率(power of exclusion,PE)等多态性统计学指标。采用SPSS 13.0软件对每个基因座上的等位基因频率分布进行统计分析,以P≤0.05为差异有统计学意义,以OR及其95%CI表示相对风险度,OR大于1为有易感倾向,OR小于1为有抗性倾向[17]。
2 结 果
病例组与对照组之间在性别、吸烟状况差异有统计学意义(P<0.05),在饮酒状况上差异无统计学意义(P>0.05),见表1。病例组与对照组在15个STR基因座的基因型频率分布差异均无统计学意义(P >0.05),符合 Hardy-Weinberg平衡定律,见表 2。病例组与对照组在 CSF1PO、D19S433、D3S1358基因座的等位基因10、15.2、16差异有统计学意义(P < 0.05),OR 值分别为 1.482、1.673、1.467,均大于 1,见表 3。病例组与对照组在CSF1PO、D19S433 基因座的等位基因14、14.2 差异有统计学意义(P<0.05),OR值分别为0.126和0.476,见表3。
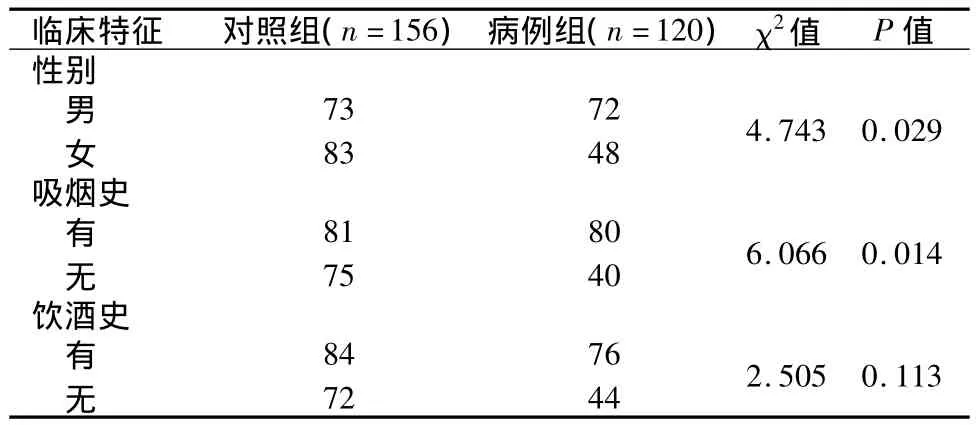
表1 肺癌患者组与对照组的临床特征Table 1 Clinical characteristics of the lung cancer patients and normal controls
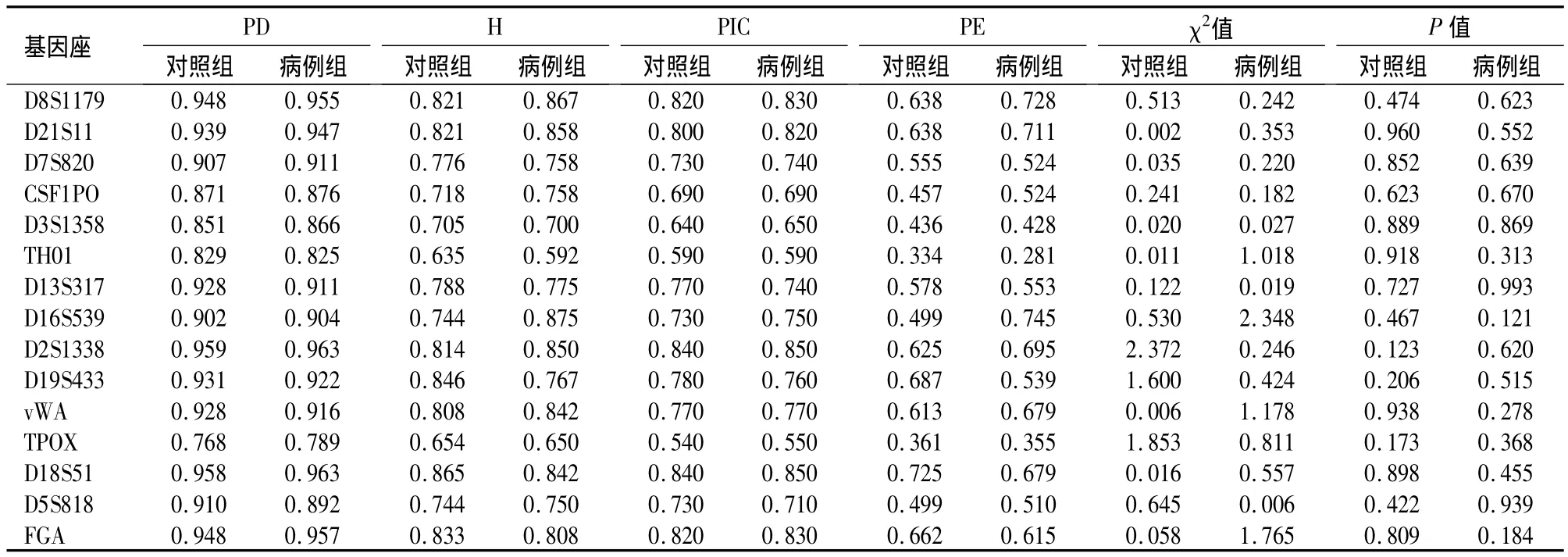
表2 肺癌患者组与对照组STR基因座的多态性统计学指标Table 2 Statistical indicators of the polymorphisms of the 15 STR loci in the lung cancer patients and normal controls
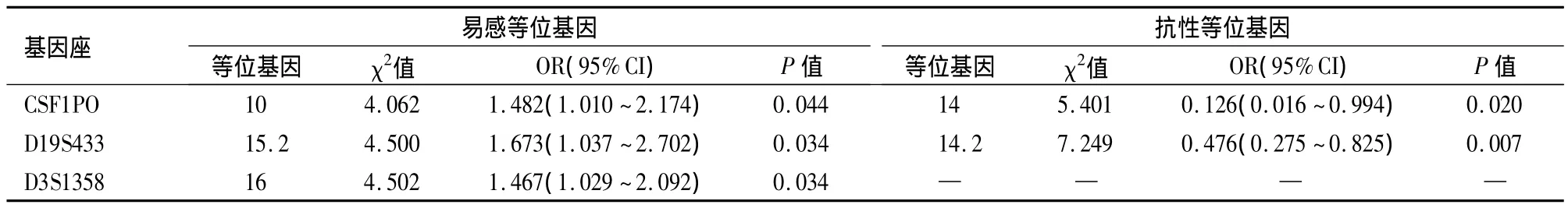
表3 肺癌患者组与对照组的肺癌发生相关易感等位基因和抗性等位基因统计学分析Table 3 Statistical analysis on lung cancer-related susceptive and resistant alleles in the lung cancer patients and normal controls
3 讨 论
肿瘤的发生是遗传因素和环境因素共同作用的结果。吴建中等[18]的研究表明影响贲门癌发生发展的环境因素目前主要有吸烟、饮酒、饮茶等。而p53基因多态性则被证实与贲门癌的发生具有相关性[19]。一般我们认为环境因素是肿瘤发生的始动因素,而个体的遗传特征如肿瘤易感基因则决定其对肿瘤的易感性。肿瘤易感基因虽然不直接导致肿瘤发生,但可以影响癌基因和(或)抑癌基因的突变率[20],从而影响个体对肿瘤的易感性。此类改变一般表现为个体某个基因在群体中的出现频率上,因此对肿瘤的发病风险进行分子生物学研究时可以发生高频改变的基因为出发点来比较肿瘤患者与健康人群在基因频率上的差异。虽然目前的研究范围很广泛,但肿瘤的发生机制仍未明确,促使我们寻找更多新的遗传标记作为研究手段,例如群体遗传学研究中应用最为广泛的STR基因座,其在人类基因组中广泛存在,多态性丰富,且位于非编码区,是分子生物学研究理想的遗传标记[21],可用于基因作图、定位克隆、疾病发生机制的关联分析[22]。本研究中选取的15个STR基因座随机分布在13条不同的染色体上,有利于随机筛选,且突变率低,对照组与病例组在15个STR基因座上的基因型分布均符合Hardy-Weinberg平衡定律。对照组在15个STR基因座的PD值介于0.768与0.959之间,PE值介于0.334与0.725 之间,PIC 值介于 0.540 与 0.840 之间,H值介于0.635与0.865之间,群体内遗传差异大,上述结果说明本研究选取的病例组与对照组均具有群体代表性。
由于STR基因座的等位基因频率与人种、民族的遗传背景关系明显,因此在进行病例-对照研究前需先建立本地区健康人群在选取的STR基因座上的等位基因频率分布数据,进而根据肿瘤患者与健康人群在上述STR基因座的等位基因频率是否存在显著性差异,筛选出与肿瘤发病风险相关的易感因素或者抗性因素。否则,结果就会出现偏差。Climent等[23]研究了HLA-DRB1等位基因多态性与宫颈癌的关系,结果显示等位基因15是与宫颈癌发病风险相关的抗性因素。而在辽宁地区的宫颈癌患者中,等位基因15则是易感因素[24],结论正好与Climent等[23]研究相反。
本研究首先采集南京地区健康个体的外周静脉血样作为对照组,并对其进行STR分型,获得等位基因频率与基因型频率,以此作为基础数据,再根据病例组与对照组中相关等位基因的出现频率是否存在显著性差异,从中筛选出与肺癌易感性或抗性相关的等位基因[25],并用优势比(odds ratio)来近似的估计肺癌发生的相对危险度,即携带有特定等位基因的人与不携带此等位基因的人患有肺癌风险的比值。实验结果显示,病例组与对照组在CSF1PO、D19S433、D3S1358 基因座的等位基因 10、15.2、16之间的频率分布差异均有统计学意义(P=0.044、0.034、0.034,OR=1.482、1.673、1.467)。例如CSF1PO基因座等位基因10的OR值为1.482,说明携带此等位基因的个体患肺癌的风险是未携带此等位基因的个体的1.482倍,由此可以认为CSF1PO基因座等位基因10可能是与肺癌发生相关的易感因素,其附近可能存在与肺癌发生相关的易感基因。结果同时显示,病例组与对照组在 CSF1PO、D19S433基因座的等位基因14、14.2之间的频率分布差异均有统计学意义(P=0.020、0.007,OR=0.120、0.476)。例如CSF1PO基因座的等位基因14的OR值为0.126,说明携带此等位基因的个体患肺癌的风险是未携带此等位基因的个体的0.126倍,由此可以认为CSF1PO基因座等位基因14可能是与肺癌发生相关的抗性因素,其附近可能存在与肺癌发生相关的保护基因。
本研究中用于估计病因大小或暴露与疾病之间关联强度的OR值的95%可信区间值均不包括1,说明病例组与对照组的差异有统计学意义[26],反映了STR基因座应用于肿瘤发病风险研究的可行性。
本研究首次应用STR基因座对与肺癌发生相关的易感因素和抗性因素进行了初步研究。结果显示,肺癌的发生是易感因素与抗性因素协同作用的结果。CSF1PO、D19S433、D3S1358基因座等位基因10、15.2、16是与肺癌发生相关的易感因素,可以加大肺癌的患病风险。CSF1PO、D19S433基因座等位基因14、14.2是与肺癌发生相关的抗性因素,可以降低肺癌的患病风险。另外,在本研究中尚未发现病例组与对照组在其他12个STR基因座的等位基因分布有显著性差异,因此还需要在以后进行大样本、多地域、多民族广泛深入的协同研究,探寻更多可能与肺癌发生相关联的STR基因座,为进一步深入探索肺癌的发生机制提供新的途径。
[1]Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2]张思维,陈万青,雷正龙,等.中国肿瘤登记处2004年恶性肿瘤发病资料分析[J].中国肿瘤,2008,17(11):909-912.
[3]陈万青,张思维,孔灵芝,等.中国肿瘤登记处2004年恶性肿瘤死亡资料分析[J].中国肿瘤,2008,17(11):913-916.
[4]Shen H,Spitz MR,Qiao Y,et al.Smoking,DNA repair capacity and risk of nonsmall cell lung cancer[J].Int J Cancer,2003,107(1):84-88.
[5]许德兵,宋 勇.分子生物标志物在肺癌早期诊断中的研究进展[J].医学研究生学报,2013,26(7):766-770.
[6]Bartsch H,Nair U,Risch A,et al.Genetic polymorphism of CYP genes,alone or in combination,as a risk modifier of tobacco-related cancers[J].Cancer Epidemiol Biomarkers Prev,2000,9(1):23-28.
[7]Hsu NY,Wang HC,Wang CH,et al.Lung cancer susceptibility and genetic polymorphism of DNA repair gene XRCC4 in Taiwan[J].Cancer Biomark,2009,5(4):159-165.
[8]Ford JG,Li Y,O'Sullivan MM,et al.Glutathione S-transferase M1 polymorphism and lung cancer risk in African-Americans[J].Carcinogenesis,2000,21(11):1971-1975.
[9]Tokumoto H.Analysis of HLA-DRB1-related alleles in Japanese patients with lung cancer--relationship to genetic susceptibility and resistance to lung cancer[J].J Cancer Res Clin Oncol,1998,124(9):511-516.
[10]Suzuki K,Ito Y,Wakai K,et al.Serum heat shock protein 70 levels and lung cancer risk:a case-control study nested in a large cohort study[J].Cancer Epidemiol Biomarkers Prev,2006,15(9):1733-1737.
[11]李昌林,周清华,王艳萍,等.LAPTM4B基因多态性与肺癌易感性的关系[J].中国肺癌杂志,2006,9(2):109-112.
[12]Hou SM,Ryberg D,Falt S,et al.GSTM1 and NAT2 polymorphisms in operable and non-operable lung cancer patients[J].Carcinogenesis,2000,21(1):49-54.
[13]Lee SJ,Lee SY,Jeon HS,et al.Vascular endothelial growth factor gene polymorphisms and risk of primary lung cancer[J].Cancer Epidemiol Biomarkers Prev,2005,14(3):571-575.
[14]游 攀,黄如欣,倪宏英,等.15个短串联重复序列基因座基因频率在原发性胃腺癌患者和正常人群间分布的比较[J].中华检验医学杂志,2006,29(12):1137-1140.
[15]张 雷,强 勇,易 俊,等.微卫星序列不稳定性与食管癌发病风险的相关性研究[J].医学研究生学报,2013,26(10):1056-1060.
[16]Walsh PS,Metzger DA,Higuchi R.Chelex 100 as a medium for simple extraction of DNA for PCR-based typing from forensic material[J].Biotechniques,1991,10(4):506-513.
[17]Maki P,Veijola J,Joukamaa M,et al.Maternal separation at birth and schizophrenia--a long-term follow-up of the Finnish Christmas Seal Home Children[J].Schizophr Res,2003,60(1):13-19.
[18]吴建中,高长明,丁建华,等.亚甲基四氢叶酸还原酶基因C677T多态性、生活习惯与贲门癌易感性的关系[J].中国肿瘤,2004,13(5):273-276.
[19]Casson AG,Evans SC,Gillis A,et al.Clinical implications of p53 tumor suppressor gene mutation and protein expression in esophageal adenocarcinomas:results of a ten-year prospective study[J].J Thorac Cardiovasc Surg,2003,125(5):1121-1131.
[20]Poulsen HE,Loft S,Wassermann K.Cancer risk related to genetic polymorphisms in carcinogen metabolism and DNA repair[J].Pharmacol Toxicol,1993,72(Suppl 1):93-103.
[21]吕德坚,陈惠玲.DNA亲权鉴定[M].广州:暨南大学出版社,2005:94-114.
[22]Koreth J,O'Leary JJ,O'D MJ.Microsatellites and PCR genomic analysis[J].J Pathol,1996,178(3):239-248.
[23]Climent C,Nazario CM,Umpierre S,et al.Major histocompatibility complex class II polymorphisms and risk of cervical cancer in Puerto Rican women[J].P R Health Sci J,2007,26(2):97-101.
[24]杜 洋,董玉贞,王慧敏,等.辽宁地区妇女宫颈癌与人类白细胞抗原DRB1—15等位基因的关系[J].中外妇儿健康,2011,6:63-64.
[25]Shriver MD,Jin L,Boerwinkle E,et al.A novel measure of genetic distance for highly polymorphic tandem repeat loci[J].Mol Biol Evol,1995,12(5):914-920.
[26]王家良.循证医学[M].北京:人民卫生出版社,2010:37-45.
