MicroRNA-10b对人低转移肺癌细胞株95-C增殖和侵袭的作用及其机制的研究
2014-09-28李明慧张国庆庞作良郭文佳
刘 翼,李明慧,张国庆,庞作良,郭文佳
0 引 言
目前研究表明,微小RNA(microRNA,miRNA)在肿瘤的发生发展侵袭转移过程中起着重要作用[1]。miRNA已成为调节基因表达的关键分子之一,它几乎涉及肺癌癌变的每一个进程,包括其进展、血管新生、侵袭和转移[2-3]。最近有一项调查研究表明,与良性肿瘤患者相比,肺癌患者中miRNA-10b、miRNA-141和miRNA-155的水平明显升高,血清中miRNA-10b的高表达和淋巴结转移有关[4]。本研究通过转染表达miRNA-10b质粒进入人低转移肺癌细胞株95-C,观察miRNA-10b对人肺癌生物学行为的影响,并研究其可能的作用机制。
1 材料与方法
1.1 细胞系和主要试剂 人低转移肺癌细胞株95-C购于中国典型培养物保藏中心(CCTCC);胎牛血清购于美国Gibco公司;RPMI-1640培养基购于美国Hyclone公司,miRNA-10b真核表达质粒由纽恩(上海)生物科技有限公司合成;脂质体转染试剂Lipofectamine TM2000及TRIzol试剂购于美国Invitrogen公司;SYBRGreen PCR试剂盒购于美国Thermo公司;CCK-8购于日本同仁化学研究所;Transwell小室购于康宁生命科学有限公司;KLF4抗体购于Abcam公司,GAPDH购于Fermentas公司。
1.1.1 细胞培养 将95-C置于10%胎牛血清的DMEM高糖培养液,于37℃、5%CO2的培养箱中培养。
1.1.2 细胞转染 取对数生长期细胞接种于6孔板,设置为3个组,分别是:空白对照组(未转染);阴性对照组[空载体转染(NC序列:TTCTCCGAACGTGTCACGT)];miRNA-10b质粒转染组。采用脂质体lipofectamineTM 2000(Invitrogen)转染siRNA,具体操作步骤如下:转染前1 d接种细胞,使其到转染时能够达到30%~50%的密度,培养过夜;250 μL改良型必需基本培养基(opti-MEM)中加入5 μL lipofectamineTM 2000,室温静置5 min;250 μL opti-MEM 中加入5μL的siRNA;将上述两者混合后室温放置20 min备用;将细胞培养液吸去,换成无血清、无抗生素的培养液,然后加入500 μL脂质体和siRNA的转染混合液,混匀;37℃,5%CO2培养4~6 h后换成正常培养液(含10%FBS、PS)。转染后24h荧光显微镜下根据绿色荧光蛋白的表达观察转染效率。
1.2 RT-PCR检测细胞 miRNA-10b的表达及KLF4 mRNA的表达 转染后48 h收集各组细胞,按TaqManmicroRNA Isolation Kit说明书提取细胞总RNA,用分光光度计定量检测。RNA样品用逆转录反应合成cDNA后,用SYBRGreen PCR试剂盒检测样本中miRNA-10b含量。采用的特异性引物序列:miRNA-10b上游引物:5'GGATACCCTGTAGAACCGAA3',下游引物5'CAGTGCGTGTCGTGGAGT3';内参U6 上游引物:5'TGGGGTTATACATTGTGAGAGGA3',下游引物:5'GTGTGCTACGGAGTTCAGAGGTT3';KLF4 mRNA上游引物:5'AAGAATCCAAACCCAAGC3',下游引物5'CGAATTTCCAGCCACATC 3';内参GAPDH上游引物:5'TCTGATTTGGTCGTATTGGG 3',下游引物:5'GGAAGATGGTGATGGGATT 3'。反应条件为95℃ 10 min 预变性,95℃ 15 s,60℃ 45 s,40 个循环,反应结束后得到各个标本和内参U6及GAPDH的基本循环数(Ct值)。根据公式R=2-ΔΔCt,计算目的基因相对含量(RQ值),即为miRNA-10b和KLF4mRNA相对含量,实验重复3次。
1.3 细胞增殖实验检测细胞增殖情况 将每块板设置对空白对照组、阴性对照组和miRNA-10b质粒转染组,用胰蛋白酶消化处于对数生长期的细胞株,稀释细胞(1×104~5×104个/mL培养液),取100 μL至96孔培养板,每组分为24、48和72 h 3个时间点,按1∶10体积比混合无血清必需基本培养基DMEM和CCK-8,采用微板分光光度计测定450 nm波长吸光度。记录数值,并制作细胞生长曲线。
1.4 Transwell侵袭实验 实验前24h将不同分组的细胞换成无血清DMEM培养基,接种前将transwell小室和24孔板用1×PBS浸泡5 min,用无血清DMEM培养液洗涤细胞,接种到transwell小室内,0.5 mL细胞悬液加入每个小室,0.75 mL含10%FBS的DMEM培养液加入下层的24孔板中,每组3复孔,于37℃培养箱中培养48 h,固定,染色,transwell小室内没有迁移的细胞用棉签擦去,显微镜下观察,计数每个视野中的细胞数。
1.5 Western blot检测KLF4蛋白的表达 收集空白对照组、阴性对照组和miRNA-10b质粒转染组细胞,用RIPA裂解细胞,提取细胞总蛋白,95℃变性,蛋白定量,取20 μg蛋白经12%聚丙烯酰胺凝胶电泳,然后转移至硝酸纤维素膜上。KLF4一抗稀释倍数为1∶400,用增强化学发光显色系统显色,以GAPDH作为内参(稀释倍数1∶1500)。KLF4的相对表达量以KLF4与GAPDH灰度扫描值的比值表示,实验重复3次。
1.6 统计学分析 采用SPSS 19.0软件进行统计分析,定量资料用均数±标准差()表示,组间均数比较采用单因素方差分析,两两比较在方差齐时选择Student-Newman-Keuls检验,方差不齐时选择Games-Howell检验,以P≤0.05为差异有统计学意义。
2 结 果
2.1 转染后各组细胞miRNA-10b的表达 转染48 h后,RT-PCR检测3组miRNA-10b的RQ平均值,结果显示,miRNA-10b质粒转染组(1.61±0.12)的 miRNA-10b表达较空白对照组(1.01±0.08)、阴性对照组(0.86 ±0.07)明显上调,差异有统计学意义(P<0.05);而阴性对照组与空白对照组比较,差异无统计学意义(P>0.05)。
2.2 转染后各组细胞的增殖情况 生长曲线反映了各个时间点细胞的增殖情况,miRNA-10b质粒转染组细胞生长速度明显高于空白对照组和阴性对照组细胞,差异有统计学意义(P<0.05),空白对照组与阴性对照组比较差异无统计学意义(P>0.05)。见图1。
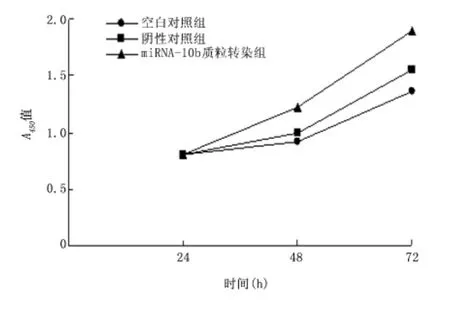
图1 miRNA-10b对人低转移肺癌细胞株95-C增殖的影响Figure 1 The effects of miRNA-10b on proliferation of 95-C cells
2.3 Transwell结果 miRNA-10b质粒转染组[(188.0 ±15.1)/高倍显微镜]明显较空白对照组[(151.0 ± 11.3)/高倍显微镜]、阴性对照 组[(136.0 ±10.8)/高倍显微镜]有更多的细胞迁移到Transwell膜的另一侧,差异有统计学意义(P<0.05),而空白对照组与阴性对照组差异无统计学意义(P >0.05)。见图2。
2.4 转染后各组细胞KLF4蛋白表达的变化 转染48 h后,Western blot检测各组细胞KLF4蛋白的表达的变化,结果显示:miRNA-10b质粒转染组KLF4蛋白表达(0.86 ±0.06)较空白对照组(1.48±0.05)和阴性对照组(1.54 ±0.08)降低,差异有统计学意义(P<0.05)。空白对照组、阳性对照组差异无统计学意义(P>0.05)。见图3。
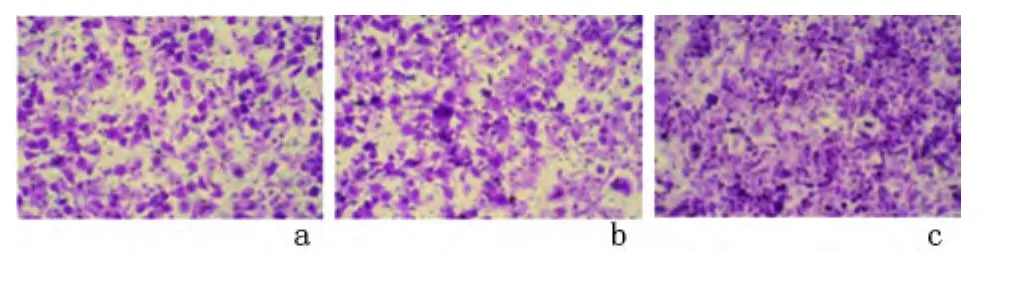
图2 Transwell实验检测过表达miRNA-10b对95-C侵袭能力的影响(×200)Figure 2 Invasive ability of 95-C over expressed miRNA-10b determined by Transwell(×200)
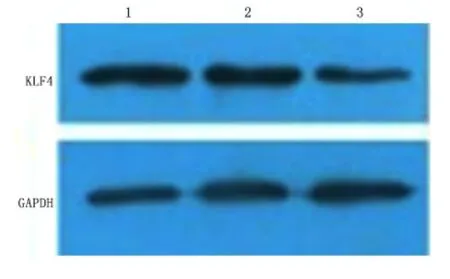
图3 转染后各组细胞KLF4的变化Figure 3 The expression of KLF4 protein in each group after transfection
2.5 转染后各组细胞KLF4mRNA的表达 转染48h后,RT-PCR检测3组miRNA-10b的RQ平均值,结果显示,miRNA-10b质粒转染组的KLF4mRNA的表达(0.59 ±0.04)较空白对照组(0.68 ±0.09)和阴性对照组(0.72±0.11)下调,但3组间差异无统计学意义(P >0.05)。
3 讨 论
MicroRNA长度大约为20~25nt,主要参与基因转录后水平的调控。动物尤其是人的miRNA的生物合成过程已经初步得到诠释,即miRNA基因首先在细胞核内合成初级转录产物,经Drosha切割后形成前体miRNA,转运到细胞质中经Dicer进一步切割产生成熟miRNA,成熟miRNA通过与靶mRNA的3'端非翻译区部分互补配对调节基因表达[5-6]。研究显示,miRNAs表达或者缺失与多种肿瘤的发生有关,提示miRNAs在肿瘤发生、发展和转移中发挥重要作用[7]。
miRNA-10b定位于HOX基因簇,不仅维持着正常组织的增殖分化,而且在肿瘤的发生及侵袭转移过程中也起着重要作用,最近的一些研究表明其可促进胃癌、口腔癌等多种恶性肿瘤细胞的侵袭及转移[8-9]。我们通过体外实验将表达miRNA-10b的质粒转染入95-C细胞中,获得过表达miRNA-10b的95-C细胞,根据细胞增殖实验结果可以看出,miRNA-10b表达量增高的细胞增殖速度加快;通过transwell检测95-C细胞侵袭能力的改变,结果提示:过表达miRNA-10b可以增强95-C细胞侵袭能力。
目前研究认为,成熟的miRNA存在2种可能的作用机制:翻译水平调控和导致mRNA的降解。miRNA与靶结合位点的匹配程度是决定miRNA发挥何种作用的关键因素。当miRNA序列与靶基因的mRNA3'UTR或编码区域不完全互补配对时,会引起mRNA翻译水平调控,即抑制mRNA的翻译,影响蛋白水平表达;而完全的互补配对则导致靶mRNA的降解[10]。有研究结果表明,在食管癌中,KLF4基因的mRNA是miRNA-10b的直接和功能性靶基因,miRNA-10b通过下调靶基因KLF4的表达促进人食管癌细胞的侵袭转移[11]。KLF4曾被命名为胃肠富集Kruppel样因子或表皮锌指因子,主要在消化道和上皮细胞中表达,是一种具有结合位点特异性真核生物锌指蛋白转录因子,属于KLF蛋白家族一员,在多种肿瘤中表达下调[12-14]。转染表达KLF4可在体内抑制肿瘤的生长,抑制癌细胞的侵袭转移,可能与KLF4抑制细胞外基质蛋白-富含半胱氨酸的酸性分泌蛋白的表达或与KLF4上调p21和下调细胞周期素D1,导致细胞周期停滞在G1-S期有关[15]。我们在95-C细胞中过表达 miRNA-10b,48 h后收集细胞蛋白,通过Western blot实验发现,过表达miRNA-10b的细胞中KLF4蛋白水平降低;48 h后收集细胞总RNA,通过RT-PCR检测细胞中KLF4mRNA水平的改变,miRNA-10b过表达引起KLF4 mRNA水平降低,但与空白对照组及阴性对照组比较,差异无统计学意义,提示 miRNA-10b对KLF4 mRNA的调节为转录后翻译抑制。
一个特定miRNA可能有许多潜在的靶基因,miRNA-10b可能通过它的多个靶基因协同作用而发挥其生物调节功能。miRNA-10b在肿瘤细胞中的特定生物学功能必定是其作用于一系列相关靶基因的结果,KLF4在肺癌的增殖与转移过程中起重要作用,我们的研究中证实KLF4是miRNA-10b的功能性靶基因,是否为miRNA-10b的直接靶基因还不确定,因为没有建立相应的萤光素酶报告系统,有待在今后的研究中进一步证实。
我们通过研究认为:miRNA-10b能促进95-C细胞的增殖和侵袭,有可能是通过下调KLF4蛋白的表达得以实现。miRNA-10b可能成为具潜能的非小细胞肺癌治疗靶点,沉默miRNA-10b基因的表达治疗策略有望能改善非小细胞肺癌患者的预后。
[1]Berezikov E,Guryev V,van de Belt J,et al.Phylogenetic shadowing and computational identification of human microRNA genes[J].Cell,2005,120(1):21-24.
[2]程 文.微小RNA与肿瘤相关性研究[J].医学研究生学报,2011,24(2):203-207.
[3]印 洁,李玉枫,宋 勇,等.miR-21在肺癌血管生成中的作用及培美曲塞对其影响[J].医学研究生学报,2012,25(5):476-480.
[4]Roth C,Kasimir-Bauer S,Pantel K,et al.Screening for circulating nucleic acids and caspase activity in the peripheral blood as potential diagnostic tools in lung cancer[J].Mol Oncol,2011,5(3):281-291.
[5]Meltzer PS.Cancer genomics:small RNAs with big impacts[J].Nature,2005,435(7043):745-746.
[6]Yekta S,Shih IH,Bartel DP.MicroRNA-directed cleavage of HOXB8 mRNA[J].Science,2004,304(5670):594-596.
[7]封 冰,陈龙邦.微小RNA与表观遗传调控:肿瘤治疗新策略[J].医学研究生学报,2011,24(1):92-95.
[8]Ya-Ching L,Chen YJ.Oncogenic function and early detection potential of miRNA-10b in oral cancer as identified by microRNA profiling[J].Cancer Prev Res,2012,5(4):665-674.
[9]Kim K,Lee HC,Park JL,et al.Epigenetic regulation of microRNA-10b and targeting of oncogenic MAPRE1 in gastric Cancer[J].Epigenetics,2011,6(6):740-751.
[10]Lund E,Güttinger S,Calado A,et al.Nuclear export of microRNA precursors[J].Science,2004,303(5654):95-98.
[11]Tian Y,Luo A,Cai Y,et al.MicroRNA-10b promotes migration and invasion through KLF4 in human esophageal Cancer cell lines[J].Biol Chem,2010,285(11):7986-7994.
[12]Li D,Peng Z,Tang H,et al.KLF4-mediated negative regulation of IFITM3 expression plays a critical role in colon cancer pathogenesis[J].Clin Cancer Res,2011,17(11):3558-3568.
[13]Yu F,Li J,Chen H,et al.Kruppel-like factor 4(KLF4)is required for maintenance of breast cancer stem cells and for cell migration and invasion[J].Oncogene,2011,30(18):2161-2172.
[14]张志平,王 洲,刘相燕,等.KLF4和SPARC在非小细胞肺癌中的表达及其相关性研究[J].中国肺癌杂志,2012,15(12):720-724.
[15]Zhou Y,Hofstetter WL,He Y,et al.KLF4 inhibition of lung Cancer cell invasion by suppression of SPARC expression[J].Cancer Biol Ther,2010,9(7):507-513.
