铜和镍对大麦根伸长的联合毒性研究
2014-09-27宋宁宁王学东马义兵
钟 旭,宋宁宁,王学东,马义兵,*
1. 首都师范大学资源环境与旅游学院,北京 1000482. 中国农业科学院农业资源与农业区划研究所,北京 100081
铜和镍对大麦根伸长的联合毒性研究
钟 旭1,2,宋宁宁2,王学东1,马义兵2,*
1. 首都师范大学资源环境与旅游学院,北京 1000482. 中国农业科学院农业资源与农业区划研究所,北京 100081
重金属的复合污染在环境污染中普遍存在,所以复合污染的联合毒性研究对于准确评价重金属污染有着重要的意义。本论文以大麦根伸长为研究对象,探索了铜(Cu)和镍(Ni)对大麦根伸长的联合毒性。基于Cu-Ni混合物的剂量-效应曲线,运用扩展的浓度加和(CA)与独立作用(RA)两个模型对不同浓度组合的Cu-Ni混合物的交互作用及联合毒性进行预测。结果表明,扩展的CA和RA模型均能较好地预测Cu-Ni混合物对大麦根伸长的联合毒性,低剂量的Ni能缓解Cu对大麦根伸长的毒性作用,但是低剂量的Cu对Ni的生物毒性没有显著影响。研究阐明了Cu、Ni复合作用对大麦根伸长联合毒性的效应机理。
联合毒性;铜;镍;浓度加和模型;独立作用模型;
目前环境中重金属的风险评估和质量标准制定通常是以单一元素的生态毒性数据为依据的,但是自然环境中的生物往往暴露于多种重金属组成的混合污染物而非单一污染物中。重金属在混合物中的毒性变化很大,它们作用于生物体时往往会发生与单一重金属完全不同的联合毒性作用[1-2]。即使每种重金属浓度低于无观测效应浓度(NOEC)时,其混合物也可能对生物产生显著的联合毒性,这一现象可归因于不同重金属之间的交互作用[3]。研究重金属混合物中各组分生物效应间的交互作用及这些作用对生物毒性的影响,对阐释重金属联合毒性作用机理和评价重金属联合毒性作用具有重要的意义。
在生态毒理学中,混合物联合毒性分析中最常用的定量预测模型是浓度加和模型(concentration addition, CA)和独立作用模型(independent addition, RA)。CA模型一般用来预测具有相同或者相似毒性作用机制的化学物质的联合毒性,它认为如按一定比例用一种化学物质代替另外一种化学物质时,混合物的毒性不改变[4]。与CA模型相对应的是RA模型,它适用于具有相异作用模式的化学物质组成的混合物的联合毒性的预测,它依赖于已知化学物质的单一毒性效应来评估总体毒性[5]。尽管有时混合物组分并不是严格遵守相同或者相似的毒性作用方式,CA和RA 模型目前已成为预测环境中混合物毒性的参考模型[6-8]。
铜(Cu)是生物体必需的微量元素,镍(Ni)是生物体的有益元素,但二者又是环境中常见的重金属污染物,过量的Cu和Ni会对生物体产生毒性效应。国内外研究者以大量生物毒性测试数据为基础构建了较为完善的Cu和Ni的生物毒性预测模型[9-13],但是这些研究通常是基于单一重金属元素指标而非复合污染效应进行的。针对目前环境中Cu-Ni复合污染的高生态风险问题,本研究以土壤模拟溶液中的大麦根伸长为研究对象,采用基于混合物假定线性相互作用的扩展的CA和RA模型研究Cu-Ni的联合毒性[6],探讨不同Cu-Ni组合与生物毒害的关系,确定复合污染下Cu、Ni之间的交互作用模式,以期为阐明Cu-Ni对大麦根伸长的联合毒性效应机理以及建立重金属复合污染的生态风险评价方法体系提供科学理论依据。
1 材料和方法(Materials and methods)
1.1 实验材料
二水合氯化铜(CuCl2·2H2O)、六水合氯化镍(NiCl2·6H2O)、氯化钙(CaCl2)和氢氧化钠(NaOH)溶液均为分析纯或优级纯,2-(N-吗啡啉)乙磺酸(MES)为Sigma公司进口产品。大麦种子购自河南省农业科学院培育的驻大麦6号。
1.2 实验设计
设Cu、Ni两个组,每组实验均以0.2 mmol·L-1的CaCl2为背景溶液,对于每个组,每组实验变化Cu(或Ni)浓度,并伴有Ni(或Cu)浓度的变化。通过添加CuCl2母液配置Cu2+的浓度范围为0.00,0.10,0.25,0.50,0.80,1.00,2.50 μmol·L-1,添加的Ni2+为0,0.10,0.25,0.40,0.50 μmol·L-1;通过添加NiCl2母液配置Ni2+的浓度范围分别为0,0.01,0.5,2.5,5,10,20 μmol·L-1,添加的Cu2+为0,0.05,0.10,0.25,0.5 μmol·L-1。溶液的pH值均为6.5。
1.3 溶液配置
使用1 mol·L-1的NaOH、1 mol·L-1的HCl及不能与金属络合的缓冲剂MES调节培养液pH值至6.5[14]。通过添加CuCl2母液配置6个Cu浓度,添加NiCl2配置6个Ni浓度,每组实验添加6组Ni或者Cu。每个Cu浓度或Ni浓度设置3个重复。
1.4 植物培养
大麦根长抑制实验参照ISO标准(11269-1)[15]。大麦种子用10%的次氯酸钠消毒洗净后置于水培装置中。每个处理为6粒种子,暴露于装有供试溶液的烧杯中,每个处理设置3个重复,置于RHZ-800智能人工气候箱中培养。培养条件如下,白天光照12~14 h,温度为(24±2 ℃);夜间光照8~12 h,温度为(18±2 ℃)。光照强度为25 000 lux。每隔1 d更换1次溶液,培养5 d后测定根长,并依据公式(1)计算不同处理下的相对于对照的根的伸长百分比(RE,%):
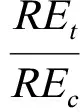
(1)
式中,REt代表不同Cu、Ni浓度处理的根伸长(cm),REc代表对照根伸长(cm)。
1.5 Cu、Ni毒性阈值的计算
Cu、Ni形态采用WHAM 6.0软件计算[16],输入参数为溶液中阴阳离子浓度和pH值。由于试验为开放系统,因此CO2的分压取3.5×10-4atm。EC50拟合采用log-logistic曲线(公式(2))拟合。

(2)
式中,Y为相对于对照的大麦根伸长百分比(%);X为总Cu(Ni)浓度或自由Cu2+(Ni+)活度;Y0、M和b表示拟合常数;M为log(EC50),EC50为大麦根伸长受到50%抑制时Ni(Ni+)或Cu(Cu2+)的含量。EC50的显著性检验采用澳大利亚科学和工业研究组织内部交流软件计算出95%置信区间(95% C.I.),如果两个EC50的95%置信区间不重叠,表示两个EC50存在显著性差别,否则表示两个数值差别不显著。
1.6 CA和RA模型的数学描述
当溶液pH=6.5时,自由离子Cu2+、Ni2+为主要的毒性形态,因此应用CA和RA模型对Cu、Ni混合物的联合毒性进行预测时,只考虑了对大麦根伸长起主要作用的毒性形态Cu2+和Ni2+[13,17]。考虑到混合物中Ni对Cu的解毒作用,将代表Ni对Cu毒性影响的扩展系数c12引入到CA和RA扩展模型中。因为低剂量的Cu对Ni的生物毒性没有显著影响(表1),因此不再考虑Cu对Ni毒性影响的扩展系数c21。
基于两种毒性呈线性相互作用的假设,CA模型中大麦在Cu-Ni混合溶液中的相对根长(RE)可以表示为方程(3)[6]。式中c1代表混合溶液中Cu2+毒性的强度系数;c12表示Ni对Cu2+毒性影响的扩展系数;c2代表Cu溶液中Ni2+毒性的强度系数;d1表示拟合常数。{Cu2+}、{Ni2+}代表离子活度。
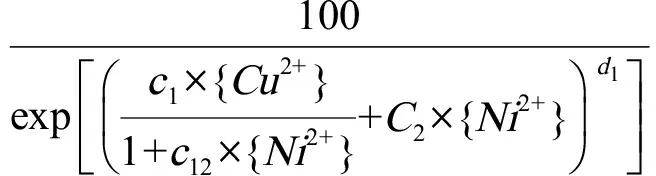
(3)
基于两种毒性呈线性相互作用的假设,效应加和模型(RA)中大麦在Cu-Ni混合溶液中的相对根长(RE)可以表示为方程(4),式中参数含义参考方程(2),d1、d2表示拟合常数。

(4)
2 结果(Results)
2.1 Cu 和Ni 对大麦根伸长的毒性效应
不同Cu和Ni处理下的剂量—效应曲线如图1所示,从剂量—效应曲线计算得到的Cu和Ni的毒性阈值EC50列于表1。当溶液pH为6.5时,随着低剂量Ni的加入,EC50{Cu2+}值从0.48增大到1.21,增大了2.52倍,表明低剂量范围内,随着Ni浓度的增加,Cu对大麦根伸长的毒性在逐渐减弱。但是,低剂量Cu加入时,EC50{Ni2+}值在4.36~5.43之间波动,并无显著性变化,表明低剂量范围内,随着Cu浓度的增加,Ni对大麦根伸长的急性毒性没有显著变化,Cu对Ni的毒性没有显著影响。
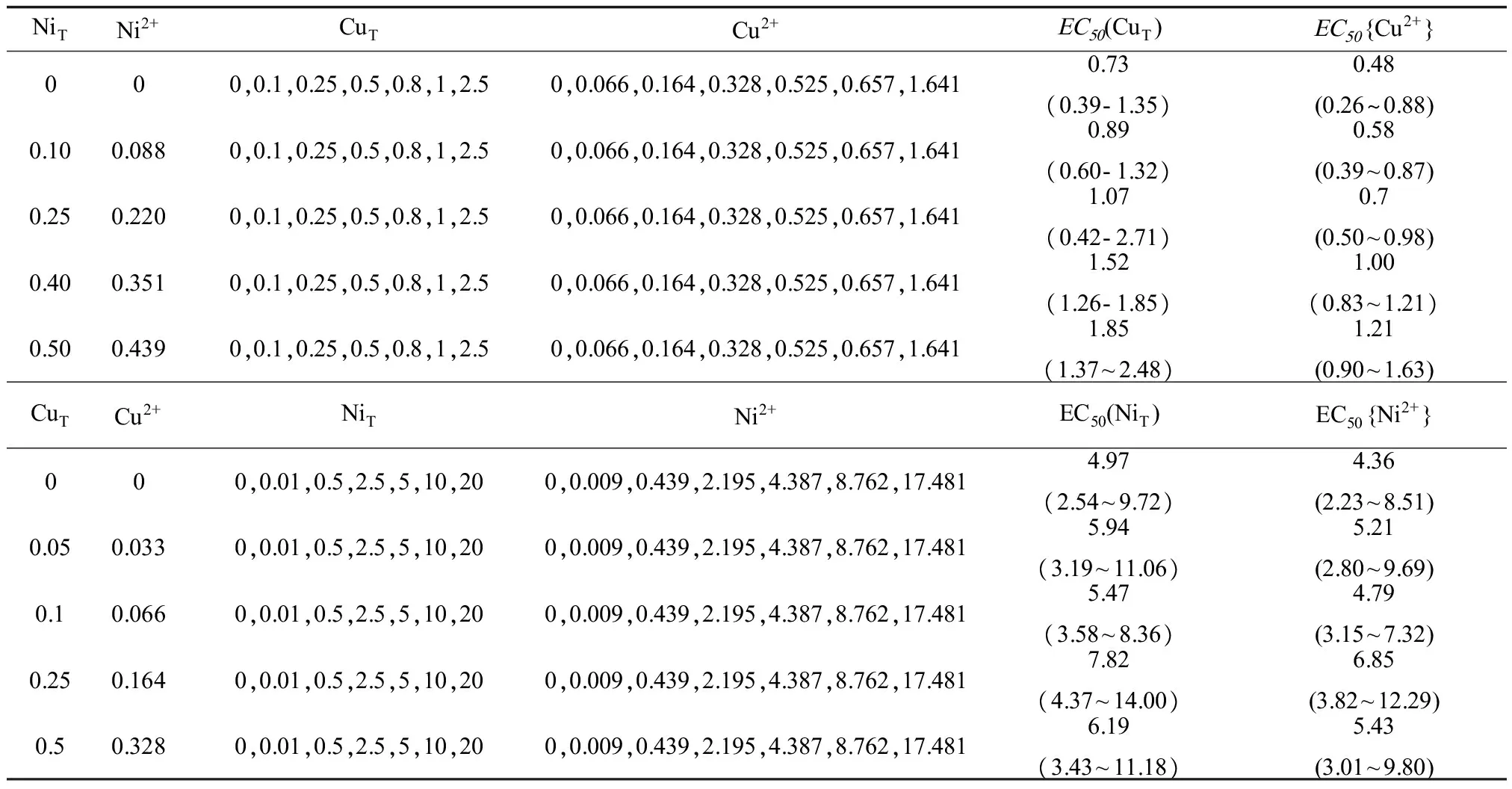
表1 不同处理下供试溶液的化学成分及EC50值和其95%置信区间Table 1 Composition of the test media used in the various bioassay sets and observed EC50 for barley root elongation and 95% confidence intervals μmol·L-1
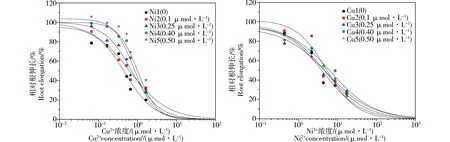
图1 Cu、Ni剂量效应曲线Fig. 1 Toxicity of Cu (Ni) to barley root elongation expressed as dose-response curves
2.2 CA和RA扩展模型参数的估算
通过DPS9.0软件对CA和RA扩展模型进行拟合,得到的各参数见表2。两个模型拟合得到Cu2+和Ni2+毒性的强度系数差别不大,分别为 6.04和6.07(logKCu),5.27和5.23(logKNi),表明在pH 6.5 条件下Cu2+对大麦根伸长的毒性要大于Ni2+。利用CA扩展模型拟合的代表Ni对Cu的作用的强度系数c12为4.96,远远小于RA扩展模型的拟合值6.37,表明Cu、Ni之间相互作用的大小会因假定的Cu、Ni之间作用方式的不同而变化,但CA和RA两个扩展模型拟合结果均为低剂量的Ni对Cu有强烈的解毒能力。
图2为两种模型预测的大麦相对根伸长与实测大麦相对根长的比较。两种模型对Cu-Ni对大麦根长联合毒性的预测结果相同。趋势线的斜率、截距、R2值以及和1:1直线的吻合程度表明CA和RA扩展模型的预测和实测大麦根长都具有较好的相关性,均能较准确的模拟复合金属对大麦急性毒性的影响。

表2 浓度加和(CA)和效应加和(RA)扩展模型的拟合参数Table 2 Parameters associated with extended concentration addition (CA) and response addition (RA) models

图2 预测和实测大麦根伸长相关关系Fig. 2 Relationship between predicted and observed barely root elongation
3 讨论(Discussion)
本论文研究了Cu、Ni对大麦根伸长的联合毒性时发现Ni能明显缓解Cu对大麦根伸长的毒害作用,但是低剂量的Cu对Ni的毒害没有显著影响。有关重金属复合污染对植物的联合毒性效应方面,已有文献表明: Cd+Zn组合对蝇子草(Silenevulgaris)重金属的吸收表现为拮抗作用,而Cu+Zn、Cu+Cd组合则表现为协同作用[18]。Zn2+能够显著缓解Cu2+对生菜(Lactucasativa)的毒性,而Cu2+对Zn2+的毒性没有显著影响[6]; Cd2+和Zn2+在土豆体内具有相互促进吸收积累的机制,二者呈协同作用,但在大白菜和野生苋中Cd2+具有抑制Zn2+吸收积累的机制,两者呈拮抗作用[19]。重金属之间对生物的联合毒性效应可以表现为相加作用、拮抗作用或协同作用。其作用机理大多与金属硫蛋白的生物合成有关,动植物体内的金属硫蛋白能螯合部分重金属,并对重金属的动态平衡及其存在形式具有重要作用[20]。正常情况下,金属硫蛋白在生物体内的含量很低,但当生物受到重金属胁迫时,其体内会诱导合成金属硫蛋白,进入细胞内的重金属就会结合到这类新合成的蛋白质上,或取代原来结合在该蛋白上的其它金属[21]。Cu2+和Ni2+对大麦根伸长的联合毒性表现为拮抗作用,可能是Cu2+和Ni2+在与金属硫蛋白结合时发生竞争性抑制所致。Cu2+和Ni2+能与生物体内的硫蛋白结合生成铜硫蛋白、镍硫蛋白,不同金属硫蛋白的稳定性存在一定差异,镍硫蛋白稳定性小于铜硫蛋白,Cu2+与镍硫蛋白中的Ni2+发生置换反应生成铜硫蛋白,从而降低了体液中Cu2+的浓度,致使Cu2+毒性降低。重金属混合物的联合毒性除不同重金属离子与金属硫蛋白的亲合力或螯合饱和度存在差异有关外[7],还与各种重金属离子的质量浓度水平及质量浓度组合有关[22-23],因此它们之间的相互作用机制远比单一重金属的作用要复杂得多。
本研究中应用扩展后的CA和RA两个模型均能较好地预测Cu、Ni的联合毒性,均表明Ni对Cu的解毒作用,且对它们之间的相互作用进行了定量分析。扩展后的CA和RA模型在估算重金属的混合毒性方面有一定的优势,它考虑到混合重金属所有潜在的相互作用,在数学表达式中引入了扩展系数cij的计算,而非传统意义上在某个响应水平的浓度或活性的单一值。利用这种建模方法能够绘制完整的剂量效应曲线,描述混合物的毒性,提供了互动混合物的毒性的定量评估。本研究中CA和RA两个扩展模型对Cu、Ni混合物联合毒性的预测结果差异不明显,无法确定Cu、Ni对大麦根伸长的作用机制是相同还是相异。在环境混合物的联合毒性评价的最佳参考模型是选择CA还是RA一直都是富有争议的。张亚辉等[24]在研究一组氯酚化合物对大型溞的联合毒性时发现,利用CA模型拟合的结果更接近实际观察值,RA倾向于“低估”实际的联合毒性。Versieren[8]等研究了Cu-Ni对大麦根长的联合毒性发现RA模型比CA模型更准确。Yen Le[6]在研究Cu2+-Zn2+,Cu2+-Ag+对生菜(Lactucasativa)根伸长抑制毒性时,发现Cu2+-Zn2+,Cu2+-Ag+的联合毒性既可用CA模型,也可用RA模型进行评价。环境中存在的污染物的作用机理或作用方式大都是未知的,且对混合物组分作用机制的“相似”和“相异”并没有一个明确范围的界定,因此,CA和RA两个模型的应用范围比较宽泛,而非严格按照其定义中的“相似”和“相异”去判别混合物的联合毒性。
[1] Norwood W P, Borgmann U, Dixon D G, et al. Effects of metal mixtures on aquatic biota: A review of observations and methods [J]. Human and Ecological Risk Assessment, 2003, 9(4): 795-811
[2] Manzo S, Buono S, Cremisini C. Cadmium, lead and their mixtures with copper:Paracentrotuslividusembryotoxicity assessment, prediction, and offspring quality evaluation [J]. Ecotoxicology, 2010, 19(7): 1209-1223
[3] Cooper N L, Bidwell J R, Kumar A. Toxicity of copper, lead, and zinc mixtures toCeriodaphniadubiaandDaphniacarinata. Ecotoxicology and Environmental Safety, 2009, 72(5): 1523-1528
[4] Berenbaum M C. The expected effect of a combination of agents: The general solution [J]. Journal of Theoretical Biology, 1985, 114(3): 413-431
[5] Backhaus T, Altenburger R, Boedeker W, et al. Predictability of the toxicity of a multiple mixture of dissimilarly acting chemicals toVibriofischeri[J]. Environmental Toxicology and Chemistry, 2000, 19(9): 2348-2356
[6] Yen Le T T, Vijver M G, Jan Hendriks A, et al. Modeling toxicity of binary metal mixtures (Cu2+-Ag+, Cu2+-Zn2+) to lettuce,Lactucasativa, with the biotic ligand model[J]. Environmental Toxicology and Chemistry, 2013, 32(1): 137-143
[7] 王志铮, 王伟定, 杨阳, 等. 4 种重金属离子对彩虹明樱蛤 (Moerellairidescens) 的急性致毒效应[J]. 海洋与湖沼, 2007, 38(4): 373-378.
Wang Z Z, Wang W D, Yang Y, et al. Acut toxic effects of four heavy metals onMoerellairidescens[J].Oceanlogia Et Limmologia Sinica, 2013, 32(1): 137-143 (in Chinese)
[8] Versieren L, Smets E, De Schamphelaere K, et al. Mixture toxicity of copper and zinc to barley at low level effects can be described by the Biotic Ligand Model [J]. Plant and Soil, 2014: 1-12
[9] Thakali S, Allen H E, Di Toro D M, et al. A terrestrial biotic ligand model. 1. Development and application to Cu and Ni toxicities to barley root elongation in soils [J]. Environmental Science & Technology, 2006, 40(22): 7085-7093
[10] Thakali S, Allen H E, Di Toro D M, et al. Terrestrial biotic ligand model. 2. Application to Ni and Cu toxicities to plants, invertebrates, and microbes in soil [J]. Environmental Science & Technology, 2006, 40(22): 7094-7100
[11] Li B, Zhang X, Wang X, et al. Refining a biotic ligand model for nickel toxicity to barley root elongation in solution culture [J]. Ecotoxicology and Environmental Safety, 2009, 72(6): 1760-1766
[12] Wang X, Li B, Ma Y, et al. Development of a biotic ligand model for acute zinc toxicity to barley root elongation[J]. Ecotoxicology and Environmental Safety, 2010, 73(6): 1272-1278
[13] Wang X D, Ma Y B, Hua L. A biotic ligand model predicting acute copper toxicity for barley (Hordeumvulgare): Influence of calcium magnesium sodium potassium and pH. Chemosphere, 2012, 89: 89-95
[14] Kandegedara A, Rorabacher D B. Noncomplexing tertiary amines as “better” buffers covering the range of pH 3-11. Temperature dependence of their acid dissociation constants [J]. Analytical Chemistry, 1999, 71(15): 3140-3144
[15] International Organization for Standardization.Soil Quality Determination of the Effects of Pollutants on Soil Flora.Part 1:Method for the Measurement of Inhibition of Root Growth.1993: ISO 1 1 269-1 [S]. Geneva,Switzerland
[16] Tipping E. Humic ion-binding model VI: An improved description of the interactions of protons and metal ions with humic substances [J]. Aquatic Geochemistry, 1998, 4(1): 3-47
[17] 张璇, 华珞, 王学东, 等. 不同 pH 值条件下Ni对大麦的急性毒性[J]. 中国环境科学, 2008, 28(7): 640-645
Zhang X, Hua L, Wang X D, et al. Effect of pH on nickel acute toxicity to barley (Hordeumvulgare) [J]. China Envinronmental Science, 2008, 28(7): 640-645 (in Chinese)
[18] Sharma S S, Schat H, Vooijs R, et al. Combination toxicology of copper, zinc, and cadmium in binary mixtures: Concentration‐dependent antagonistic, nonadditive, and synergistic effects on root growth in Silene vulgaris [J]. Environmental Toxicology and Chemistry, 1999, 18(2): 348-355
[19] Zhou Q X, Cheng Y, Zhang Q R, et al. The compound pollution ecology toxicology effect quota relations analyzes [J]. Chinese Science Cedits, 2003, 33(6): 566-572
[20] Frias-Espericueta M G, Voltolina D, Osuna-López J I. Acute toxicity of copper, zinc, iron, and manganese and of the mixtures copper zinc and iron manganese to Whiteleg shrimpLitopenaeusvannameipostlarvae [J]. Bulletin of Environmental Contamination and Toxicology, 2003, 71(1): 68-74
[21] George S, Hodgson P, Todd K, et al. Metallothionein protects against cadmium toxicity-proof from studies developing turbot larvae [J]. Marine Environmental Research, 1996, 42(1-4)
[22] Feron V J, Groten J P. Toxicological evaluation of chemical mixtures [J]. Food and Chemical Toxicology, 2002, 40(6): 825-839
[23] 周启星, 程云, 张倩茹, 等. 复合污染生态毒理效应的定量关系分析[J]. 中国科学: C 辑, 2004, 33(6): 566-573.
[24] 张亚辉, 曹莹, 王一喆, 等. 3 种氯酚化合物对大型溞的联合毒性[J]. 生态毒理学报, 2011, 6(4): 403-409
Zhang Y H, Cao Y, Wang Y Z, et al. Joint toxicity of three chlorophenols toDaphniamagna[J]. Asian Journal of Ecotoxicology, 2011, 6(4): 403-409 (in Chinese)
◆
JointToxicityofCu-NitoBarleyRootElongation
Zhong Xu1,2, Song Ningning2, Wang Xuedong1, Ma Yibing2,*
1. College of Resource Environment and Tourism, Capital Normal University, Beijing 100048, China2. Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences, Beijing 100081, China
3 June 2014accepted10 August 2014
The combined pollution of heavy metals is common in the environment pollution, so that the joint toxicity of heavy metals is important for risk assessment of contamination of heavy metals in environments. In the present study, the joint toxicity of copper (Cu) and nickel (Ni) to barley root elongation was studied based on dose-effect curves. Furthermore, the interactions of Cu2+-Ni2+were included in quantitatively estimating toxicity of Cu-Ni mixtures by linearly expanding the concentration addition (CA) and response addition (RA) models. It was demonstrated that both extended CA and extended RA models could be employed to predict the joint toxicity of Cu and Ni to barley root elongation. Results showed that Ni in a low dose had a significant alleviative effect on Cu toxicity while Cu in a low dose did not affect Ni toxicity significantly. The present study explained the mechanism of the Cu-Ni joint toxicity to barley root elongation.
joint toxicity; copper; nickel; concentration addition model; response addition model
2014-06-03录用日期:2014-08-10
1673-5897(2014)4-751-06
: X171.5
: A
马义兵(1957—),男,河北保定人,研究员,主要从事土壤重金属环境风险评价和治理.
国家自然科学基金项目(40971262);公益性行业(农业)科研专项项目(200903015)
钟旭(1988-)女,硕士,研究方向:土壤重金属生态风险评价,E-mail:zhongxvhuanke@sina.com
*通讯作者(Corresponding author),E-mail: ybma@caas.ac.cn
10. 7524/AJE. 1673-5897. 20140510004
钟 旭,宋宁宁,王学东,等. 铜和镍对大麦根伸长的联合毒性研究[J]. 生态毒理学报, 2014, 9(4): 751-756
Zhong X, Song N N, Wang X D, et al. Joint toxicity of Cu-Ni to barley root elongation [J]. Asian Journal of Ecotoxicology, 2014, 9(4): 751-756 (in Chinese)
