3类色系榉树叶色表达期色素含量变化规律研究
2014-09-26刘雪梅金晓玲汪晓丽
刘雪梅, 金晓玲, 汪晓丽, 王 征
(中南林业科技大学风景园林学院,湖南 长沙 410004)
3类色系榉树叶色表达期色素含量变化规律研究
刘雪梅, 金晓玲, 汪晓丽, 王 征
(中南林业科技大学风景园林学院,湖南 长沙 410004)
对秋季叶色为红色、黄色、绿色的3类不同色系榉树在叶色表达期的色素含量变化规律进行研究.结果表明,3类色系榉树的叶绿素和类胡萝卜素含量变化趋势相似,叶绿素含量随着秋季叶色变化而逐渐降低;类胡萝卜素含量则一直保持比较稳定的状态;3类色系榉树的花青苷变化存在显著差异,黄色和绿色系榉树花青苷呈逐渐降低趋势,而红色系则表现为先上升再下降的变化过程.可溶性糖变化趋势基本一致,均表现为叶色开始变化时上升随后开始下降的变化过程.3类色系榉树的总叶绿素与类胡萝卜素含量的比值变化趋势无显著差异;但总叶绿素与花青苷含量的比值变化特点不同,黄色和绿色系随着叶色变化,比值表现为快速下降—平稳—快速下降三个阶段;而红色系则一直保持快速下降趋势.可溶性糖含量与花青苷的大量合成显著正相关,相关系数达0.957.红色系榉树的叶色表达与花青苷含量变化显著相关,黄色系榉树的叶色表达与较大的叶绿素含量变化量和叶绿素与类胡萝卜素的比值变化量密切相关,绿色系榉树的叶色表达则与很高的叶绿素含量有关.
榉树;叶色表达期;色素含量;花青苷
秋色叶树种叶色季相变化多样,不仅能够极大的丰富园林景观,更能展现景观的动态美,尤其是乔木秋色叶树种在景观中的应用备受喜爱;但是当前中国园林中应用的彩叶乔木资源还不多,其叶色变化机理及品种选育研究还不够深入[1].榉树不仅秋季叶色丰富,而且耐土壤瘠薄,同时具有净化空气的作用,能更好地适应城市园林景观复杂的环境,加强景观效果的持续性,具有很高的社会、经济、景观及生态价值[2~5].因此,研究榉树的叶色变化机理,选育不同秋季叶色的榉树新品种,对园林秋色叶乔木树种的开发应用有重要意义.已有学者开展了榉树叶色的研究,赵旺兔[6]、罗雪梅等[7]观察了榉树秋季叶色变化类型,发现榉树秋季叶色丰富,包括红、棕红、暗红、紫、黄、橙黄及绿色等;赵旺兔[6]还对不同季节的榉树叶肉细胞超微结构进行了观察,发现榉树叶色的变化与叶绿体降解及深色嗜锇颗粒的累积有关;曹娴[8]研究了榉树叶色变化与花青素含量的关系;黄利斌等[9]比较了秋季叶色为红色、黄色及橙黄色榉树间色素含量差异.但他们的研究还不够全面,暂未对不同色系榉树在叶色表达期内色素含量的动态变化进行系统研究. 2009—2011年,罗雪梅[7]根据榉树叶色在秋季的变色时间早晚和叶色观赏期长短综合考虑,将榉树分为红色、黄色和绿色3大色系类型,并进行了叶色稳定性观察.本研究以其中秋季叶色为红色、黄色和绿色,且叶色表现稳定的4 a生榉树为材料,在叶色表达期内对3类色系榉树的叶绿素、类胡萝卜素、花青苷和可溶性糖的含量进行测定,并进行相关性分析,探究不同色系榉树色素含量动态变化规律及相关关系,为其叶色变化机理的研究和不同色系榉树新品种的选育提供理论依据.
1 材料与方法
1.1材料
试验以经过3 a连续筛选的秋季叶色稳定、生长健壮、长势相当的4 a生榉树为材料,红色系、黄色系和绿色系各10棵,于2012年春统一定植于校园内,进行相同的栽培管理.2012-09-15—2012-12-15,每种色系随机选择3株作为试验样株,每15 d采鲜样,进行叶绿素、类胡萝卜素、花青苷和可溶性糖含量的测定.
1.2方法
1.2.1 色素含量的测定 选择位于树冠同一高度的东南西北4个方向采样,每个单株设 4个重复.叶绿素 a,b及类胡萝卜素含量的测定参照郝建军等[10]的方法.将叶片取回,洗净,擦干,剪碎后,用丙酮与乙醇体积比1∶1混合溶液作提取剂,封口于暗处浸提,至叶片完全变白,检测色素提取液在 663,646,470 nm 下的吸光度并计算其含量,总叶绿素含量用叶绿素 a和 b含量之和表示.花青苷的测定参考仝月澳等[11]的方法, 将叶片取回,洗净,擦干,剪碎,称取0.1 g加入V(1.5 mol·L-1盐酸)∶V95%乙醇=15∶85混合提取液10 mL在黑暗条件下浸提24 h,取滤液,检测535 nm波长的吸光度.参考胡位荣等[12]的计算方法计算含量.
1.2.2 可溶性糖的测定 采用蒽酮比色法,标准曲线的制作参考郝建军等[10]的方法.
1.3数据分析
所得数据利用Microsoft Excel 2003 作图,IBM SPSS 20软件进行数据统计分析.
2 结果与分析
2.13类榉树色素及可溶性糖含量动态变化规律
2.1.1 叶绿素含量动态变化 3类色系榉树叶绿素含量动态变化如图1、图2、图3所示.随着叶色的变化,叶绿素含量均逐渐降低,其中黄色系榉树叶绿素含量的降低幅度最大,其叶绿素a、叶绿素b和总叶绿素含量降幅都大于80%.在叶色表达期,叶绿素含量以绿色系榉树最大,黄色系次之,红色系最小.

注:若未加特别说明,以下图中Y代表黄色系榉树,R代表红色系榉树,G代表绿色系榉树,下同Note: If there is no special indication in the figure, the “Y”,“R”,“G” always represents yellow, red and green Zelkova schneideriana respectively. The same is below.图1 3类色系榉树叶片叶绿素a含量变化Fig.1 Changes of Chl.a content in the leaves of 3 kinds leaf color of Zelkova schneideriana

图2 3类色系榉树叶片叶绿素b含量变化Fig.2 Changes of Chl.b content in the leaves of 3 leaf color groups of Zelkova schneideriana
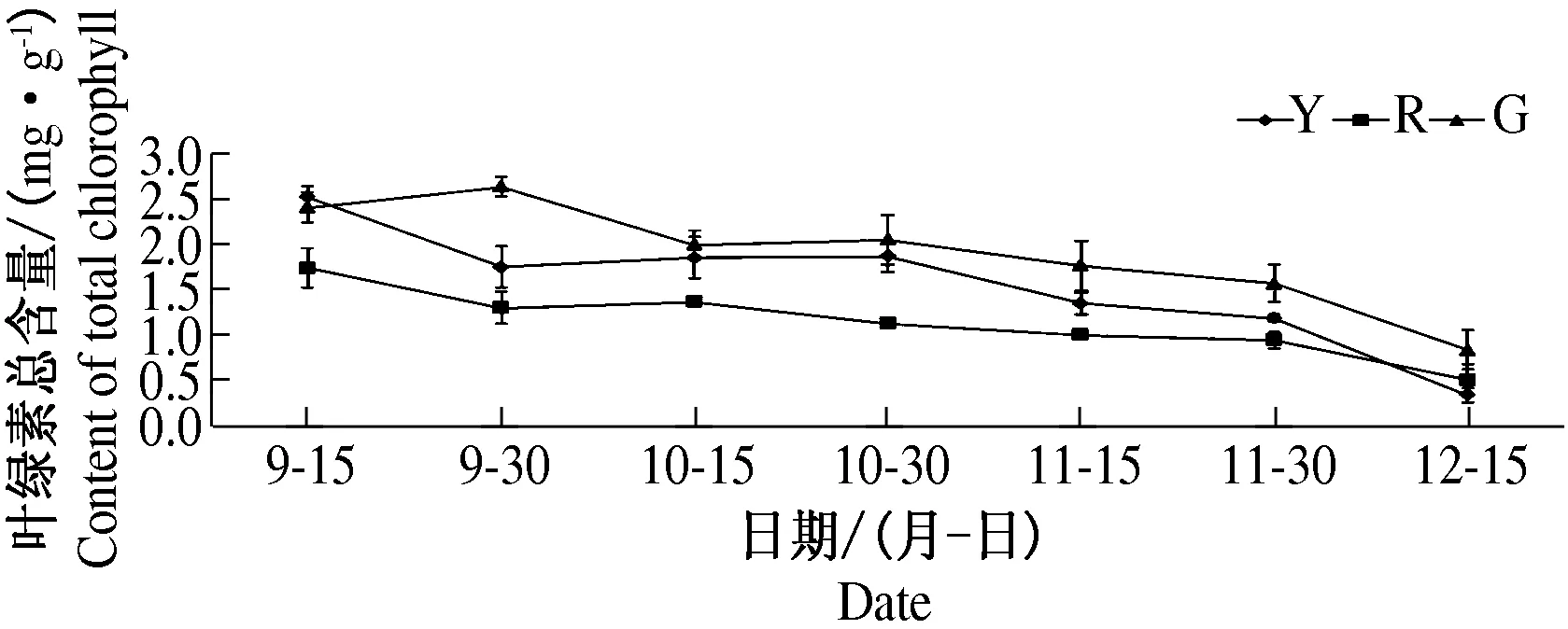
图3 3类色系榉树叶绿素总含量变化Fig.3 Changes of chlorophyll total content in the leaves of 3 leaf color groups of Zelkova schneideriana
2.1.2 类胡萝卜素含量动态变化 3类色系榉树的类胡萝卜素含量均较稳定(图4),整个叶色表达期间,类胡萝卜素含量变化不大,这与楚爱香等[13]对4种槭树属植物的研究结果一致.黄色系榉树类胡萝卜素含量总是保持在0.3~0.4 mg·g-1,红色和绿色系榉树则一直保持在0.25~0.35 mg·g-1和0.32~0.42 mg·g-1.

图4 3类色系榉树叶片类胡萝卜素含量变化Fig.4 Changes of carotenoid content in the leaves of 3 leaf color groups of Zelkova schneideriana
2.1.3 花青苷含量动态变化 3类色系榉树的花青苷含量的动态变化如图5所示.由图看出,黄色系和绿色系榉树的花青苷变化趋势一致,均呈逐渐降低趋势;相比于黄色系和绿色系榉树,红色系榉树花青苷含量动态变化趋势则显著不同,其变化过程与李向茂[14]、钱见平等[15]的研究结果一致,随着叶色的变化,花青苷含量迅速增加,直至叶片变色末期,花青苷含量才迅速下降,表现为先上升再下降的变化过程.同时,从图5可知,花青苷含量最大的红色系榉树,最大值为1.75 mg·g-1,是黄色系和绿色系榉树的3倍以上.

图5 3类色系榉树叶片花青苷含量变化Fig.5 Changes of anthocyanin content in the leaves of 3 leaf color groups of Zelkova schneideriana
2.1.4 可溶性糖相对含量动态变化 可溶性糖对花青苷的合成过程起信号作用[16],因此研究可溶性糖含量的变化规律,有助于明确花青苷的变化机制.
3类色系榉树的可溶性糖相对含量的变化趋势,均表现为先上升再下降的变化过程.由图6可知,红色系榉树的可溶性糖含量高于黄色系和绿色系榉树,分析3者可溶性糖相对含量差异结果(表1),发现黄色系与绿色系榉树间可溶性糖相对含量无显著差异;而红色系榉树可溶性糖相对含量与黄色和绿色系榉树间则存在显著差异;可溶性糖相对含量最高的是红色系,最高值可达42.7%,比黄色系和绿色系榉树高出18% 以上.

图6 3类色系榉树叶片可溶性糖含量变化Fig.6 Changes of soluble sugar content in the leaves of 3 leaf color groups of Zelkova schneideriana
2.1.5 3类色系榉树色素含量差异比较 为了明确不同色系榉树间色素含量差异,对11-30(因为此时黄色和红色系基本完全变色,此时色素含量差异最明显)测定结果进行了分析(表1).结果表明,3类色系榉树的类胡萝卜素含量无显著差异;绿色系榉树叶绿素含量差异最大,其含量显著高于红色系和黄色系的叶绿素含量,特别是叶绿素a和总叶绿素的含量,显著差异水平小于0.01;红色系榉树的花青苷和可溶性糖含量最大,与黄色系和绿色系榉树的可溶性糖含量差异极显著.

表1 11月3类色系榉树的叶片色素含量Table 1 Pigments content in leaves of 3 leaf color groups of Zelkova schneideriana in November
注:采用Duncan新复极差法进行数据分析,表中数据为平均值±标准差,不同小写字母代表在5% 水平上显著差异; 不同大写字母代表在1%水平上显著差异.
Note: Data analyzed by Duncan method in the table are the average ±SE, and different small letters mean significant difference at 5% level; different capital letters meant significant difference at 1% level.
2.2叶绿素总量与类胡萝卜素、花青苷含量比值变化
植物叶片中花青苷、叶绿素及类胡萝卜素在细胞中的比例及位置决定了叶片颜色.当叶绿素含量较大时,叶片为绿色;当类胡萝卜素含量较大时,叶片为黄色;当花青苷含量较大时,叶片为红色.因此研究总叶绿素含量与类胡萝卜素、花青苷含量的比值变化规律有助于探究榉树叶色变化机理.
2.2.1 总叶绿素与类胡萝卜素含量比值变化 3类色系榉树总叶绿素与类胡萝卜素含量的比值变化趋势见图7.其中比值最大的是绿色系榉树,而比值变化量最大的却是黄色系榉树,这与叶绿素的变化规律相似.

图7 3类色系榉树叶片总叶绿素与类胡萝卜素含量比值变化Fig.7 Changes of total chlorophyll/carotenoid in the leaves of 3 leaf color groups of Zelkova schneideriana
2.2.2 总叶绿素与花青苷含量比值变化 3类色系榉树总叶绿素与花青苷含量的比值变化趋势见图8.黄色系和绿色系榉树总叶绿素与花青苷含量

图8 3类色系榉树叶片叶绿素总量与花青苷含量比值变化Fig.8 Changes of total chlorophyll / anthocyanin in the leaves of 3 leaf color groups of Zelkova schneideriana
比值的下降表现为快速下降—平稳—快速下降的变化过程;红色系榉树的比值则一直呈快速下降趋势,可能是花青苷含量变化趋势所致.总叶绿素与花青苷含量比值最小的是红色系榉树,其次是黄色系,最大的是绿色系.
2.3花青苷含量与其他色素相关性研究
2.3.1 花青苷含量与其他色素含量的相关性 3类色系榉树花青苷与其他色素含量的相关性见表2.由表2可知,黄色系榉树的花青苷含量只与叶绿素b含量呈显著正相关;绿色系榉树花青苷则与叶绿素a、b和总叶绿素含量均呈显著正相关关系,表明绿色系花青苷与叶绿素的含量变化有同步性.红色系榉树花青苷与其他色素均呈负相关关系,但不显著,这与对红檵木[17]、黄连木[18]研究结果有一定差异,可能与实验样品叶色差异有关.另外,在红色系榉树中,花青苷含量和总叶绿素与花青苷的比值间表现出极显著的负相关关系,这与黄色和绿色榉树显著不同,说明在红色系榉树中的花青苷含量极大地影响着花青苷在色素中所占比例,由此进一步影响着红色系榉树叶色的表达.
2.3.2 花青苷与可溶性糖相关性 3类色系榉树花青苷与可溶性糖的相关性不同(表2).在红色系榉树中,二者存在极显著正相关,相关系数达0.957,这与唐前瑞[19]研究结果一致;而黄色系和绿色系榉树的花青苷与可溶性糖间则无显著相关性.此结果表明可溶性糖含量与花青苷的大量合成显著正相关.
3 结论与讨论
1) 3类色系榉树叶绿素含量呈逐渐降低趋势,其中以黄色系榉树的叶绿素降幅最大,绿色系的叶绿素含量最高;类胡萝卜素含量均较稳定.3类色系榉树的花青苷含量变化有较大差异,其中差异最大的是红色系榉树,其花青苷含量先上升再下降,这种变化过程完全不同于黄色系和绿色系花青苷的逐渐降低趋势;同时,红色系榉树的花青苷含量最高,显著大于黄色系和绿色系榉树,黄色系与绿色系榉树间花青苷含量无显著差异.

表2 3类色系榉树花青苷含量与其他色素含量的相关性分析Table 2 Analysis of correlation among anthocyanin and the other pigment in the leaves of 3 leaf color groups of Zelkova schneideriana
注:*代表在0.05水平上显著相关;**代表在0.01水平上显著相关.
Note: * means significant differnece of 5% level; ** means significant difference of 1% level.
2) 3类色系榉树的总叶绿素与类胡萝卜素含量比值变化趋势相似,但比值大小和比值变化量有差异.绿色系榉树的比值最大,而黄色系榉树的比值变化量最大.总叶绿素与花青苷比值的变化趋势不同,黄色系和绿色系榉树比值表现为快速下降—平稳—快速下降的变化过程,红色系比值则一直持续下降;3类色系榉树的总叶绿素与花青苷含量的比值大小依次为:绿色系>黄色系>红色系.
3) 花青苷含量与类胡萝卜素含量无显著相关关系.花青苷与叶绿素含量存在一定的相关性,但在3类色系榉树中相关性不同,黄色系的花青苷只与叶绿素b显著正相关;绿色系的花青苷与叶绿素显著正相关,而在红色系榉树中花青苷则与其他色素无显著相关性.只有在花青苷大量合成时,花青苷含量才与可溶性糖含量呈显著正相关关系.
4) 黄色系榉树色素变化最显著的特点是,叶绿素降幅最大,总叶绿素与类胡萝卜素含量的比值减少量也最大,结果与王欢利等[20]报道的金叶植物的叶色主要特点相似.红色系榉树则以花青苷的变化特点最显著,不仅其花青苷含量和变化趋势均显著不同于黄色和绿色系榉树,而且在3类色系榉树中,红色系榉树的总叶绿素与花青苷含量的比值最小,表明红色系榉树叶色的表达并不单纯是由于叶绿素降解的原因,还因为合成了大量的花青苷,这与钱见平[15]对红色类型元宝枫的研究结果一致.绿色系榉树色素最显著的特点是,叶绿素含量显著大于黄色系和红色系榉树.
3类色系榉树叶片在转色之前即存在叶绿素、类胡萝卜素和花青苷,但以叶绿素为主,类胡萝卜素和花青苷含量低,因此叶片呈绿色.随着叶色的表达,不同色系榉树的叶绿素发生不同程度的降解,类胡萝卜素含量保持稳定,花青苷含量升高,致使类胡萝卜素和花青苷在叶片总色素含量中的比例增大,从而实现相应的叶色转变.
根据试验结果,推测3类色系榉树改变相关呈色色素含量比例的方式不同.红色系榉树花青苷的比例提高是叶绿素含量减少和花青苷含量增加的共同结果,但花青苷含量变化量更大;黄色系榉树类胡萝卜素比例的提高则主要是叶绿素的大量降解所致,原因是黄色系的类胡萝卜素含量稳定,而叶绿素与类胡萝卜素的比值变化量却最大,而且数据显示黄色系的叶绿素降幅明显大于红色和绿色系榉树,表明黄色系类胡萝卜素比例上升的主要原因是叶绿素含量大量减少;绿色系榉树叶绿素的较高比例则可能通过10月之前的生长期大量合成叶绿素且确保叶绿素在色素中能长时间保持较高的比例,从而使叶色保持较长的绿色期而不变色.另外,试验结果表明,叶绿素、类胡萝卜素和花青苷3类色素所占的比例对叶色的表达有直接的影响,但是不同叶色表达的具体临界比值需进一步研究,同时,叶色表达的相关基因的研究应加强.
[1] 程 诗,杨建欣,罗言云.彩叶大乔木的园林景观应用[J].湖南农业大学学报:自然科学版, 2012,36(2):95-97.
[2] GARFI G, CARIMI F, PASTA S, et al. Additional insights on the ecology of the relic treeZelkovasiculadi Pasquale, Garfì et Quézel (Ulmaceae) after the finding of a new population[J]. Flora, 2011,206(5), 407-417.
[3] M. MIRABOLFATHY. Outbreak of charcoal disease onQuercusSPP. andZelkovaCarpinifoliatrees in forests of Zagros and Alborz mountains in Iran[J] Iranian Journal of Plant Pathology, 2013,49(2): 77-79.
[4] XIAOLING J, XIJUN H, YOUPING S, et al. Callus Induction and Plant Regeneration from Immature Embryos ofZelkovasinicaschneid[J]. Hortscience, 2012,47(6):790-792.
[5] HOSHIKA Y, PAOLETTI E, OMASA K. Parameterization ofZelkovaserratastomatal conductance model to estimate stomatal ozone uptake in Japan [J]. Atmospheric Environment, 2012,55:271-278.
[6] 赵旺兔.榉树生物学特性及园林应用研究[D].南京:南京林业大学,2003.
[7] 罗雪梅.不同榉树品系的生长特性及黄色品系组培快繁技术研究[D].长沙:中南林业科技大学,2012.
[8] 曹 娴.草莓抗灰霉病基因定位及榉树种质资源多样性的ISSR分析[D].上海:上海交通大学,2011.
[9] 黄利斌,施大伟,葛 静,等.秋季不同叶色榉树叶片色素含量变化的研究[J].江苏林业科技,2012,39(6):1-4.
[10] 郝建军,康宗利,于 洋.植物生理学实验技术[M].北京: 化工工业出版社,2007:68-72.
[11] 仝月澳,周厚基.果树营养诊断法[M].北京:农业出版社,1982.
[12] 胡位荣,张昭其,季作梁.酸处理对采后荔枝果皮色泽与生理活性的影响[J].食品科学, 2004,2(7):176-180.
[13] 楚爱香,张要战,王萌萌.四种槭树属(Acer)植物秋色叶变化与色素含量和可溶性糖的关系[J].江西农业大学学报,2013,35(01):108-111.
[14] 李向茂.小丑火棘秋冬转色期叶色变化的生理特性[J].上海交通大学学报:农业科学版, 2013,31(03):82-87.
[15] 钱见平,丰 震,王长宪,等.元宝枫无性系秋季叶片主要成分含量动态变化[J].中国农学通报,2013,(7):26-30.
[16] NAGIRA Y, OZEKI Y I. A system in which anthocyan synthesis is induced in regererated torenia shoots[J]. Journal of Plant Research, 2004, 117(5):377-383.
[17] 袁 明,万兴智,杜 蕾,等.红花檵木叶色变化机理的初步研究[J].园艺学报,2010,37(6):949-956.
[18] 胡静静,沈 向,李雪飞,等.黄连木秋季叶色变化与可溶性糖和矿质元素的关系[J].林业科学,2010,46(2):80-86.
[19] 唐前瑞,陈德富,陈友云,等.红檵木叶色变化的生理生化研究[J].林业科学,2006,42(2):111-115.
[20] 王欢利,刘新亮,曹福亮,等.金叶植物叶片特点及叶色成因的研究进展[J].林业科技开发,2013,37(4):17-22.
(责任编辑:梁保松)
Studiesonthepigmentcontentchangeruleintheleafcolorexpressionperiodof3groupsofleafcolorZelkovaschneideriana
LIU Xue-mei, JIN Xiao-ling, WANG Xiao-li, WANG Zheng
(College of Landscape Architecture, Central South University of Forestry and Technology, Changsha 410004, China)
Zelkovaschneiderianais one of the important color leaf landscape plants, for its beautiful leaf color in autumn. To clarify the mechanism of leaf color changes, this research has selected 3 groups ofZelkovaschneiderianawith different autumn leaf color, including the yellow group, the red group and the green group. The results are as follows: Their chlorophyll and carotenoid had similar change trend, the content of chlorophyll gradually reduced, and carotenoid contents were stability. The anthocyanin content of three color groups was different. The red groups’ anthocyanin content increased first and decreased later, and this trend was significantly different from the yellow and green groups whose content gradually reduced. Their soluble sugar’s change trends were consistent, and all of them increased first and then decreased. The trend of the ratio of total chlorophyll and carotenoid content changes had no significant difference. In the mean while, the change of red group’s ratio of total chlorophyll and the anthocyanin were quite different from the yellow and green groups, whose drop change had divided into three stages: fast descend-smooth-fast descend. But the red group maintained rapid decline. There are clearly relevant relationships between soluble sugar and synthesis of anthocyanin. The red group’s color expression was significantly correlated with the content of anthocyanin. And the yellow group’s color expression was related to the large variation of chlorophyll content and the ratio of chlorophyll and carotenoid. But the green group’s color expression was related to the high content of chlorophyll.
Zelkovaschneideriana; leaf color expression period; pigment content; anthocyanin
S 687
:A
2014-05-19
湖南省研究生科研创新项目(CX2012B329);中南林业科技大学研究生科技创新基金项目(CX2012B06);湖南省科技计划项目(2011NK3040)
刘雪梅,1986年生,女,四川泸州人,硕士研究生,从事园林植物与观赏园艺的研究.
金晓玲,1963年生,女,浙江东阳人,教授,博士研究生导师.
1000-2340(2014)05-0596-06
