α7尼古丁受体介导100Hz电针调节自然杀伤细胞活性的实验研究*
2014-09-26胡志苹黄志华
胡志苹,黄志华,黄 诚
(赣南医学院基础医学院,江西赣州341000)
α7尼古丁受体(Alpha 7nicotinic receptor,α7nAChR)在抗炎免疫反应中扮演着重要的角色。有实验表明,乙酰胆碱(acetyl choline,ACh)可抑制体外培养的脂多糖刺激引起的巨噬细胞释放 TNF、IL-6、IL-1β及IL-18,刺激迷走神经可抑制大鼠肝脏TNF的合成,降低炎症免疫反应[1],进一步的实验发现乙酰胆碱是通过与巨噬细胞膜上α7nAChR结合而发挥抑制炎性细胞因子的合成及分泌的作用[2]。小鼠外周血与脾组织的淋巴细胞可表达mAChRs和nAChRs[3],本实验也发现小鼠免疫细胞上有α7nAChR的表达[4]。以上实验结果提示,α7nAChR可能参与了电针(electroacupuncture,EA)调节免疫功能的作用,但其作用机制不清楚。为此,本研究应用α7nAChR抗体和特异性的α7nAChR拮抗剂α-银环蛇毒(αbungarotoxin,α-Bgt),进一步证实α7nAChR在电针对 NK细胞活性中的作用,旨在为EA的临床应用提供理论基础和参考。
1 材料与方法
1.1 材料 雄性昆明小鼠,体质量18~22g,由江西中医学院实验动物中心提供,自然照明,自由饮水、饮食。实验严格按照赣南医学院医学伦理委员会的相关规定。α-Bgt(T0195)购自Sigma公司;α7nAChR抗体(SC-5544)购自Santa Cruz生物科技有限公司。对小鼠进行分组,每组9只。(1)为检测α7nAChR抗体的作用,实验分6组:对照组、IgG组、α7nAChR抗体组、100Hz EA组、100Hz EA+IgG和100Hz EA+α7nAChR抗体组;(2)为检测特异性的α7nAChR拮抗剂α-Bgt的作用,实验分9组:对照组、1.5μg/mL a-Bgt组、3.0μg/mL a-Bgt组、扎针组(needle组)、扎针 +1.5μg/mL a-Bgt组、扎针+3.0μg/mL a-Bgt组、100Hz EA组、100Hz EA+1.5 μg/mL a-Bgt组和100Hz EA+3.0μg/mL a-Bgt组。
1.2 方法
1.2.1 EA刺激 分别给予小鼠双后肢的足三里和三阴交插针,并与HANSEA刺激仪相连,对照组于穴位附近扎针后不通电流,处理时间与100Hz EA组相同,刺激强度以0.5、1.0、1.5mA方式递增各刺激10min,共30min,每天1次,连续刺激3d。
1.2.2 脾脏NK细胞杀伤活性检测 靶细胞的制备:细胞培养24h后,1 000r/min,离心时间5min,弃上清液,加入2mL RPMI-1640培养液重悬,用苔盼蓝染色检测细胞活性应大于90%;细胞浓度调至5×105mL-1。效应细胞的制备:无菌取脾,用100目不锈钢筛机械分离,Hank′s液洗2次,以10%胎牛血清RPMI-1640培养液重悬,用苔盼蓝染色检测细胞活性应大于90%,调整细胞浓度为1×107mL-1。效-靶细胞作用:96孔培养板中各加入100μL YAC-1细胞及效应细胞,效-靶比为20∶1,另设效应细胞孔及靶细胞孔,均为3复孔,将培养板置于37℃、5%CO2温箱中培养20h,每孔加10μL MTT(5 mg/mL),37℃、5%CO2环境中培养4h。结果观察:取出培养板,2 000r/min,离心5min,弃上清液,加二甲基亚砜150 μL,震荡5min,酶标仪570nm读取光密度(OD)值,计算NK细胞的杀伤活性=[1-(实验孔OD值-效应细胞OD值)/靶细胞对照孔OD值]×100%。
1.3 统计学处理 采用Prism5.0统计软件进行分析,计量资料以表示。数据分析采用单因素方差分析并继之以Newman-Keuls检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 α7nAChR抗体对100Hz EA作用脾脏NK细胞活性的影响 在EA前,预先给予小鼠抗α7nAChR抗体后,观察100 Hz EA对小鼠NK细胞活性的影响。结果显示,分别与100 Hz EA组和100Hz EA+IgG组相比,100Hz EA+α7nAChR抗体组的NK细胞活性均明显增强,差异有统计学意义(P<0.05),见图1。

图1 α7nAChR抗体对100Hz EA作用脾脏NK细胞活性的影响
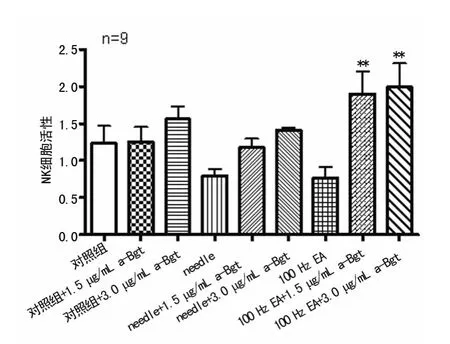
图2 α7nAChR特异性拮抗剂α-Bgt对100Hz EA作用脾脏NK细胞活性的影响
2.2 特异性的α7nAChR拮抗剂α-Bgt对100Hz EA作用脾脏NK细胞活性的影响 在EA前,分别给予小鼠不同剂量的特异性α7nAChR拮抗剂α-Bgt后,观察100Hz EA对小鼠NK细胞活性的影响。结果显示,与100Hz EA组相比,100Hz EA+1.5μgα-Bgt组和100Hz EA +3.0μgα-Bgt组均明显增强了NK细胞活性,差异有统计学意义(P<0.01),见图2。
3 讨 论
ACh作为神经递质在中枢和外周神经系统发挥信息传递的作用。近年来的研究显示,胆碱能系统在机体免疫调节中起重要作用。小鼠淋巴细胞表达 ACh、ChAT、mAChRs和nAChRs[3],淋巴细胞合成和释放的ACh可通过作用于免疫细胞上的mAChRs和nAChRs来发挥免疫调节作用[5],mAChRs和nAChRs参与了对细胞因子的调节作用(如IL-6)[6],这些证据均支持胆碱能系统参与了免疫功能调节过程。
在小鼠上存在16种不同的nAChRs亚单位(α1-7、α9-10、β1-4、δ、ε、γ),他们组成了多种具有不同结构和药理性质的同构五聚体和异构五聚体[7]。在淋巴细胞和巨噬细胞上主要表达nAChRs中 的 α2,α5-7,α10 和 β2 亚 单 位[8]。 在 这 些nAChRs的 亚 单 位 中,对 α7nAChR 的 研 究 较 多[9-10]。α7nAChR对免疫细胞起负反馈调节作用,这种作用主要是通过抑制TNF-α、IFN-γ和IL-6等细胞因子的合成和释放来实现的,而且发现在α7nAChR基因敲除小鼠血清中的致炎性细胞因子含量明显升高[11-12]。因此,目前认为7nAChR是胆碱能系统调节免疫反应的关键受体,它的兴奋介导了大部分的ACh在免疫系统中的效应[13]。
有研究表明,EA可提高刺激副交感神经的作用效果[14]。课题组前期研究结果提示,α7nAChR可能参与了100Hz EA对小鼠NK细胞活性的调节作用。因此,本实验选择α7nAChR作为研究EA通过胆碱能系统调节免疫功能的切入点。结果显示,连续3d给予100Hz EA刺激后,小鼠NK细胞活性明显降低。如预先给予抗α7nAChR的抗体后,再进行100Hz EA刺激,小鼠的NK细胞活性显著升高;同样,进一步应用特异性的α7nAChR拮抗剂α-Bgt的实验也观察到100Hz EA可显著地升高NK细胞活性[15]。以上结果提示,小鼠免疫细胞上的α7nAChR在100Hz EA调节NK细胞活性中发挥重要作用。
[1]Borovikova LV,Ivanova S,Zhang M,et al.Vagus nerve stimulation attenuates the systemic inflammatory response to endotoxin[J].Nature,2000,405(6785):458-462.
[2]Wang H,Yu M,Ochani M,et al.Nicotinic acetylcholine receptor alpha7subunit is an essential regulator of inflammation[J].Nature,2003,421(6921):384-388.
[3]Fujii T,Takada-Takatori Y,Kawashima K.Basic and clinical aspects of non-neuronal acetylcholine:expression of an independent,non-neuronal cholinergic system in lymphocytes and its clinical significance in immunotherapy[J].J Pharmacol Sci,2008,106(2):186-192.
[4]黄诚,韩立民.α7尼古丁受体参与100HzEA调节小鼠NK细胞活性[J].时珍国医国药,2012,23(5):1079-1081.
[6]Son YS,Park HJ,Kwon OB,et al.Antipyretic effects of acupuncture on the lipopolysaccharide-induced fever and expression of interleukin-6and interleukin-1beta mRNA in the hypothalamus of rats[J].Neurosci Lett,2002,319(1):45-48.
[7]Marubio LM,Changeux JP.Nicotinic acetylcholine receptor knockout mice as animal models for studying receptor function[J].Eur J Pharmacol,2000,393(1/3):113-121.
[8]De Rosa MJ,Dionisio L,Agriello E,et al.Alpha7nicotinic acetylcholine receptor modulates lymphocyte activation[J].Life Sci,2009,85(11/12):444-449.
[9]Fujii YX,Tashiro A,Arimoto K,et al.Diminished antigen-specific IgG1and interleukin-6production and acetylcholinesterase expression in combined M1and M5muscarinic acetylcholine receptor knockout mice[J].J Neuroimmunol,2007,188(1/2):80-85.
[10]Chernyavsky AI,Arredondo J,Galitovskiy V,et al.Structure and function of the nicotinic arm of acetylcholine regulatory axis in human leukemic T cells[J].Int J Immunopathol Pharmacol,2009,22(2):461-472.
[11]Kawashima K,Yoshikawa K,Fujii YX,et al.Expression and function of genes encoding cholinergic components in murine immune cells[J].Life Sci,2007,80(24/25):2314-2319.
[12]Stuckenholz V,Bacher M,Balzer-Geldsetzer M,et al.The α7nAChR agonist PNU-282987reduces inflammation and MPTP-induced nigral dopaminergic cell loss in mice[J].J Parkinsons Dis,2013,3(2):161-172.
[13]Gahring LC,Enioutina EY,Myers EJ,et al.Nicotinic receptor alpha7expression identifies a novel hematopoietic progenitor lineage[J].PLoS One,2013,8(3):e57481.
[14]Vukelic M,Qing X,Redecha P,et al.Cholinergic receptors modulate immune complex-induced inflammation in vitro and in vivo[J].J Immunol,2013,191(4):1800-1807.
[15]Thomsen MS,Mikkelsen JD.Theα7nicotinic acetylcholine receptor ligands methyllycaconitine,NS6740and GTS-21reduce lipopolysaccharide-induced TNF-αrelease from microglia[J].J Neuroimmunol,2012,251(1/2):65-72.
