短期冻存兔骨髓间充质干细胞对其生物特性的影响*
2014-09-26武成聪陈佳滨蔡伟良宁寅宽
武成聪,李 强,陈佳滨,茹 嘉,蔡伟良,宁寅宽
(桂林医学院附属医院骨科二病区,广西桂林541000)
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是组织工程中重要的种子细胞之一,大量具有良好分化能力的干细胞经多次传代后老化、分化能力下降或者死亡[1]。将良好分化能力BMSCs冻存则可在需要时及时复苏应用。而冻存复苏过程是否会对BMSCs生物特性、骨化潜能造成影响。本实验旨在探讨短期冻存兔BMSCs对其生物特征及其成骨分化能力的影响,为后期组织工程骨构建奠定基础。
1 材料与方法
1.1 材料 清洁级新西兰白兔3只,1月龄,体质量约0.5 kg,购于桂林医学院动物实验中心,实验过程符合动物伦理学要求[2]。
1.2 主要试剂 低糖DMEM、胰蛋白酶、胎牛血清购于美国Hyclone公司;MTT、维生素C、β-磷酸甘油、地塞米松购于韩国BIOSHARP公司;小鼠抗兔CD44/CD45单克隆抗体、小鼠抗兔IgG1、PerCP生物素标记山羊抗小鼠IgG(H+L)分别购于美国 ANTIGENIX、eBioscience、Jackson ImmunoResearch公司;小鼠抗兔CollagenⅠ购于武汉博士德生物工程有限公司;山羊抗小鼠IgG/辣根酶标记、DAB显色试剂盒购于北京中杉金桥公司;茜素红购于国药集团化学试剂有限公司;碱性磷酸酶(ALP)测试盒购于南京建成生物工程研究所。
1.3 方法
1.3.1 细胞分离、冻存 无菌条件下穿刺股骨大转子抽取骨髓、分离,界面层细胞以含15%胎牛血清的完全培养基,37℃、5%CO2、饱和湿度培养。48h后首次换液,细胞铺满瓶底80%左右传代。第5代加入冻存保护液,程序降温后液氮保存。30d后复苏培养,冻存后第10代BMSCs作为实验组;冻存期间再次分离原代细胞第10代BMSCs作为对照组。
1.3.2 MTT比色法测定吸光度(OD) 实验组、对照组各以2.5×103个/孔BMSCs接种96孔板,每组8个复制孔,按MTT检测流程操作,波长490nm下测定OD值,连续检测7 d,每天OD均值代表细胞增殖情况。
1.3.3 细胞周期检测 随机收集实验组、对照组各3皿细胞固定,流式细胞仪进行细胞周期检测。重复3次,得出细胞各周期的百分率并计算增殖指数(PI)=(S+G2M)/(G0/1+S+G2M)。
1.3.4 BMSCs表型检测 选取实验组、对照组每组各3皿细胞,设空白管、同型对照管、实验管,按操作说明分别标记CD44/45-PerCP,流式细胞仪检测。重复3次,各组阳性率做统计分析。
1.3.5 成骨分化检测 实验组和对照组各以105个/孔接种6孔板(免疫组织化学、茜素红组作爬片处理)。细胞铺满瓶底80%后更换成骨诱导液(含10nmol/L地塞米松,15mmol/L维生素C,10mmol/Lβ-磷酸甘油)作不传代培养诱导7、14d,各组取3孔,按ALP试剂盒说明操作,计算ALP水平。第14天,每组3张细胞爬片,Ⅰ型胶原免疫组织化学染色(SP法)。Image-Pro Plus(IPP)图像软件取3个区域测量(100倍,九点法),平均光密度代表单位面积Ⅰ型胶原水平。第21天茜素红染色,IPP以红色结节为标志分析钙结节面积(总像素数)。均重复3次。
1.4 统计学处理 采用SPSS11.0统计软件进行分析,对各组数据作两独立样本t检验,计量资料以表示,以P<0.05为差异有统计学意义。
2 结 果
2.1 BMSCs培养情况 原代分离48h后首次换液,镜下贴壁细胞即为BMSCs,数量较少,呈短梭状,散在集簇状分布,随培养时间延长及传代后细胞形成大量的小集落,呈长梭状,汇合成片,旋涡状排列(图1A);实验组细胞复苏后24h内细胞可贴壁,不贴壁细胞数目较对照组增加,细胞梭形,较瘦长,部分细胞出现老化,总体而言细胞生长情况影响不大(图1B)。

图1 冻存前后兔BMSCs生长情况(×40)
2.2 MTT检测OD值 实验组细胞生长潜伏期延长,MTT检测OD值从第3天开始增加(即细胞增殖速度),第4天后增殖速度能够与对照组持平,差异无统计学意义(P>0.05,n=8),随后进入平台期,见表1。
2.3 BMSCs表面标志 实验组、对照组表面抗原阳性率分别为 CD44:93.62% ±1.05%、93.95% ±0.71%;CD45:0.24%±0.11%、0.29%±0.10%,二者差异无统计学意义(P>0.05),冻存复苏对BMSCs表面抗原无明显影响,细胞并未因冻存而发生变异,见图2。
表1 MTT检测OD值±s)

表1 MTT检测OD值±s)
组别0±0.13 0.47±0.06 0.53±0.07对照组 0.03±0.00 0.06±0.00 0.18±0.04 0.38±0.03 0.48±0.07 0.53±0.08 0.54±0.07 P 1d 2d 3d 4d 5d 6d 7d实验组 0.03±0.00 0.03±0.00 0.08±0.01 0.29±0.05 0.4 0.21 0.00 0.00 0.00 0.14 0.17 0.81
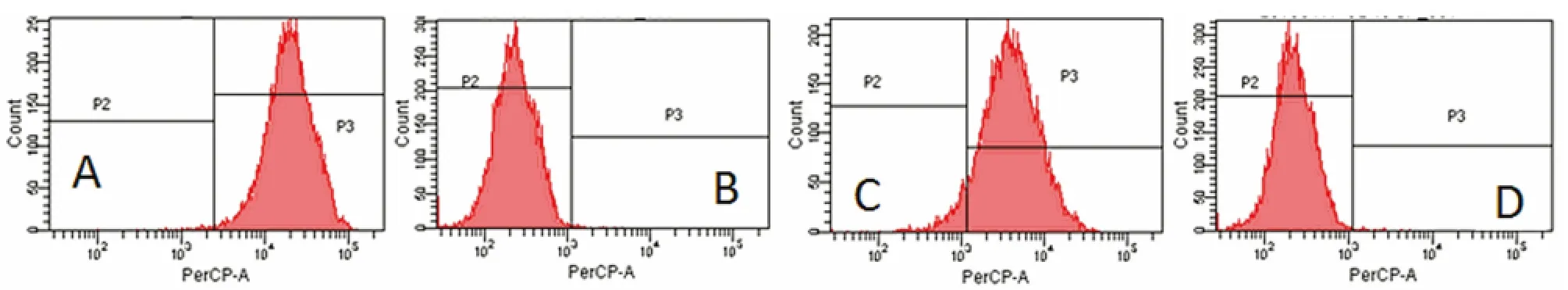
图2 第10代BMSCs表面标志表达情况
2.4 BMSCs周期检测 实验组与对照组G1、S、G2/M期的细胞比例及PI比较,差异无统计学意义(P>0.05),见表2。
表2 第10代BMSCs各期细胞比例±s,%)

表2 第10代BMSCs各期细胞比例±s,%)
组别 G1 S G2 57.00±3.47 33.70±3.17 9.29±0.52 42.9±3.4对照组 56.84±2.27 34.20±0.94 8.93±2.41 43.0±2.3 P PI实验组0.933 0.756 0.768 0.960
2.5 ALP表达情况 实验组和对照组经成骨诱导后7、14d,随诱导时间增加ALP水平呈递增趋势,两个时间点实验组和对照组ALP水平变化差异无统计学意义(P>0.05),见表3。>
2.6 Ⅰ型胶原SP法检测 成骨诱导14d,实验组和对照组Ⅰ型胶原染色均呈阳性表达,细胞胞质出现棕黄色颗粒,大小形态均一(图3)。经冻存后BMSCsⅠ型胶原蛋白表达量(平均光密度分析)变化与未冻存组相比,差异无统计学意义(P>0.05),见表4。
表3 成骨诱导后第7、14天ALP水平±s,U/gprot)

表3 成骨诱导后第7、14天ALP水平±s,U/gprot)
组别6.73±1.92 15.99±4.36对照组 6.76±0.91 16.41±2.22 P 7d 14d实验组0.97 0.79
2.7 钙结节茜素红染色 实验组和对照组成骨诱导分化培养到约10d细胞呈梭形表面粗糙,细胞间隙紧密,细碎颗粒、扁平样改变,14d左右漩涡中心形成细胞团,21d形成钙化结节,肉眼可见培养皿底散在白色状物,染色后均为红色(图4),两组钙结节面积差异无统计学意义(P>0.05),见表4。
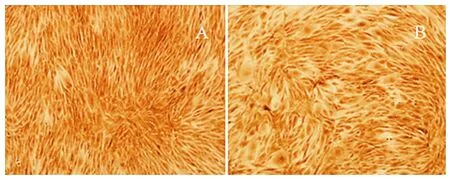
图3 成骨诱导后14dⅠ型胶原染色(SP×100)
表4 Ⅰ型胶原、钙结节染色情况±s)

表4 Ⅰ型胶原、钙结节染色情况±s)
组别 平均光密度 钙结节面积(像素)0.442±0.022 1 055 811.0±199 798.5对照组 0.456±0.015 1 155 874.0±222 157.3 P实验组0.16 0.32
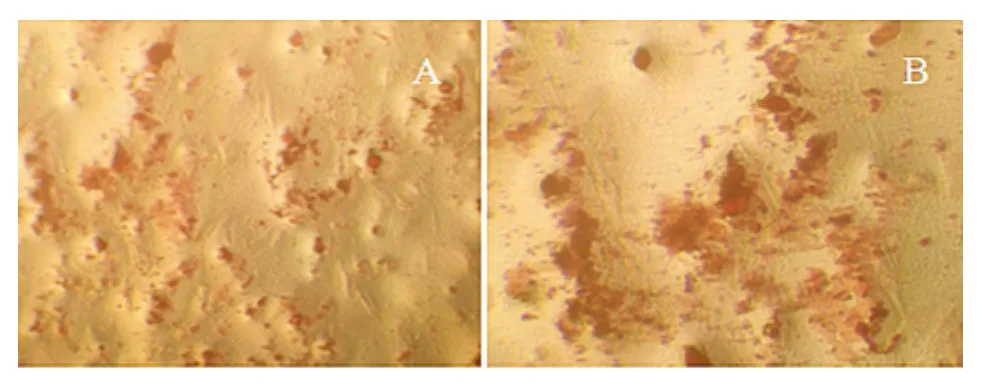
图4 导后21d钙结节茜素红染色(×100)
3 讨 论
BMSCs在特定的条件下能向骨、软骨、脂肪、肌等细胞分化[3]。本研究采用密度梯度离心法[4]成功分离兔BMSCs,其生长状态良好,能够满足后期骨组织工程种子细胞的要求。而BMSCs体外实验中,其随传代增加会使细胞老化、分化能力逐渐下降或者死亡[5]。低温冻存BMSCs则是存贮种子细胞的有效途径,理论上在-196℃及冻存保护液作用下细胞生化反应与活力代谢基本静止,可无限期冻存细胞[6]。但实际效果不佳,冻存时细胞所处环境对细胞影响较大,其机制可能为溶质反应导致[7]。本实验中,短期冻存BMSCs后,虽然生长增殖速度较对照组缓慢,但细胞状态并未发现明显变化,其增殖能力能与对照组相当。细胞周期中实验组和对照组的绝大部分BMSCs处于G1期,具有较强的增殖分化能力,冻存后仍具有典型的干细胞增殖特点。
骨髓由多组细胞系组成,对于实验分离得到及后续冻存复苏后的BMSCs,是否是种子细胞或者其生物特征是否因细胞冻存过程而改变[8]。本研究通过标记细胞阳性表达的CD44和阴性表达的CD45检测发现,通过密度梯度离心法获得的靶细胞为BMSCs,实验组对照组CD44阳性率均超过90%,不表达的CD45,经统计分析说明了经过短期冻存后的BMSCs并没有发生分化或变异。
BMSCs成骨、成软骨、成脂分化这一生物特性可以用来鉴定其多向分化潜能[9-10]。BMSCs的成骨分化必须在特定条件下进行,特定的化学物质(β-磷酸甘油、地塞米松、维生素C等)可促使BMSCs向成骨细胞分化并能通过骨化标志性产物ALP、Ⅰ型胶原、矿化结节等验证[11]。ALP高表达是成骨过程中成熟成骨细胞特异性标志之一[12];Ⅰ型胶原蛋白分泌量增加标志着BMSCs向成骨细胞系分化[13];细胞外基质钙化与Ca2+沉积是成骨分化的终末期表现[14]。本研究发现,实验组和对照组的BMSCs,其ALP表达量均随诱导时间的增加而相应增加;在相同时间点,实验组、对照组Ⅰ型胶原蛋白均呈阳性表达,对比光密度发现其表达量并未因冻存细胞而改变。同样,钙结节染色也印证了低温冷冻过程并未使BMSCs成骨分化能力发生质的改变。
综上所述,本实验旨在为临床或实验研究缩短反复培养鉴定BMSCs的实验周期,采用密度梯度离心法成功获得纯度较高的兔BMSCs,在其处于最佳状态时给予冻存复苏检测其生物特征及成骨能力是否受到影响。本研究结果显示,兔BMSCs在短期冻存后其增殖、生物特征及成骨分化潜能无明显变化,复苏后可用于进一步研究和应用。
[1]Guo KT,SchAfer R,Paul A,et al.A new technique for the isolation and surface immobilization of mesenchymal stem cells from whole bone marrow using high-specific DNA aptamers[J].Setm Cells,2006,24(10):2220-2231.
[2]中华人民共和国科学技术部.关于发布《关于善待实验动物的指导性意见》的通知[J].畜牧兽医科技信息,2007,23(4):35-36.
[3]Friedenstein AJ,Chailakhyan RK,Gerasimov UV.Bone marrow osteogenic stem cells:in vitro cultivation and transplantation in diffusion chambers[J].Cell Tissue Kinet,1987,20(3):263-272.
[4]沈兴,余更生,田杰,等.兔骨髓间充质干细胞体外分离培养及冻存研究[J].实用医学杂志,2006,22(9):996-997.
[5]Lippens E,Cornelissen M.Slow cooling cryopreservation of cell-microcarrier constructs[J].Cells Tissues Organs,2010,192(3):177-186.
[6]Rust PA,Costas C,Cannon SR,et al.Characterisation of cryopreserved cells freshly isolated from human bone marrow[J].Cryo Letters,2006,27(1):17-28.
[7]雷香丽.大鼠骨髓间充质干细胞的体外培养及体内移植实验性研究[D].广州:南方医科大学,2012.
[8]McCarty RC,Gronthos S,Zannettino AC,et al.Characterisation and developmental potential of ovine bone marrow derived mesenchymal stem cells[J].J Cell Physiol,2009,219(2):324-333.
[9]Baksh D,Song L,Tuan RS.Adult mesenchymal stem cells:characterization,differentiation,and application in cell and gene therapy[J].J Cell Mol Med,2004,8(3):301-316.
[10]Tuli R,Tuli S,Nandi S,et al.Transforming growth factor-beta-mediated chondrogenesis of human mesenchymal progenitor cells involves N-cadherin and mitogen-activated protein kinase and Wnt signaling cross-talk[J].J Biol Chem,2003,278(42):41227-41236.
[11]Qu D,Li J,Li Y,et al.Angiogenesis and osteogenesis enhanced by bFGF ex vivo gene therapy for bone tissue engineering in reconstruction of calvarial defects[J].J Biomed Mater Res A,2011,96(3):543-551.
[12]Collignon H,Davicco MJ,Barlet JP.Isolation of cells from ovine fetal long bone and characterization of their osteoblastic activities during in vitro mineralization[J].Arch Physiol Biochem,1997,105(2):158-166.
[13]Salasznyk RM,Williams WA,Boskey A,et al.Adhesion to vitronectin and collagen I promotes osteogenic differentiation of human mesenchymal stem cells[J].J Biomed Biotechnol,2004,2004(1):24-34.
[14]Klees RF,Salasznyk RM,Kingsley K,et al.Laminin-5induces osteogenic gene expression in human mesenchymal stem cells through an ERK-dependent pathway[J].Mol Biol Cell,2005,16(2):881-890.
