洱海苦草(Vallisneria natans)水深分布和叶片C、N、P化学计量学对不同水深的响应*
2014-09-25朱天顺张霄林倪乐意
李 威,何 亮,朱天顺,曹 特,张霄林,倪乐意
(1:中国科学院水生生物研究所东湖湖泊生态系统试验站,武汉430072)(2:中国科学院大学,北京100049)
沉水植物是湖泊中重要的初级生产者,在维持清水稳态方面发挥着独特的作用[1].水深波动是湖泊重要的水文特征,对湖泊生态系统有着重要的影响[2].水深变化可导致光照、风浪和底泥等特征发生相应变化,是影响沉水植物生长、繁殖与分布的综合环境因子[3].沉水植物定植的水深范围在不同类型的湖泊中差异很大,如在贫营养的抚仙湖中沉水植物定植的最大水深超过10 m,在中-富营养的洱海中,沉水植物定植的最大水深不超过6 m,并且近年来沉水植物定植深度在不断变小[4-5],其中水体消光系数增大造成的弱光限制是导致深水区沉水植物衰退甚至消亡的重要因素.为了适应水位的变化,沉水植物面临着生存与扩张的权衡(trade-off),各个构件的生物量分配、株高和分株数变化等表现出很强的形态可塑性[6].符辉等[3]的研究表明,随水深的增加苦草(Vallisneria natans)的生物量、无性系分株数均显著降低,而株高随水深梯度呈先升高后降低的趋势,其他沉水植物如刺苦草(V.spiralis)[7]、马来眼子菜(Potamogeton malaianus)[8-9]、菹草(P.crispus)[10-11]、狐尾藻(Myriophyllum spicatum)[2]、黑藻(Hydrilla verticillata)[12]等的相关研究也有类似的趋势.
水深变化对沉水植物生理生化也会产生一定的影响.如何伟等[10]的研究表明,水深差异显著影响了菹草叶片光合电子传递速率及光响应曲线;刘伟龙等[8]的研究表明,水深对马来眼子菜体内氮和磷含量也有很大影响,陈正勇等[11]的研究表明在水深3 m以下,菹草的叶绿素含量显著增加.然而目前关于水深对沉水植物生理生化方面(特别是碳(C)、氮(N)和磷(P)生态化学计量学)的研究仍然比较缺乏,而且多集中在室内模拟实验或富营养化水体中,由于条件限制,设置的水深梯度较小(多集中在0.5~2.0 m之间)[7-10],导致研究结果有很大局限性,如何伟等[10]设置水深范围为0.3~1.8 m,结果显示水深差异对菹草叶片光合色素影响不明显;陈正勇等[11]设置水深范围为0.5~4.0 m,结果显示在水深3 m以下,菹草的叶绿素含量开始显著增加.野外调查研究能够客观反映不同水深长期作用下沉水植物的自然生存状态和对生境适应的结果,对野外生境下沉水植物生理生化对水深的响应进行研究有助于理解或阐明沉水植物对水深的适应机制,同时对于湖泊水位调控、沉水植被修复也具有重要参考作用.
苦草是中国比较常见的沉水植物,广泛分布于淡水生态系统中,它能定植于不同水深环境中,但在不同水深下形态差异较大[3].洱海是一个中-富营养的高原湖泊,沉水植物物种丰富,近年来微齿眼子菜(P.maackianus)和苦草成为洱海优势种[5],虽然微齿眼子菜的平均生物量要大于苦草,但是苦草分布的水深范围和频度则大于微齿眼子菜(李威等,未发表).本研究通过对云南洱海沉水植物苦草水深分布情况进行调查,并对定植于不同水深的苦草叶片中C、N和P含量及其比率进行分析,以阐明水深梯度对苦草生态化学计量学的影响.
1 材料和方法
1.1 现场调查、样品采集及测定方法
于2011年6-7月沿洱海湖滨均匀设置98个采样断面,调查洱海水生植物的分布情况,每个断面用赛氏盘测量透明度,用水下照度仪(Li-COR UWQ-192S,Li-Cor,Lincoln,NE)测量水下光合有效辐射(photosynthetic active radiation,PAR),并取表层水样带回实验室测量总氮和总磷含量.每个断面由岸边向湖心沿水深梯度设置采样点,每个采样点用自制的水下镰刀(采集面积约0.2 m2)采集沉水植物,重复3个样方,每个样方内植物按种类分开,洗去泥沙和附着物,沥干浮水,用杆秤称量每种沉水植物的鲜重.共采集到有苦草的样方738个,水深分布范围为0.5~5.6 m,选取其中33个苦草分布较多的断面(图1),每个断面按水深梯度取少量苦草叶片装进自封袋并编号带回实验室.设置5个水深梯度范围,编号为1~5(1代表0.5~1.4 m,2代表1.5 ~2.4 m,3 代表2.5 ~3.4 m,4 代表3.5 ~4.4 m,5 代表4.5 ~5.4 m),分别采集到18、18、29、17、8 个苦草叶片样品,合计90个,在烘箱里烘干至恒重,用研钵磨碎,用元素分析仪(Flash EA 1112 series,CE Instru-ments,Italy)测定 C、N 含量,用硫酸-过氧化氢消解、钼锑抗分光光度法测定P含量.
1.2 统计方法
苦草随水深梯度i分布的频度Fi和相对生物量Br计算公式分别为:

式中,Ni是苦草出现在水深梯度i范围内的样方数,Ns是苦草的总样方数,Bi是水深梯度i范围内样方中苦草地上部分的总生物量,Bs是所有样方中苦草地上部分的总生物量.
水深z处的消光系数Kd计算公式为[13]:

式中,I0为表层光合有效辐射,Iz为水深z处的光合有效辐射.
采用 Microsoft Excel 2010和 SPSS 16.0 Software Package分析数据和作图,水深对苦草C、N、P及其比率的影响用Oneway ANOVA分析,苦草N、P含量关系显著性采用Pearson相关分析.生物量数据均为鲜重,苦草叶片C、N、P含量均为单位质量浓度,C∶N、C∶P和N∶P均为质量比.
图1 洱海采样断面分布Fig.1 Distribution of sampling transects in Lake Erhai
2 结果
2.1 洱海环境指标及苦草分布特征
所调查的33个断面水体表层平均总氮含量为0.769 ±0.419 mg/L,总磷含量为 0.011 ± 0.007 mg/L,水体平均透明度为 1.71 ±0.28 m,调查区域苦草定植的水深范围为0.5~5.6 m,平均消光系数为0.941±0.215,水体表层平均光合有效辐射约为936 μmol/(m2·s),0.5 ~1.4 m 范围内平均光照强度约为表层的39.7%,1.5~2.4 m 范围内平均光照强度约为表层的16.0%,2.5~3.4 m 范围内平均光照强度约为表层的6.2%,3.5~4.4 m范围内平均光照强度约为表层的3.5%,4.5~5.6 m范围内平均光照强度仅为表层的1.9%.苦草分布的频度和相对生物量均随水深梯度呈先升高后降低的趋势,在 1.5~2.4 m范围内达到最大频度(31.3%),在2.5 ~3.4 m 范围内达到最大相对生物量(31.2%)(图2).
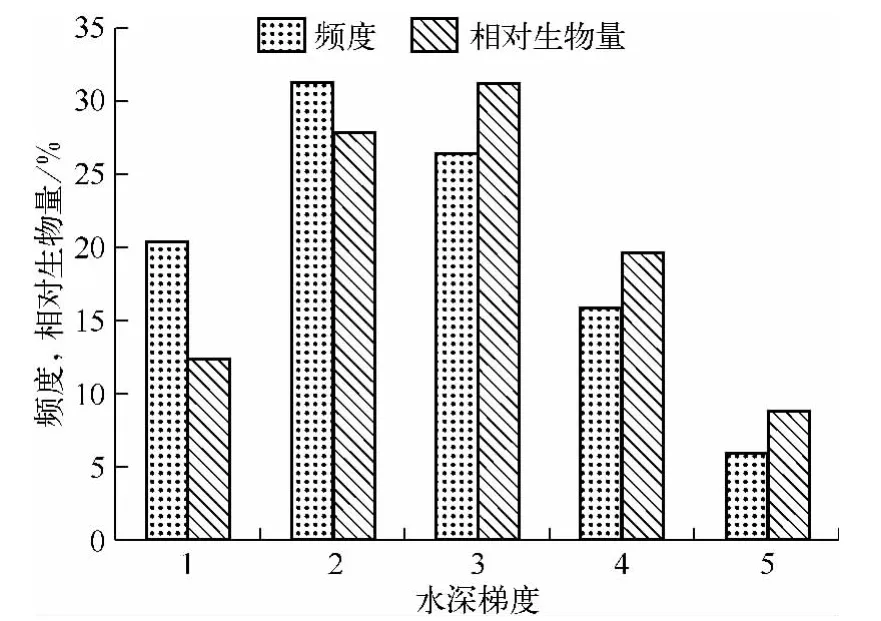
图2 苦草分布的频度和相对生物量沿水深梯度的变化Fig.2 Frequency and relative biomass of V.natans along water depth gradient
2.2 苦草叶片C、N、P生态化学计量学特征
苦草叶片的C、N、P含量和C∶N、C∶P、N ∶P值均呈正态分布.苦草叶片的C含量平均为356.10±8.85 mg/g,范围为335.90 ~375.07 mg/g;苦草叶片 N 和 P 含量平均值分别为 26.13 ±5.40 mg/g和3.54 ±1.15 mg/g,范围分别为12.81~37.94 mg/g和1.40~6.37 mg/g.C 含量的变异系数较小,N、P 含量及 C ∶N、C∶P、N∶P值的变异系数均较大(图3).
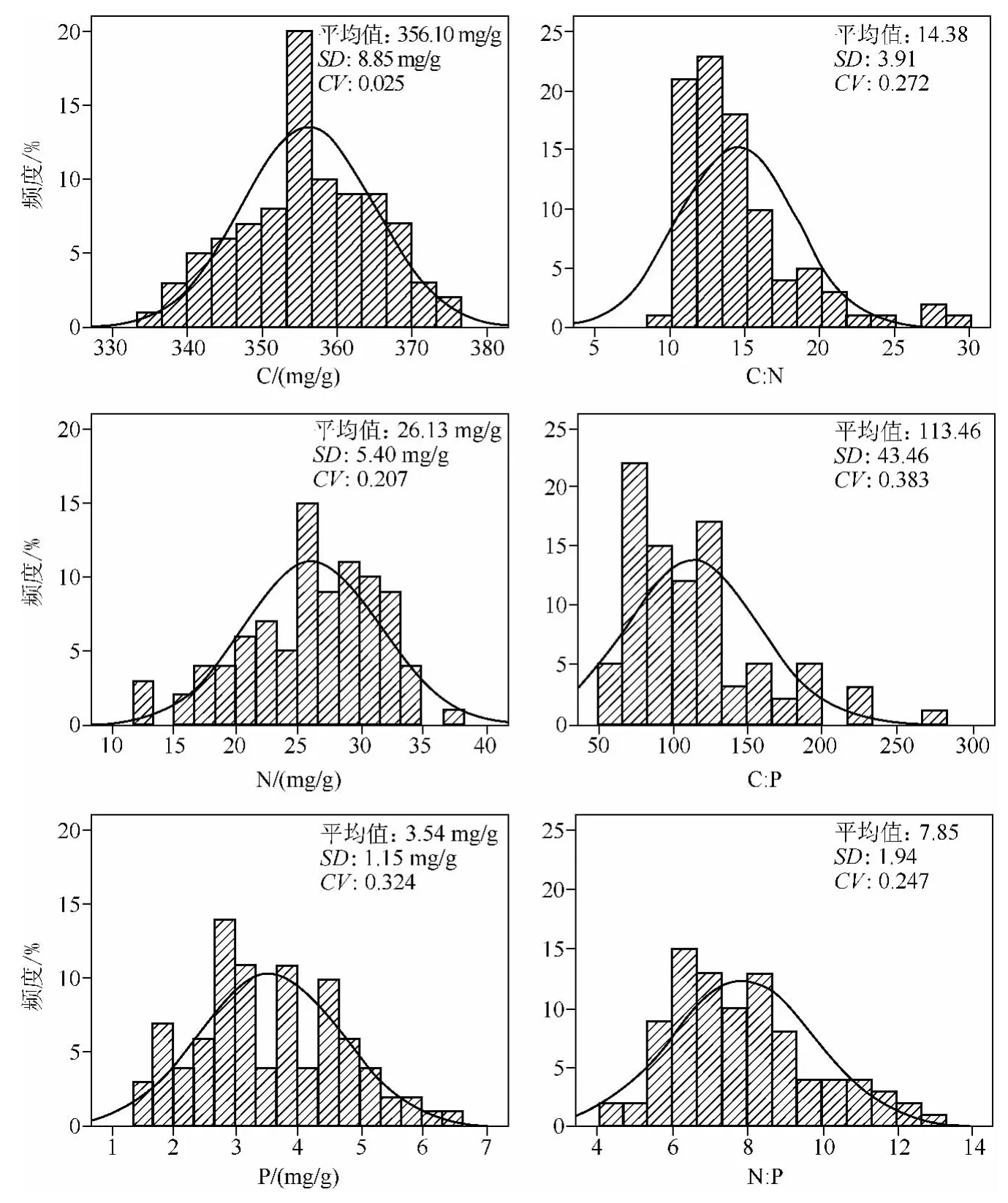
图3 苦草叶片C、N、P含量及C∶N、C∶P、N∶P值的频率分布直方图(SD为标准偏差;CV为变异系数,是标准偏差与平均值的比值)Fig.3 Histograms showing the distribution of leaf C,N,P concentrations and their mass ratios for V.natans(Curves indicate fitted log-normal curves;SD:standard deviation;CV:coefficient variation,defined as the ratio of SD to mean value)
2.3 苦草叶片C、N、P含量及其比率随水深的变化趋势
苦草叶片的C含量在水深梯度1、2和3处随水深的增加而降低,水深梯度3、4和5处C含量没有显著差异(P>0.05),水深梯度5相对于水深梯度1,C含量下降了3.8%;苦草N含量在水深梯度1、2和3处无显著差异(P>0.05),但水深梯度3、4和5处N含量要显著高于水深梯度1(P<0.05),约增加了36.1%;苦草P含量随水深的增加呈上升趋势,但水深梯度2和3之间、4和5之间P含量没有显著差异(P>0.05),水深梯度5相对于水深梯度1,P含量增加了82.4%;苦草叶片C∶N、C∶P随水深梯度的变化趋势和N、P的变化趋势相反,N∶P在水深梯度2~5处没有显著差异(P>0.05),但水深梯度1处要显著高于梯度2~5处(P <0.05,图4).
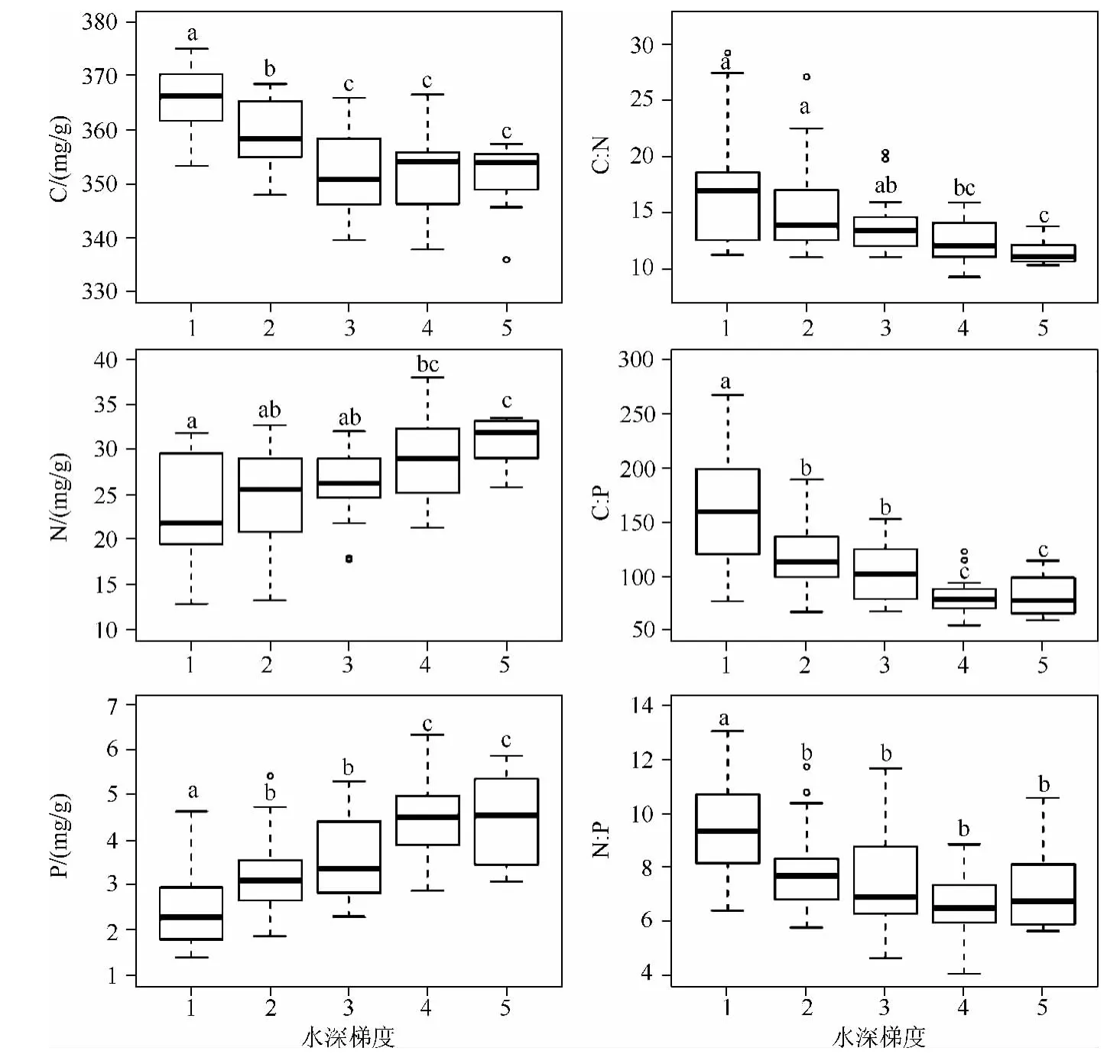
图4 苦草叶片C、N、P及其比率随水深梯度变化的箱线图(虚线的上下端代表最大值和最小值;矩形的上下端代表上四分位数和下四分位数;中间横线为中位数;空心圆代表异常值;字母不同表示差异显著,P<0.05)Fig.4 Box plots of leaf C,N,P concentrations and their mass ratios for V.natans along water depth gradient(The top and bottom of dashed lines indicate maximum and minimum values;The top and bottom of boxes indicate upper and lower quartiles;Lines in the boxes indicate median values;Different letters indicate significant differences among water depth gradients in the level of P <0.05)
2.4 苦草叶片N、P含量在各水深梯度处的耦合关系
苦草叶片N、P含量在各个水深梯度均呈显著正相关(P<0.05),但浅水处(0.5~2.4 m)的相关性(R2>0.5,P≤0.001)要大于深水处(2.5 ~5.6 m)的相关性(R2<0.2,P <0.05)(图5).
3 讨论

图5 苦草叶片N、P含量在各水深梯度处的耦合关系((a)0.5 ~1.4 m;(b)1.5 ~2.4 m;(c)2.5 ~3.4 m;(d)3.5 ~5.6 m)Fig.5 Scatter plots showing relationships between leaf N and P concentrations of V.natans in different water depths(0.5-1.4 m(a),1.5-2.4 m(b),2.5-3.4 m(c)and 3.5-5.6 m(d))
水下光照是沉水植物生长的基本环境因子之一,湖底光照占表层光照的百分比决定了沉水植物定植的深度,湖泊底部的光照强度一般要大于湖泊水面光照强度的1%~3%才能维持沉水植物的正常生长[14-16].本研究调查得到2011年苦草在洱海分布的最大水深为5.6 m,而4.5~5.6 m水深范围内水体平均光照仅为表层的1.9%,这表明5.6 m可能已经是洱海苦草分布的极限水深.本研究中洱海1.5~2.4 m水深范围内平均光照为表层光照的16.0%;2.5~3.4 m水深范围内平均光照为表层光照的6.2%,苦草在这两个水深范围内达到最大频度和相对生物量,这表明苦草在洱海中的最适生长深度在1.5~3.4 m水深范围内,这应该是苦草长期适应洱海生境、经过洱海各种环境因子自然选择而达到的最适生长深度.水深过低,沉水植物的垂直生长受到限制,且光照过强也会对植物造成一定损伤,如何伟等[10]的研究表明,浅水处(水深低于0.6 m)菹草叶片光系统Ⅱ最大光化学量子产量及光合电子传递速率均低于深水处;水深过高,光照不足、底泥厌氧等同样会限制沉水植物的生长,这二者之间的权衡导致沉水植物在中等梯度的水深下达到最大优势度.另外,苦草的半饱和光强为147 μmol/(m2·s)(李威等,未发表),约为洱海表层光照的15.7%,在1.5~2.4 m水深范围内,这表明洱海1.5~2.4 m水深范围的光照条件最适合苦草生长,苦草在这个水深范围分布最多(即频度最大),但是苦草的最大相对生物量却出现在水深2.5~3.4 m之间,推测其原因可能是多方面因素共同造成的.植物通过克隆觅食(在营养丰富的斑块发育更多的分株)和根觅食(在营养丰富的斑块上增生更多的根)能够大幅度增加营养的获取[17],Xiao等[18]的研究表明,刺苦草能够通过克隆觅食趋向有利生境(如营养丰富、光线充足的生境),逃脱有害生境(如营养贫乏、光线较弱的生境).根据我们的调查,在洱海东部区域,湖岸带坡度较大,水底石头较多,受风浪扰动较大,且浅处底泥多为砂质底,营养较深处贫乏,这对苦草的大量增殖相当不利,因而可能导致苦草通过“觅食效应”定植到适当水深处(如2.5~3.4 m),从而在这一水深范围达到最大的生物量;在其他受风浪扰动较小的湖湾区域,虽然浅水区营养丰富,但是水生植物种类也较多,竞争激烈,且多为菱、荇菜、浮萍等浮叶/漂浮植物及其他能形成冠层的沉水植物,水下光照被严重削减,对于苦草这种莲座型沉水植物尤为不利,虽然在浅水处苦草也均有分布,但生物量较小,2.5~3.4 m水深范围竞争相对较少,可能更适合苦草的克隆生长.
相关研究表明,水深能够影响水体多个指标,如水温、pH、DO、光照、营养、叶绿素、底泥、风浪等,其中水体光照受到的影响最大[2-3,7-8,19],本研究也发现水体光照随着水深梯度的增加而呈指数下降.Li等[20]的研究发现,遮光处理下苦草N含量显著高于不遮光处理,C含量在两个处理下变化不大,所以弱光条件下苦草C∶N显著低于高光条件.黎慧娟等[21]的研究也表明苦草叶中N、P含量随光照的减弱而增加.本研究中深水区苦草N、P含量显著高于浅水区,这与Li等[20]和黎慧娟等[21]研究得到的弱光条件下N、P变化趋势相似,表明水深对苦草叶片N、P的影响主要是由水深造成的弱光引起的.本研究中苦草叶片C含量浅水区显著高于深水区,这可能不仅仅是光照变化引起的,因为Li等[20]的研究表明遮光与不遮光处理之间苦草C含量变化不大,Cronin等[16]对眼子菜属沉水植物P.amplifolius的研究也表明光照处理对其组织C含量没有影响.我们推测,这可能是由浅水区和深水区溶解性无机碳(DIC)的差异造成的,CO2在水体中的传播速率远低于空气,并且DIC经过叶片表面的边界层面临的阻力也相当大,这使得DIC成为沉水植物生长的一种限制因子[22-23].浅水区受风浪影响要大于深水区,风浪加速了空气和水体的CO2交换,同时也降低了叶片与湖水CO2交换的阻力,所以浅水区的苦草能利用的CO2要显著多于深水区,并且浅水区光照情况也优于深水区,这可能导致浅水区苦草光合作用和C获取都大于深水区,浅水区苦草的叶片C含量要高于深水区.另外,Yan等[24]发现CO2浓度升高,刺苦草叶片N、P含量因受到生物稀释而降低,本研究中浅水区苦草叶片N、P含量低于深水区的结果与之也吻合.
苦草叶片C含量的变异较N、P小,所以C∶N和C∶P主要是由N、P含量决定的,C∶N和C∶P随水深的变化趋势与N、P相反,这与海草的研究结果相似[25].N∶P受水深变化的影响较小,除水深梯度1外,其他4个水深梯度苦草叶片N∶P变异较小.而水深梯度1处苦草叶片N∶P变异比较大的原因可能是由于这个梯度苦草叶片P含量较小,至于P含量低则可能与浅水处底泥P的可利用性低有关.需要指出的是,虽然苦草N、P含量随水深变化表现出了一定的变异性,但要远小于苦草形态随水深变化的可塑性,如苦草叶片N、P含量在不同水深下的变化不超过1倍,而其生物量、株高和分株数等在不同水深下的变化可能超过5倍[3],这表明苦草生态化学计量学具有一定的内稳性.
N和P是植物新陈代谢活动(如光合作用和呼吸作用等)中必不可少的生命元素,一般来说,无论是陆生植物还是水生植物,植物组织N、P含量是紧密耦合在一起的[26-28],本研究还发现一个有趣的现象,水深的增加使得苦草叶片N、P含量的耦合性变弱,这可能是苦草在深水区N、P的不均衡积累或代谢失衡引起的,苦草叶片N、P含量虽然都随水深的增加而增加,但是二者增加的速度却是不同步的,如,相对于水深梯度1,水深梯度5处苦草的N含量增加了36.1%,P含量增加了82.4%,同时,深水区苦草N和P的变异系数均小于浅水区,这表明深水区苦草叶片N、P含量发生了“聚敛”,具有趋同性,这种趋同性也降低了N和P之间的耦合性.
综上所述,苦草对水深(光照)的适应能力很强,也正因为如此,苦草在富营养湖泊生态修复中常被用作先锋种,必须注意的是,随着水体光照条件的不同苦草的最适生长水深也不同,这提示我们在苦草的恢复工程中要注意苦草生长水深的选择,需要根据被修复水体的光照条件和水文特征综合考虑.另外,水深的增加加剧了弱光和低含量溶解性无机碳限制,使得苦草生长率下降,这可能是导致苦草叶片C含量下降、N和P含量上升的主要原因,从而造成其C∶N∶P生态化学计量学失衡,但尚需要进一步的实验验证.
[1]Scheffer M,Redelijkheid MR,Noppert F.Distribution and dynamics of submerged vegetation in a chain of shallow eutrophic lakes.Aquatic Botany,1992,42:199-216.
[2]柏 祥,陈开宁,任奎晓等.不同水深条件下狐尾藻生长对沉积物氮磷的影响.生态环境学报,2011,20(6/7):1086-1091.
[3]符 辉,袁桂香,曹 特等.水深梯度对苦草(Vallisneria natans)克隆生长与觅食行为的影响.湖泊科学,2012,24(5):705-711.
[4]熊 飞,李文朝,潘继征等.云南抚仙湖沉水植物分布及群落结构特征.云南植物研究,2006,28(3):277-282.
[5]符 辉,袁桂香,曹 特等.洱海近50a来沉水植被演替及其主要驱动要素.湖泊科学,2013,25(6):854-861.
[6]Strand JA,Weisner SEB.Morphological plastic responses to water depth and wave exposure in an aquatic plant(Myriophyllum spicatum).Journal of Ecology,2001,89:166-175.
[7]袁龙义,李守淳,李 伟等.水深对刺苦草生长和繁殖策略的影响研究.江西师范大学学报:自然科学版,2007,31(2):156-160.
[8]刘伟龙,胡维平,翟水晶等.水深对马来眼子菜生长及氮磷去除效果的影响.南京林业大学学报:自然科学版,2008,32(4):11-16.
[9]翟水晶,胡维平,邓建才等.不同水深和底质对太湖马来眼子菜(Potamogeton malaianus)生长的影响.生态学报,2008,28(7):3035-3041.
[10]何 伟,王国祥,杨文斌等.水深梯度对菹草生长的影响.生态学杂志,2009,28(7):1224-1228.
[11]陈正勇,王国祥,吴晓东等.不同水深条件下菹草(Potamogeton crispus)的适应对策.湖泊科学,2011,23(6):942-948.
[12]吴晓东,王国祥,陈正勇等.水深梯度对黑藻生长的影响.生态与农村环境学报,2011,27(4):40-45.
[13]Krause-Jensen D,Sand-Jensen K.Light attenuation and photosynthesis of aquatic plant communities.Limnology and Oceanography,1998,43(3):396-407.
[14]Duarte CM.Seagrass depth limits.Aquatic Botany,1991,40:363-377.
[15]Squires MM,Lesack LFW,Huebert D.The influence of water transparency on the distribution and abundance of macrophytes among lakes of the Mackenzie Delta,Western Canadian Arctic.Freshwater Biology,2002,47:2123-2135.
[16]Cronin G,Lodge DM.Effects of light and nutrient availability on the growth,allocation,carbon/nitrogen balance,phenolic chemistry,and resistance to herbivory of two freshwater macrophytes.Oecologia,2003,137:32-41.
[17]Xie Y,Deng W,Wang J.Growth and root distribution of Vallisneria natans in heterogeneous sediment environments.Aquatic Botany,2007,86:9-13.
[18]Xiao K,Yu D,Wang J.Habitat selection in spatially heterogeneous environments:a test of foraging behaviour in the clonal submerged macrophyte Vallisneria spiralis.Freshwater Biology,2006,51:1552-1559.
[19]Zhu G,Li W,Zhang M et al.Adaptation of submerged macrophytes to both water depth and flood intensity as revealed by their mechanical resistance.Hydrobiologia,2012,696(1):77-93.
[20]Li Y,Yu D,Xu X et al.Light intensity increases the susceptibility of Vallisneria natans to snail herbivory.Aquatic Botany,2005,81:265-275.
[21]黎慧娟,倪乐意,曹 特等.弱光照和富营养对苦草生长的影响.水生生物学报,2008,32(2):225-230.
[22]Madsen TV,Maberly SC,Bowes G.Photosynthetic acclimation of submersed angiosperms to CO2and.Aquatic Botany,1996,53:15-30.
[23]严 雪,于 丹,李永科.CO2浓度升高对沉水克隆植物生长速率及营养元素积累的影响.植物生态学报,2003,27(4):435-440.
[24]Yan X,Yu D,Li YK.The effects of elevated CO2on clonal growth and nutrient content of submerge plant Vallisneria spinulosa.Chemosphere,2006,62:595-601.
[25]Duarte CM.Seagrass nutrient content.Marine Ecology Progress Series,1990,67:201-207.
[26]Han W,Fang J,Guo D et al.Leaf nitrogen and phosphorus stoichiometry across 753 terrestrial plant species in China.New Phytologist,2005,168:377-385.
[27]He J,Wang L,Flynn DFB et al.Leaf nitrogen:phosphorus stoichiometry across Chinese grassland biomes.Oecologia,2008,155:301-310.
[28]Xing W,Wu HP,Hao BB et al.Stoichiometric characteristics and responses of submerged macrophytes to eutrophication in lakes along the middle and lower reaches of the Yangtze River.Ecological Engineering,2013,54:16-21.
