貂源C型绿脓杆菌的分离鉴定及其药敏试验
2014-09-25刘佳卉秦绪伟张泽林齐鲁动物保健品有限公司山东济南250100
刘佳卉 秦绪伟 赵 远 张泽林 (齐鲁动物保健品有限公司 山东 济南 250100)
绿脓杆菌,是引起水貂出血性肺炎的主要病原菌。该病多发于温暖潮湿的夏秋两季,最适宜生长温度为30~37℃,可感染众多哺乳动物、禽类、爬行类和鱼类[1],发病急,死亡快,水貂死亡肺部呈现出严重的病理变化。此病的死亡率非常高,目前已成为严重阻碍我国水貂养殖业发展的烈性传染病之一,本研究从临床病死水貂中分离鉴定得到一株绿脓杆菌,并对其进行了耐药性分析,为地区性水貂出血性肺炎的防治提供理论依据。
1 材料与方法
1.1 菌株 采集来自山东诸城某一水貂养殖场暴发的水貂出血性肺炎的水貂,水貂换毛期间,口鼻流血死亡,血清平板细菌分离获得菌株。
1.2 阳性血清和其他材料 G型、B型、C型绿脓杆菌阳性血清购自日本力生研株式会社;营养琼脂、SS琼脂、麦康凯琼脂购自青岛海博生物技术有限公司;微量生化试剂管购自北京路桥技术有限责任公司;药敏纸片购自杭州天和微生物试剂公司。
1.3 细菌分离纯化 无菌条件下对病死水貂肺脏划线,接种于血清营养琼脂平板中,置于37℃恒温培养箱中培养,长出单菌落后挑取菌落进行纯培养。
1.4 分离菌的生化鉴定 参照中华人民共和国国家标准GB 7918.4-87《化妆品微生物标准检验方法》,对分离纯化的疑似菌株进行生化鉴定,包括十六烷三甲基溴化铵琼脂培养试验、染色镜检、氧化酶试验、绿脓菌素试验、硝酸盐还原产气试验、明胶液化试验、42℃生长试验。
1.5 分离菌的分子生物学鉴定 参考文献,设计一对引物进行PCR检测。上游:5’-ACGGGTGAG TAATGCC-3’,下游:5’-CAGTCTCCTTAGAGT GCC-3’,扩增片段长度为1051bp。PCR采用25µl体系,取1.5µl样品作为模板,加入10×Ex Taq Buffer2.5µl,上、下游引物各0.2µl,dNTP2µl、最后加Ex Taq酶0.2µl,用灭菌纯水补足到25µl。扩增条件为:94℃4min;94℃30s、55℃30s、72℃1min,30次循环;72℃10min。
1.6 分离菌的血清型鉴定 分别取绿脓杆菌阳性血清G型、B型、C型一滴,滴于载玻片上,用接种环取营养琼脂上菌落与血清混合,1min过后观察有无凝集。
1.7 分离菌的药敏试验 从固体培养基上挑取单菌落,均匀密集划线接种于血清营养琼脂培养基,按K-B纸片法测定该菌其对常用抗菌药物的敏感性。
1.8 分离菌的毒力试验 从固体培养基上挑取单菌落,接种于马丁肉汤培养基,37℃恒温培养箱中培养24h,细菌计数,100倍稀释腹腔注射16~20g小白鼠3只,0.3ml/只,对照注射生理盐水2只,观察7d。
2 结果
2.1 细菌分离和培养特性结果 分离的细菌在血清肉汤培养基上形成圆形,光滑,稍隆起,边缘整齐或者波浪状的绿色菌落,并有独特的芳香气味(图1A)。革兰氏染色镜检,为革兰氏阴性小杆菌,单个散在或成对出现(图1B),在SS琼脂和麦康凯培养基呈现典型性褐色菌落,菌落不规则,边缘呈现伞状伸展[2],在绿脓菌素培养基呈现绿色。2.2 分离菌的生化鉴定结果 分离菌生化试验结果如表1所示。分离株氧化酶试验、绿脓菌素试验、明胶液化、硝酸盐还原产气试验和42℃生长试验三者均为阳性,符合绿脓杆菌生化特性。

图1 分离株形态学观察
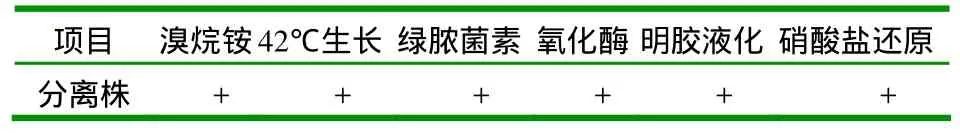
表1 分离株的生化试验结果
2.3 分离菌的分子生物学鉴定结果 经过绿脓杆菌PCR检测,该菌株在1051bp左右处产生目的条带,确定为绿脓杆菌菌株(图2)。
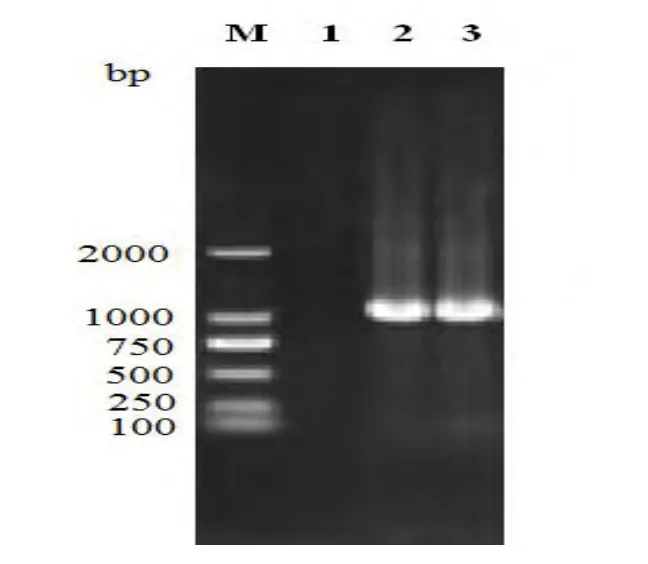
图2 绿脓杆菌PCR鉴定结果
2.4 分离菌血清型的鉴定结果 分别取绿脓杆菌阳性血清G型、B型、C型一滴,滴于载玻片上,用接种环取营养琼脂上菌落与血清混合,1min过后观察可见C型血清呈现均匀的颗粒状凝集,B型、G型血清未见凝集。
2.5 分离菌的药敏试验结果 通过对抑菌圈的大小进行测量比对,结果表明该细菌对头孢哌酮-舒巴坦、丁胺卡那霉素、庆大霉素高度敏感,对头孢曲松、恩诺沙星、链霉素、多粘菌素B中度敏感,对阿莫西林、林可霉素、复方新诺明耐药(表2)。
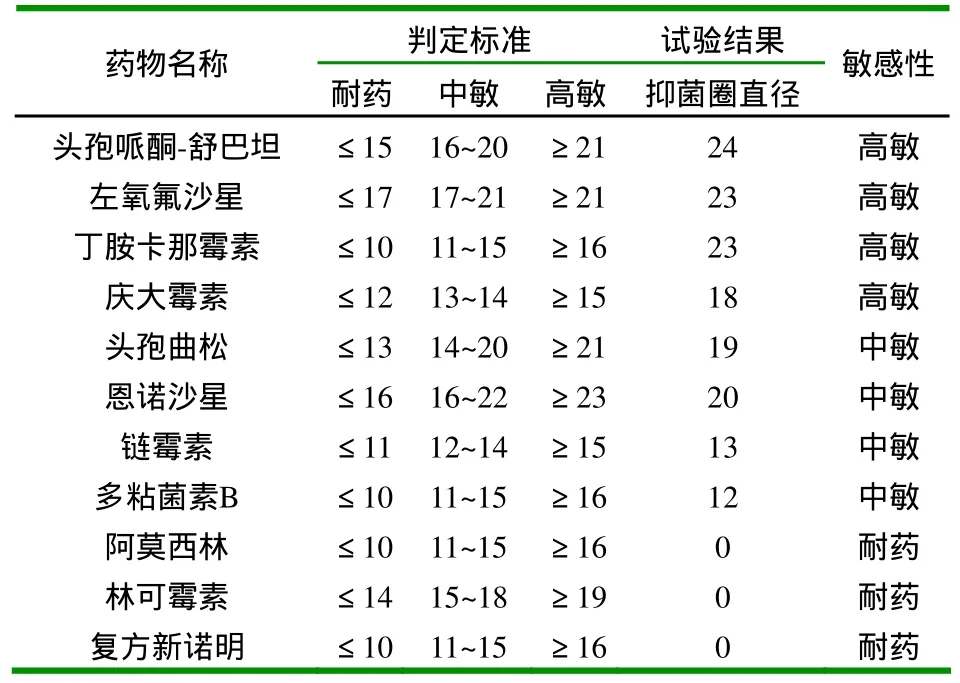
表2 分离株的药敏试验结果(抑菌圈直径) (mm)
2.6 分离菌的毒力试验结果 分离菌液体培养24h,细菌计数70亿/ml,注射36h~48h试验组小白鼠被毛凌乱,消瘦,死亡,对照组观察7日正常。分离菌对小白鼠毒力较强。
3 讨论
在临床出血性肺炎的细菌分离中,绿脓杆菌以B型、G型居多[3],C型绿脓杆菌分离比较少,本试验从患有出血性肺炎的病死水貂肺脏中分离致病菌,经过细菌形态学观察、生化实验、PCR鉴定、血清凝集试验,最终确定为致病性C型绿脓杆菌。
不同地区分离的绿脓杆菌会因为血清型的不同或者当地的用药情况不同而对抗生素的耐药性产生差异,因此在养殖场不要单一长时间用药,要根据药敏试验结果选择合适的药物进行治疗,或者轮换用药。根据本试验结果可以选择左氧氟沙星全群拌料,庆大霉素、头孢哌酮-舒巴坦或丁胺卡那霉素注射作为治疗方案,经过全场消毒、饲料熟制、药物治疗,第3天死亡下降,第5天停止死亡,第7天食欲全部恢复正常,达到了良好的治疗效果。另外也可以选择绿脓杆菌疫苗进行免疫,单一血清型绿脓杆菌疫苗保护性较差,应采取多价菌株疫苗进行预防[4],有时候使用了疫苗还会发病,主要是因为血清型不同引起的,此外发生出血性肺炎除了绿脓杆菌的各个血清型之外还有克雷伯氏菌、巴氏杆菌、肺炎双球菌等,一旦发生疾病还需要进行细菌分离和药敏试验,以确定疾病的类型和给予正确的治疗治疗方案,减少损失。
近几年来,我国水貂养殖业发展较快,养殖数量及密度不断提高,但是环境管理和疾病控制却相对滞后。水貂在免疫力低下的情况下很容易感染一些条件致病菌,因此控制该类疾病除确定病原、接种疫苗、筛选敏感药物外,还需要提高水貂养殖环境,注重饲料的合理搭配,提高水貂免疫力,从而控制原发疾病,形成科学规范的饲养管理,达到良好的经济效益。
[1]陆承平.兽医微生物学第5版[M].中国农业出版社, 2013, 152-153.
[2]周庭银.临床微生物学诊断与图解第2版[M].上海科学技术出版社.2006, 197-200.
[3]白雪等.水貂绿脓杆菌分离株的生物学特性和血清型分析[J].畜牧与兽医, 2011(7): 31-35.
[4]柴秀丽等.水貂出血性肺炎的防治[J].特种经济动物, 2008(6): 13.
