复合式微流控脱水芯片的研制*
2014-09-25雍蓓蓓徐光明
雍蓓蓓, 徐光明, 张 宏
(1.浙江大学 微分析系统研究所,浙江 杭州 310058;2.浙江大学 医学院第二附属医院,浙江 杭州 310009)
0 引 言
以微机电加工技术为基础的“微型全分析系统”(miniaturized total analysis systems,or micro total analysis systems,μTAS)[1]是通过化学分析设备和化学合成装置的微型化与集成化,最大限度地把化学实验室的功能转移到便携设备中,甚至集成到一定尺寸的芯片上。其中微流控芯片(microfluidic chips)是μTAS中最活跃的领域和发展前沿,集中体现了将化学实验室的功能转移到芯片上的思想,其目标是把整个化验室的采样、稀释、加试剂、反应、分离、检测等功能集成在可多次使用的微芯片上,因此,具有较广泛的适用性和应用前景。自1997年,Salimimoosavi H等人[2]首次报道了微流控芯片在有机合成中的应用之后,相关研究已经成为微流控芯片和合成化学领域热点之一,并迅速成为当今有机合成化学的一项新技术[3~5]。因为水是良好的亲核试剂,在许多亲核反应中少量水的存在会严重干扰合成反应,因此,在微流控系统内进行此类有机合成,就必须实现反应试剂的在线脱水。
目前在微流控系统中实现试剂在线脱水的方法主要是加热蒸发分离,Lee C C等人[6]设计了一种聚二甲基硅氧烷(PDMS)材质的微流控合成装置,实现了含F离子试剂的在线脱水,用于[18F]FDG分子影像试剂的合成,但该装置的芯片材料全部采用PDMS,对高压和溶剂的耐受性较差,使用受限。Steel C J等人[7]采用玻璃材料制成二级结构的蛇形微流控装置,解决了芯片与溶剂不兼容的问题,但存在气液分离不彻底、脱水不理想等缺点。Zhang J Y等人[8]制作了由不锈钢气流通道层、PDMS液流通道层、聚四氟乙烯多孔滤膜、硅橡胶衬垫和铝外壳组成的微流控芯片,实现了细菌的快速浓缩,但该装置结构复杂,制作难度大。
本文报道了一种玻璃—PDMS…PDMS—PC复合结构的微流控脱水芯片,玻璃液路基片、聚碳酸酯(PC)气路基片分别与弹性PDMS膜不可逆封合形成液路半芯片和气路半芯片,夹入聚四氟乙烯(PTFE)微孔膜之后可逆封合为全芯片,具有加工简单,封合可靠,液路和气路通道易于对准,而且,液路半芯片和气路半芯片可以独立更换、自由组装,用此芯片可实现有机合成过程试剂的脱水处理。
1 实 验
1.1 芯片制作
复合式微流控脱水芯片的制作全过程如图1所示。
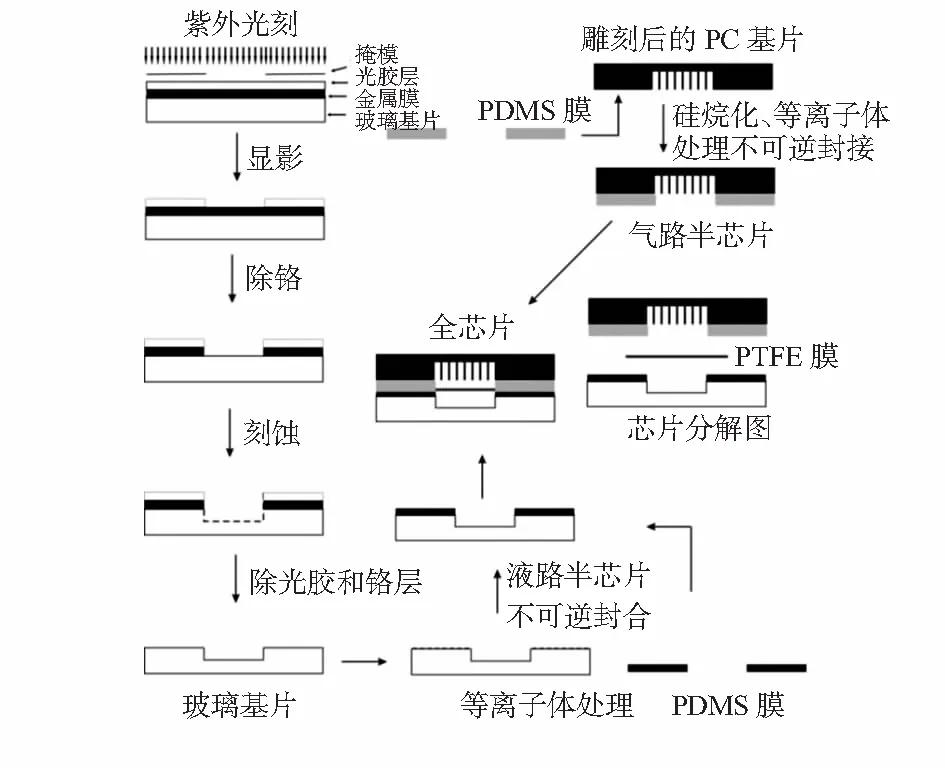
图1 脱水芯片加工流程示意图
1.1.1 玻璃液路基片的制作
玻璃液路基片采用标准光刻技术和湿法刻蚀制得,具体步骤如下:
1)掩模制作:按液路通道绘制掩模图形,并制得光刻掩模胶片。
2)光刻曝光:将掩模对准玻璃匀胶铬板,并使两者紧密贴合,于光刻机下曝光,曝光时间一般为45 s。
3)显影和定影:曝光后分离掩模与铬板,铬板光胶面朝上放入0.5 %NaOH显影液中显影40 s,去除已曝光部分光胶,并用去离子水冲洗1 min,再用吹风机吹干后置入烘箱于110 ℃下烘15 min,以固化剩余光胶。
4)除铬:铬板冷却至室温后,光胶面朝上放入去铬液中,轻轻晃动40 s,除去裸露的铬层,用自来水冲洗、吹干。
5)湿法刻蚀:在基片背面和边缘贴胶带纸保护,放入刻蚀液中,在40 ℃恒温水浴振荡器下,缓慢摇动刻蚀,通常刻蚀速度约为1 μm/min,控制刻蚀时间可控制通道深度。
6)除铬与切割芯片:刻蚀后的基片除去胶带,用蘸有无水乙醇的脱脂棉去除胶带残余物,丙酮去除剩余光胶层,去铬液除铬。依芯片大小用玻璃刀切割,用细砂纸打磨切割面的边缘以去除玻璃尖刺和碎屑,用水冲洗干净即得玻璃液路基片。
1.1.2 PDMS弹性膜的制作
PDMS预聚体与固化剂按10︰1的质量比例混合,搅拌均匀后真空脱气15~30 min;将洗干净的玻璃平板四周用胶带围绕,浇注经脱气处理的PDMS混合物,轻轻晃动使PDMS厚薄分布均一,烤胶机75 ℃下加热1.5 h使PDMS固化。固化后的PDMS膜依气液基片尺寸切割,依据液槽位置在PDMS对应处用打孔器打出与液槽及气槽匹配的孔槽,制得PDMS弹性膜。与液路基片封合的PDMS弹性膜需在对应液槽进出口位置打孔,作为进液与出液端。
1.1.3 PC气路基片的制作
用ArtCAM Pro软件绘制气路通道图形,形成刀具路径文件,控制雕刻机在PC板上刻出通道,并在需要连接气路的进出口处打孔,即得到PC气路基片。
1.1.4 芯片封合
1)不可逆封合制备液路半芯片和气路半芯片
玻璃基片与PDMS弹性膜分别用洗洁精、丙酮和去离子水清洗,氮气吹干,用等离子体处理1 min后立即以滚贴方式封合制得液路半芯片。
PC基片用去离子水超声清洗,氮气吹干,用254 nm紫外灯辐照处理1 h使其表面活化,再放入5 %(V/V)的3—氨丙基三乙氧基硅烷(APTES)水溶液中处理(80 ℃下水浴加热20 min)使其表面硅烷化[9]。硅烷化的PC基片和PDMS弹性膜再用等离子体处理后,也以滚贴方式封合制得气路半芯片。
液路半芯片的进、出液端以及气路半芯片的进、出气端分别粘接合适直径的聚四氟乙烯管或玻璃管,作为与外部设备的接口。
2)可逆封合制备PC—PDMS…PDMS—玻璃复合脱水芯片
将气路半芯片与液路半芯片的PDMS面相对(预先用保鲜膜保护,封合前揭去),中间放入PTFE微孔膜,对准后压紧,使两个半芯片通过PDMS之间的自然粘合力形成可逆封接,整个芯片用夹具固定,即得到PC—PDMS…PDMS—玻璃复合结构的微流控脱水芯片,其结构见图2。
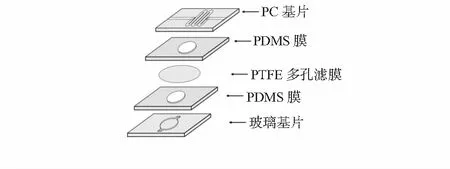
图2 复合脱水芯片结构示意图
1.2 在线脱水装置
用具有减压装置的氮气钢瓶、脱水芯片、芯片加热装置、微量注射泵构成正压式脱水装置(图3(a));用微型真空泵、脱水芯片、芯片加热装置、微量注射泵构成负压式脱水装置(图3(b)),用这两种类型的装置,实现芯片内的有机试剂在线脱水处理。
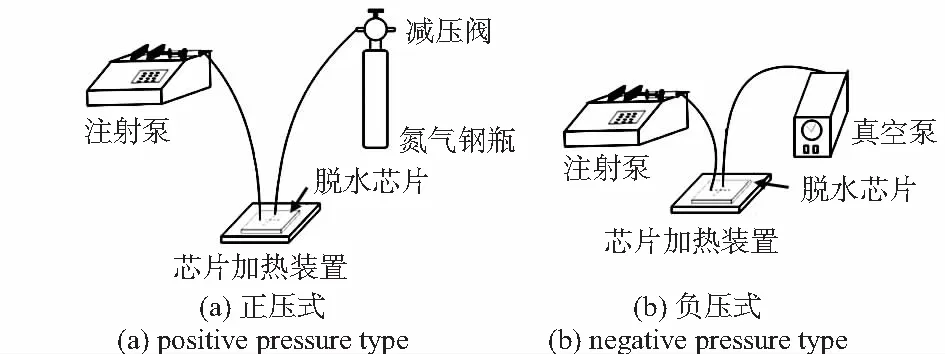
图3 微流控芯片脱水装置示意图
2 结果与讨论
2.1 复合式脱水芯片的研制
这种玻璃—PDMS…PDMS—PC复合结构的微流控脱水芯片,其底部基片采用玻璃材质,既保证了芯片刚性,又使芯片具有更好的耐热和耐溶剂性能;顶部采用PC材质,并利用上下材料的疏水差异,加之在气液芯片中间夹入 PTFE微孔膜,进一步提高了气—液相的分离效果。
用PDMS做上下两层结构之间的密封材料,简单方便,又不影响芯片的耐温及耐溶剂性能,采用等离子体处理和硅烷化处理相结合的方式,使玻璃—PDMS、PC—PDMS均形成具较高强度的不可逆封接。
此芯片的气路和液路半芯片之间不仅可重复对准、贴合,且气泡也不易残留在两层PDMS之间,上下半芯片和PTFE微孔膜均可单独更换,自由组装。
2.2 芯片脱水性能测试
2.2.1 脱水条件探究
1)分别用单独加热自然蒸发、加热结合正压(通干燥氮气)吹出、加热结合负压(抽真空)携出三种方式,研究了纯水在芯片内完全蒸发脱水的时间与加热温度之间的关系,结果如图4。
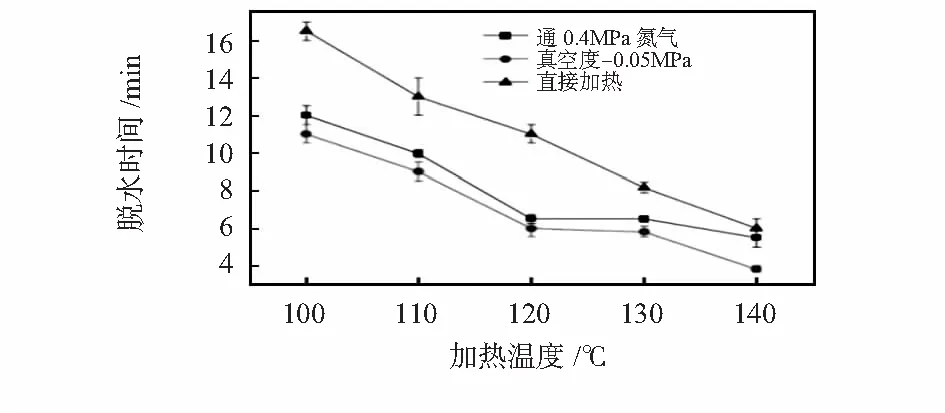
图4 脱水时间与芯片加热温度关系
结果表明:三种不同的蒸发方式均可实现芯片内的在线脱水。正压式脱水和负压式脱水两种方式均可加速水的蒸发,且这两种方式在芯片加热温度达120 ℃后,其脱水时间达到预期目标,因此,对于纯水在120 ℃下采用正压或负压方式进行脱水均较为理想,且正压方式更为简便。
2)进一步研究了正压方式下氮气压力和负压方式下真空度对纯水脱水时间的影响,其结果分别见图5和图6。
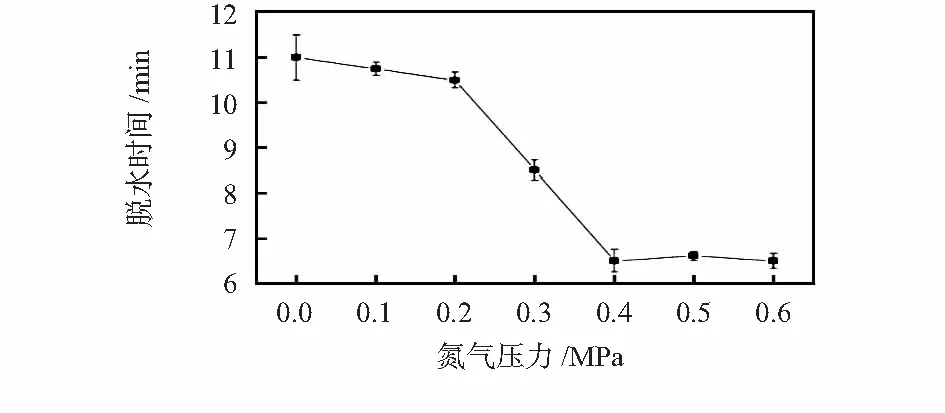
图5 脱水时间与氮气压力关系(120 ℃)
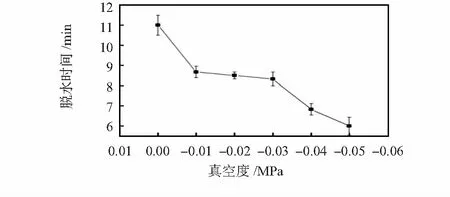
图6 脱水时间与真空度关系(120 ℃)
正压方式下,脱水时间随气压增大而减少,达到0.4 MPa以上蒸发时间不再缩短,这是因气路管道直径限制,气体流量在0.4 MPa左右达到最大值;负压方式下,脱水时间随真空度增大而减少。
3)以乙腈—水混合溶液进行了单独加热自然蒸发和正压吹出蒸发脱水的研究,结果分别见图7和图8。

图7 乙腈—水混合溶液的脱水时间与加热温度关系
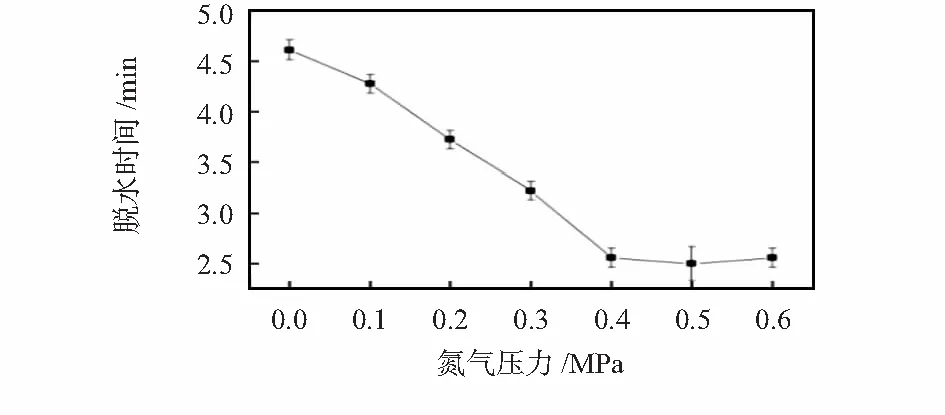
图8 乙腈—水混合溶液的脱水时间与氮气压力关系(110 ℃)
可见,正压方式同样可加快乙腈—水混合溶液的蒸发,且当加热温度达110 ℃时能得到良好脱水结果。脱水时间随氮气流量增大而缩短,在110 ℃时,氮气压力大于0.4 MPa,脱水时间便可小于3 min,达到预期目标。此外还发现,负压方式下混合溶液会被吸入气路芯片,不适用于这类混合溶液的脱水。
2.2.2 实际样品脱水测试
以KF(0.145 g/L)—乙腈水溶液(用于合成[18F]FDG)脱水为目的,用正压方式,在氮气压力0.4 MPa,温度110 ℃条件下对该混合溶液进行脱水,并用无水乙腈洗脱蒸发后的剩余物,用卡尔费休法测定了洗脱液的含水量,考察脱水时间与洗脱液含水量的关系,其结果见图9。
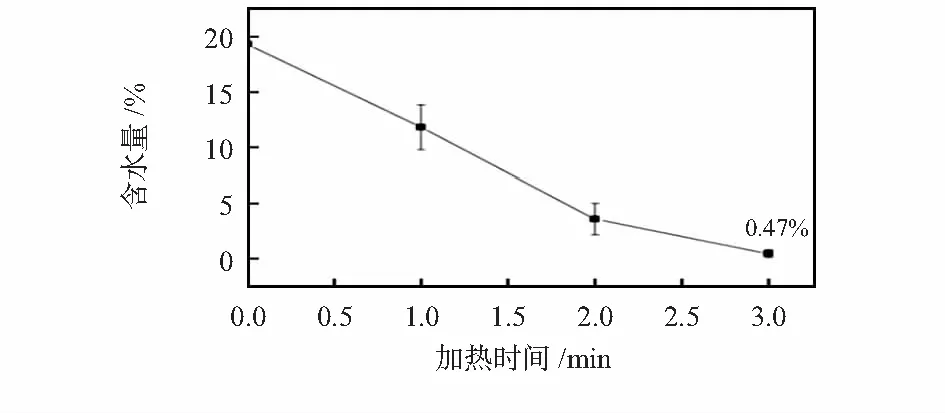
图9 氟试剂含水量与加热时间的关系
结果表明:当脱水时间在3 min时,洗脱液中的含水量小于1 %,达到脱水目标。
3 结 论
本文研制了玻璃—PDMS…PDMS—PC四层结构的微流控脱水芯片。玻璃液路基片、PC气路基片分别与弹性PDMS不可逆封合形成液路半芯片和气路半芯片,加入PTFE微孔膜后,两片半芯片再借助自然粘合与外力封合为全芯片。封接过程简单可靠,液路和气路通道易于对准,且液路半芯片和气路半芯片可独立更换、自由组装。
利用此芯片构成的脱水装置,对纯水、乙腈∶水(V/V)=2︰1混合溶液脱水进行了条件实验,脱水的合适温度为110~120 ℃,采用干燥氮气正压辅助吹出的方式更为理想,且对本系统装置合适的氮气压力为0.4 MPa。
用本脱水装置对KF—乙腈水溶液进行了实际脱水效果考察,可在3 min内完成脱水,洗脱液中含水率小于1 %,结果令人满意,该芯片可以用于合成[18F]FDG等有机试剂的脱水。
参考文献:
[1] Manz A,Graber N,Widmer H M.Miniaturized total chemical analysis systems:A novel concept for chemical sensing[J].Sensors and Actuators B:Chemical,1990,1:244-248.
[2] Salimimoosavi H,Tang T,Harrison D J.Electroosmotic pumping of organic solvents and reagents in microfabricated reactor chips[J].Journal of the American Chemical Society,1997,119:8716-8717.
[3] Jahnisch K,Hessel V,Lowe H,et al.Chemistry in microstructured reactors[J].Angew Chem Int Ed Engl,2004,43:406-446.
[4] Demello A J.Control and detection of chemical reactions in microfluidic systems[J].Nature,2006,442:394-402.
[5] Watts P,Haswell S J.The application of micro reactors for organic synthesis[J].Chem Soc Rev,2005,34:235-246.
[6] Lee C C.Multistep synthesis of a radiolabeled imaging probe using integrated microfluidics[J].Science,2005,310:1793-1796.
[7] Steel C J,O'brien A T,Luthra S K,et al.Automated PET radiosyntheses using microfluidic devices[J].Journal of Labelled Compounds and Radiopharmaceuticals,2007,50:308-311.
[8] Zhang J Y,Do J,Premasiri W R,et al.Rapid point-of-care concentration of bacteria in a disposable microfluidic device using meniscus dragging effect[J].Lab on a Chip,2010,10:3265-3270.
[9] 黄山石,胡贤巧,何巧红,等.高聚物微流控芯片上集成化气动微阀的研制[J].传感器与微系统,2012,31(8):137-140.
