基于石英和载玻片的微电极制备工艺研究*
2014-09-25张晓飞谭秋林熊继军薛晨阳
张晓飞, 张 洋, 谭秋林, 孙 东, 熊继军, 薛晨阳
(1.中北大学 电子测试技术重点实验室,山西 太原 030051;2.中北大学 仪器科学与动态测试教育部重点实验室,山西 太原 030051;3.香港城市大学 机械及生物医学工程系,香港 九龙 999077)
0 引 言
微流控芯片技术在环境监测、分析化学、生物医药等领域有着广泛的应用。在微流控芯片的设计中,电极常被用作检测电极、控制电极、电渗流驱动电极、加热及温度传感元件等。介电泳技术作为微流控芯片技术的重要组成部分,成为高通量微粒分离、捕获和操纵研究的热点。微流控芯片以其集成化、自动化和微型化的优势在环境监测、分析化学、生物医药等领域有着广泛的应用前景。近年来,各种材料的芯片不断涌现,有单晶硅片、石英、玻璃和有机聚合物等[1]。玻璃和石英有很好的电渗和优良的光学性能,两者的表面吸附和表面反应能力易于对表面进行改性,具有良好的化学惰性,作为电极基底散热效果好[2]。在用紫外分光光度法检测的微流控芯片中,最好采用石英基底[3]。聚二甲基硅氧烷(polydimethylsiloxane,PDMS)材料易于成型和键合,具有良好的生物相容性、透光性、电绝缘性和化学惰性,常用来制作微流控芯片的微通道。
为进一步证实电极制造方法的实用性,本文选用了由载玻片作为基底的PDMS—玻璃微流控芯片,进行酵母菌细胞的正负介电泳实验[4~6]。
本文以较常见的叉指型电极为例,基于光刻工艺中各工艺参数要求,重点研究以石英片和载玻片为基底的电极的制备工艺。制得的2种不同基底的电极,采用对比度、精度等关键参数进行分析,最终确定选用载玻片作为芯片基底并获得其最佳工艺参数,制作带电极的PDMS—玻璃微流控芯片,通过实验,成功观察到酵母菌细胞的正、负介电泳现象。
1 实验部分
1.1 设备和材料
仪器包括:匀胶机(KW—4A);烘台(EH20B,Lab Tech);光刻机(URE—2000A,中国科学院微电子研究所);磁控溅射镀膜机(JTRC—550型);超声波清洗机(SB—5200 DT,宁波新芝生物科技股份有限公司);Harrick等离子清洗机(PDC—32G—2);真空干燥箱;光学观察平台(实验室自制);函数信号发生器(GWIUSTEK)。
研究中所用试剂包括:丙酮、乙醇(天津市富宇精细化工有限公司);去离子水(实验室自制);正性光刻胶(RZJ304 25 mpa.s,苏州瑞红);正性光刻胶显影液(RZX—3038);正性光刻胶剥离液(RBL—3368);SU—8 2050光刻胶(MICRO CHEM);SU—8 2050剥离液(苏州瑞红);DC—184(道康宁);安琪酿酒高活性酵母菌(安琪酵母股份有限公司)。耗材为2 in(1 in=2.54 cm)单面抛光硅片(浙江立晶光电科技有限公司);载玻片(25.4 mm×76.2 mm×1 mm,帆船牌7101);2 in双面抛光石英片(1 mm厚,连云港晶圣石英制品有限公司)。
1.2 叉指型电极微流控芯片的加工过程
叉指型电极微流控芯片的制作工艺流程如图1所示。实验中掩模版均为正版(所需图形为透光部分)。电极的制作流程为:将基底(载玻片或石英片)依次用去离子水、丙酮、乙醇、去离子水超声清洗各5 min,用氮气吹干后在基底表面用匀胶机旋涂RZI—304正性光刻胶得到图1(a),经前烘、曝光、显影、后烘、溅射、剥离后制得带电极基底如图1(b)所示。PDMS微流腔体的加工过程为:将清洗(清洗方法同基底)后的硅片用匀胶机旋涂SU—8胶,经前烘、曝光、后烘、显影后制的反模如图1(c)所示,用道康宁SYLGARD 184硅橡胶双组分(基本组分与固化剂按10∶1重量比)混合后,进行倒模如图1(d)所示,95 ℃固化2 h后得到微流腔体如图1(e)所示。最后将带电极的基底与制得的PDMS腔用等离子清洗机,在氧环境下处理3~5 min后键合制得图1(f)所示微流控芯片。
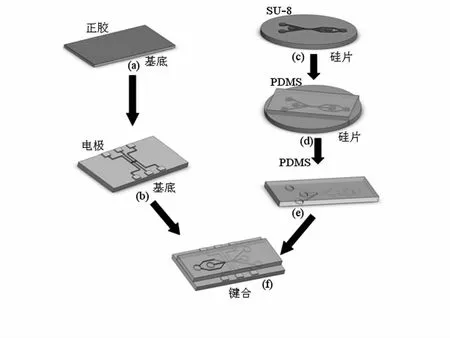
图1 微流控芯片制作工艺流程
2 加工步骤
本文设计的电极结构如图2所示,电极宽度和间距均为10 μm。实验中载玻片和石英片的匀胶转速和匀胶时间相同,参考厂商提供的条件,分别为3 000 rpm,40 s,在此参数下的匀胶厚度为1.8 μm。光刻机汞灯的曝光强度为40~45 mJ/cm2。JTRC—550型磁控溅射镀膜机在工艺参数为被底真空5.0×10-3Pa,氩气流量30 mL/min,溅射电流0.4 A,溅射时间为10 min,在工作气体压强为6.0×10-2Pa条件下,溅射厚度为700 nm的Au。前烘温度100 ℃ ,前烘时间90 s,曝光时间和显影时间见表1,去离子水冲洗时间60 s,后烘温度100 ℃ ,后烘时间120 s,剥离液冲洗时间120 s。
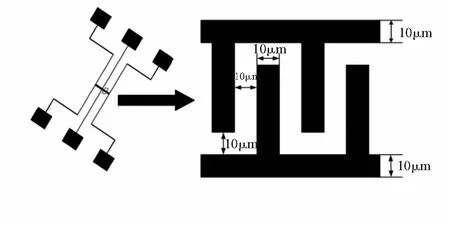
图2 电极结构设计图

表1 2种基底的曝光和显影时间

图3 不同曝光和显影时间得到的电极CCD照片
3 结果和讨论
3.1 曝光和显影时间对叉指型电极的影响
如图3所示:载玻片(2)质量效果最好,电极对比度好,满足实验用电极的要求。载玻片(1)曝光时间过长,比(2)长5 s,曝光时在掩模图形的边缘发生衍射,使得图形边缘部分感光,电极部分相对变宽且边缘不整齐。载玻片(3)曝光时间太短,光刻胶反应不完全。载玻片(4)显影时间过长,比(2)长30 s,导致光刻胶膜溶胀边缘被进一步显掉,电极边缘变圆滑,对比度低。载玻片(5)显影时间比(2)短30 s,显影不足,电极处光刻胶有残余,经剥离后电极破损。
对于石英片基底:石英片(1)的工艺参数与载玻片(2)相同,电极表面粗糙,可能是由于曝光不足或者显影时间过短。石英片(2)和(3)是分别增加曝光时间和显影时间的结果,电极表面粗糙仍没有改善。石英片(4)比(1)同时增加曝光和显影时间,得到的电极质量效果较好。石英片(5)是进一步增加曝光时间的结果,电极表面仍有破损。由于石英片本身表面光滑度不够,电极不规整,对于尺寸小的电极,不宜选用石英片作为基底。
3.2 酵母菌细胞的正负介电电泳现象
将带有电极的载玻片和PDMS通道键合后得到如图4所示的成品芯片。运用Harrick等离子清洗机将通道和电极基底不可逆键合,使用时用注射器注入酵母菌液,流体流动平滑,无侧漏和变形现象,说明此键合方法键合效果良好,满足实验要求。

图4 加工出的带电极的PDMS—玻璃微流控芯片
运用实验操作平台进行酵母菌细胞的正负介电泳实验,以此来证明运用本文中的工艺参数,制作的电极可用于实际应用。实验用酵母菌液的浓度为2×108个/mL,介质电导率σ=30 μS/cm,所加交流电场的峰峰值为8 V。实验结果如图6所示,无外加电场时酵母菌细胞的分布如图5(a)所示;当所加交流电场的频率为5 kHz时,酵母菌细胞向远离电极的方向移动,产生负介电泳现象,图5(b),(c)分别是tf=5 kHz=2 s和tf=5 kHz=6 s的细胞分布;当所加交流电场的频率为5 MHz时,酵母菌细胞向靠近电极的方向移动,产生正介电泳现象,图5(d),(e)分别是tf=5 MHz=4 s和tf=5 MHz=8 s时细胞的分布,即运用此电极芯片成功观察到酵母菌细胞的正负介电泳现象。

图5 交流电场8 V频率分别为5 kHz和5 MHz酵母菌细胞分布情况
4 结束语
通过研究以石英片和载玻片为基底的电极的制备工艺,得到加工线宽10 μm电极,两者各自的最佳工艺参数。在匀胶机转速3 000 rpm、匀胶时间40 s、前烘温度100 ℃、前烘时间90 s、曝光强度40~45 mJ/cm2、后烘温度100 ℃、后烘时间120 s、剥离液冲洗时间120 s相同时,2种基底的最
佳工艺参数分别是:载玻片曝光时间5 s,显影时间120 s;石英片曝光时间8 s,显影时间150 s。此外,当电极尺寸较小时,由于石英片表面光滑度不够,应选用载玻片作为基底。选用载玻片制作叉指型电极的PDMS—玻璃微流控芯片,通过实验,成功观察到酵母菌细胞的正、负介电泳现象。证明本文的电极制造工艺可成功应用于实际实验,实验过程中,无渗液和通道变形现象,说明制造的芯片电渗性能稳定,满足微流控芯片中电极的制造要求。
参考文献:
[1] 林炳承,秦建华.图解微流控芯片实验室[M].北京:科学出版社,2008: 32,35.
[2] Ruano Jesus M,Benoit Vincent,Aitchison J Stewart,et al.Flame hydrolysis deposition of glass on siliconfor the integration of optical and microfluidic devices [J].Anal Chem,2000,72(5): 1093-1097.
[3] Destgeer Ghulam,Lee Kyung Heon,Jung Jin Ho,et al.Conti-nuous separation of particles in a PDMS microfluidic channel via travelling surface acoustic waves (TSAW) [J].Lab on a Chip,2013,13: 4210-4216.
[4] Doh Il,Cho Young-Ho .A continuous cell separation chip using hydrodynamic dielectrophoresis (DEP) process [J].Sensors and Actuators A,2005,121(1): 59-65.
[5] Hughes M P .Strategies for dielectrophoretic separation in laboratory-on-a-chip systems [J].Electrophoresis,2002,23(16): 2569-2582.
[6] Huang Y,Holzel R,Pethig R,et al.Difference in the AC electrodynamics of viable and non-viable yeast cells determined through combined dielectrophoresis and electrotation studies [J].Phys Med Biol,1992,37(7):1499-1517.
