镉胁迫下硅对高粱生长的影响及其作用机制
2014-09-21殷俐娜王仕稳邓西平
刘 朋, 殷俐娜,2, 王仕稳,2, 邓西平,2
(1.中国科学院 水利部 水土保持研究所 黄土高原土壤侵蚀与旱地农业国家重点实验室,陕西 杨凌 712100; 2.西北农林科技大学 水土保持研究所, 陕西 杨凌 712100)
镉胁迫下硅对高粱生长的影响及其作用机制
刘 朋1, 殷俐娜1,2, 王仕稳1,2, 邓西平1,2
(1.中国科学院 水利部 水土保持研究所 黄土高原土壤侵蚀与旱地农业国家重点实验室,陕西 杨凌 712100; 2.西北农林科技大学 水土保持研究所, 陕西 杨凌 712100)
尽管硅提高植物的抗镉毒害已经被广泛的报道,但是其作用机理还不明确。该试验研究在镉胁迫的条件下,硅对高粱生长的影响及作用机制。结果发现:外源施加硅能显著地缓解镉对高粱无论地上部分还是地下部分鲜重及干重的抑制作用。抗氧化酶结果表明:在正常条件下,硅对抗氧化酶的活性没有显著的影响。在镉毒害的条件下,硅显著增强CAT和POD的活性,SOD的活性不受影响。与此相对应:硅显著地降低MDA的含量。对有机酸的分析发现:在镉胁迫的条件下,叶片中有3种有机酸能够检测到:草酸,丙二酸,丁二酸,并且其含量都在硅的调节下增加。而在根系中所检测的4种有机酸中,草酸和丙二酸的含量受到硅的调节而增加,柠檬酸的含量不受影响,而苹果酸的含量却有下降的趋势。上述结果表明:硅增强高粱幼苗的抗镉胁迫与其增强高粱抗氧化酶活性及增加高粱体内有机酸的含量相关。
硅; 镉; 抗氧化酶; 有机酸
土壤的重金属污染是一个非常严重的环境问题。镉(Cd)由于其具有非常强的流动性和毒害性,在世界范围内受到越来越多的重视[1]。黄土高原地区由于煤炭的开采导致土壤中富集了大量的镉[2]。土壤中大量富集的镉对植物的生长产生严重的影响,在高浓度的情况下会导致细胞的死亡[3-4]。黄土高原作为我国粮食作物和水果的主产区之一,土壤中的镉严重影响作物的产量及果实的品质。因此,需要采取一些方法增强植物抗镉能力,其中外源施加非毒性的化学试剂是增强植物抗镉毒害的方法之一。
硅在地壳中的含量仅次于氧,位居第二位[5]。尽管到目前为止,硅还不被广泛的认定为一种植物生长的必需元素,但是其在调控植物增强对生物胁迫和非生物胁迫的抵抗作用上已被大量的报道[6-9]。很多的研究结果表明:硅增强植物对镉的抵抗性其中一个重要的原因就是外源施加硅能改善植物对镉的吸收和运输。Chen等[10]的试验结果表明:高浓度的硅施入土壤后明显提高了土壤的pH从而降低了镉的有效性,减少了植物体对镉的吸收。Vaculik等[3]对根系固定镉的作用进行了进一步分析,结果表明:外源施加硅可以促进质外体物理障碍的形成和维管束系统的成熟从而减少了根对镉的吸收及向地上部分的运输。过去很多试验对于硅提高植物抗镉毒害的作用都是建立在长期毒害的基础上进行的。但是在我们的预试验中发现,在短期毒害下(72 h)硅也能显著提高高粱对镉毒害的抗性,因此在硅提高高粱抗镉毒害的机理中还存在着其他作用机制。基于国内外的研究进展,本试验主要研究在镉毒害的条件下,外源施加硅对高粱幼苗生长的影响,并且在此基础上研究高粱体内有机酸及抗氧化系统的变化趋势。
1 试验材料与方法
本试验选用高粱(SorghumbicolorMoench.cv.Gadambalia)作为试验材料。通过水培的方式研究外源施加硅对高粱生长的影响及其作用机制。
1.1 培养条件
高粱种子用1%的次氯酸钠灭菌后,将其放进育苗箱内催芽3 d。然后选取健壮,大小一致的高粱幼苗移栽至1/4倍Hoagland营养液中进行水培。水培试验是在黄土高原土壤侵蚀与旱地农业国家重点实验室人工气候室内进行。移栽6 d后,在营养液中加入1.67 mmol的Na2SiO3。硅处理三天后,进行镉毒害处理。镉毒害的浓度为10 μmol。在整个幼苗的生长过程中,每天用HCl和KOH调节营养液的pH值为6.0,并且保持通气。本试验一共4个处理:对照;对照+硅;镉;镉+硅。
1.2 生物量的测定
经过三天的镉毒害处理后,分别称取高粱幼苗的地上部分及根系的鲜重,然后将其放在70℃的烘箱烘干,测定其干重。
1.3 抗氧化酶活性及MDA的测定
经过三天的镉毒害处理后,对叶片进行取样分别测定抗氧化酶活性和MDA的含量。测定方法参见植物生理学试验指导[11]。
1.4 有机酸含量的测定
称取0.5 g样品,用6 ml蒸馏水进行研磨。研磨液于75℃水浴中提取15 min。然后以20 000 rpm离心20 min。上清液过0.45 μm滤膜后通过HPLC[12](Shimadzu,UV detector,Japan)分析各种有机酸的含量。HPLC的测定条件为:色谱柱为ODS-AQ column(250 mm×4.6 mm;5 μm particle size);流动相为20 mmol NH4H2PO4,pH用H3PO4调至2.5;流速设定为0.7 ml/min;柱温25℃;波长210 nm。各种有机酸的含量通过有机酸的标准曲线来计算。
1.5 统计方法
利用Excel作图,SPSS在(P<0.05)水平上进行单因素方差分析。
2 结果与分析
2.1 外源施加硅对高粱幼苗干重和鲜重的影响
结果如表1所示,在正常条件下,外源施加硅对生物量及根冠比没有显著影响。当高粱幼苗经过3 d的镉毒害处理后,无论是地上部分还是地下部分生物量(鲜重和干重)都出现显著下降。但是经过硅处理后的幼苗,其生物量下降的趋势得到显著缓解。尽管在镉胁迫下,外源施加硅可以显著增加高粱幼苗的鲜重和干重,但是其根冠比并没有受到显著影响。

表1 镉胁迫下硅对高粱幼苗地上部分和根鲜重,干重及根冠比的影响
注:不同字母代表P<0.05上有显著差异。
2.2 外源施加硅对抗氧化酶活性及MDA含量的影响
从图1可以看出,无论在正常条件还是在镉胁迫的条件下,外源施加硅对SOD的活性没有显著影响。当高粱幼苗遭遇到镉毒害后,CAT活性显著增强,而外源施加硅后,CAT活性会得到进一步的增强。POD活性在正常条件下没有显著性的差异,但是在镉毒害的条件下,外源施加硅可以明显增强POD的活性。与上述抗氧化酶活性相对应的就是MDA的含量。高粱幼苗遭受到镉胁迫后,由于细胞膜的完整性受到严重的破坏,MDA的含量显著上升。而外源施加硅后,抗氧化酶活性的增强缓解了膜脂过氧化作用,维持了细胞膜的完整性,从而降低MDA的合成。

图1 镉胁迫下硅对高粱幼苗叶片SOD,CAT,POD活性及MDA含量的影响
2.3外源施加硅对叶片有机酸含量的影响
在本试验中,使用了6种有机酸的标准样品来测定高粱叶片和根系内有机酸的含量。通过与标准样品保留时间的比较,我们发现在高粱幼苗的叶片中可以检测到三种有机酸即:草酸,丙二酸和丁二酸(图2)。但是它们的变化趋势并不完全相同。在没有镉毒害存在的情况下,外源加入硅显著增加草酸的含量。高粱幼苗经过3 d的镉处理后,地上部分中草酸的含量大幅度下降,但是经过硅处理的叶片中的草酸含量仍然要显著高于未加硅的幼苗。丙二酸的含量在正常条件没有受到外源施加硅的影响。经过镉处理后,未加硅处理的幼苗叶片丙二酸的含量仍然没有显著性的变化,但是经过硅处理的幼苗叶片丙二酸的含量显著增加。正常条件下,丁二酸的变化趋势与丙二酸相似,没有受到外源施加硅的影响,但是当高粱幼苗遭受到镉胁迫后,叶片中丁二酸大量积累并显著高于对照,值得注意的一点就是:外源施加硅可以进一步增加叶片中丁二酸的积累量。

图2 镉胁迫下硅对高粱幼苗叶片有机酸含量的影响
2.4外源施加硅对根系有机酸含量的影响
根系有机酸的种类,含量与叶片中的结果不同(图3)。相比与叶片中有机酸的种类,根系中苹果酸和柠檬酸能被检测到,但是丁二酸却没有检测到。草酸的含量在根系中各种有机酸中是最高的。无论在正常还是镉胁迫的条件下,外源施加硅都能显著地增加根系草酸的含量。苹果酸的变化趋势与其他几种有机酸的变化趋势完全不同,外源施加硅对苹果酸的含量起到了负作用。无论在正常还是镉存在的条件下,外源施加硅都减少了苹果酸的含量。根系中丙二酸在正常条件下没有受到外源施加硅的影响。但是当高粱幼苗遭受到镉胁迫后,丙二酸的含量显著增加,并且硅可以明显地提高丙二酸的增加幅度。柠檬酸的含量在正常条件下受到外源施加硅的负调节。经过3 d镉毒害处理后,根系中柠檬酸的含量显著地增加,并且其含量不受到外源施加硅的影响。
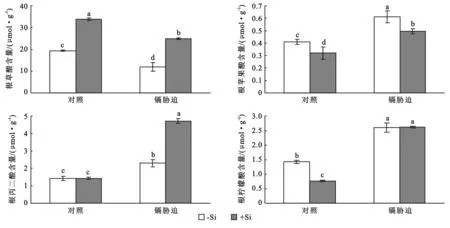
图3 镉胁迫下硅对高粱幼苗根系有机酸含量的影响
3 讨论与结论
由于镉有非常强的流动性,因此其可以在植物体内任何组织积累对植物的生长产生抑制作用。过去的研究表明:大量镉的积累会通过改变叶绿体的超微结构[13],降低光合作用相关基因的表达[14],抑制与CO2固定相关酶的活性来降低植物的光合速率,从而引起植物生物量的减少[15]。外源施加硅后对镉毒害的缓解作用已经在很多植物中得到验证,例如:在玉米和黄瓜[3,16]中外源施加硅都能增强其抗镉毒害的能力。在本试验中,正常条件下,外源施加硅对高粱幼苗的生物量没有明显影响。但是当经过3 d镉毒害后,外源施加硅能显著地增加地下部分和地上部分的生物量。所以,本试验的结果也能证明,外源施加硅能显著地增强高粱幼苗对镉毒害的抵抗作用。
对于硅增强植物抗镉毒害的作用机理已经在很多方面进行了广泛的研究。其中一个重要的作用机制就是外源施加硅能增强植物的抗氧化能力,维持细胞膜的稳定性,从而增强植物的抗镉毒害的能力。Lukaĉová等[17]的研究结果表明:当玉米遭遇到高浓度的镉胁迫时,外源施加硅能显著地增强SOD,POX的活性而CAT的活性却受到硅的抑制。当用小白菜作为研究材料,研究硅对抗氧化酶活性影响的时候发现:SOD,CAT,APX的活性都由于外源施加硅而得到显著增强[18]。本试验中,在镉处理的条件下,外源施加硅能显著增强POD,CAT的活性,而SOD的活性没有显著变化。这些结果说明:硅在调节植物抗氧化酶活性方面随着植物种类的不同而不同。
除了外源施加硅能改善植物的抗氧化能力之外,关于硅在镉吸收及运输过程中所起的物理屏障的作用受到越来越广泛的重视。对这些试验进行分析我们发现:这些试验镉处理的时间都相对较长(大于7 d),这样有利于根系木栓化形成。本试验在水培中进行,这样的培养条件不利于木栓化的形成,并且我们处理的时间尺度也相对较短,所以我们认为还存在其它作用机制。过去很多研究表明:植物体内大量合成的有机酸通过硫醇残基与重金属元素螯合能增强植物对重金属毒害的抗性[19-20]。并且有试验已经证明在重金属胁迫的条件下硅能促进有机酸的合成。当玉米遭遇到重金属毒害时,外源施加硅能促进有机酸的分泌,从而增强玉米对重金属毒害的抵抗性[21]。因此,在本试验中我们也测定了有机酸含量的变化趋势。试验结果表明:无论是在根系还是叶片,在镉胁迫的条件下外源施加硅能增加有机酸的含量。这个结论在我们的试验中是首次发现的。值得注意的一点是:尽管根系苹果酸的含量有所下降,但是这并不影响硅通过增加有机酸的含量来增强高粱的抗镉毒害能力。因为苹果酸的含量要远低于其他几种有机酸尤其是草酸的含量。大量合成的有机酸一方面通过与镉螯合降低其毒性,另一方面有机酸与镉的螯合物沉积在细胞壁上也能降低镉的毒性[19]。到目前为止,关于硅调控植物生理和分子活动的作用机制的研究还没有取得突破性的进展,所以关于硅如何调控不同有机酸的合成还需要进一步的研究。
本试验的结果表明:当高粱幼苗遭受到镉胁迫后,外源施加硅能显著地缓解镉对高粱幼苗生长造成的影响。在此基础上我们又进一步深入的探讨其作用机理。一方面:硅能增强高粱体内抗氧化酶的活性,减轻镉毒害造成的膜脂过氧化;另一方面,外源施加硅还能促进高粱体内有机酸大量合成,从而引起镉毒性的降低。
[1] Clemens S. Toxic metal accumulation, responses to exposure and mechanisms of tolerance in plants[J]. Biochimie,2006,88(11):1707-1719.
[2] 王丽,王力,和文祥,等.神木煤矿区土壤重金属污染特征研究[J].生态环境学报,2011,20(8):1343-1347.
[3] Vaculík M, Landberg T, Greger M, et al. Silicon modifies root anatomy, and uptake and subcellular distribution of cadmium in young maize plants[J]. Annals of Botany,2012,110(2):433-443.
[4] 刘劲松,石辉,李秧秧.镉胁迫对黄瓜幼苗光合和叶绿素荧光特性的影响[J].水土保持研究,2012,18(5):187-190.
[5] Epstein E. Silicon[J]. Annual Review of Plant Biology,1999,50(1):641-664.
[6] Garbuzov M, Reidinger S, Hartley S E. Interactive effects of plant-available soil silicon and herbivory on competition between two grass species[J]. Annals of Botany,2011,108(7):1355-1363.
[7] Dallagnol L J, Rodrigues F A, Tanaka F A O, et al. Effect of potassium silicate on epidemic components of powdery mildew on melon[J]. Plant Pathology,2012,61(2):323-330.
[8] Gong H, Zhu X, Chen K, et al. Silicon alleviates oxidative damage of wheat plants in pots under drought[J]. Plant Science,2005,169(2):313-321.
[9] Hattori T, Sonobe K, Araki H, et al. Silicon application by sorghum through the alleviation of stress-induced increase in hydraulic resistance[J]. Journal of Plant Nutrition,2008,31(8):1482-1495.
[10] Chen H M, Zheng C R, Tu C, et al. Chemical methods and phytoremediation of soil contaminated with heavy metals[J]. Chemosphere,2000,41(1):229-234.
[11] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[12] Pinto A P, Simoes I, Mota A M. Cadmium impact on root exudates of sorghum and maize plants: a speciation study[J]. Journal of Plant Nutrition, 2008,31(10):1746-1755.
[13] Souza V L, de Almeida A A F, Lima S G C, et al. Morphophysiological responses and programmed cell death induced by cadmium inGenipaamericanaL.(Rubiaceae)[J]. Biometals,2011,24(1):59-71.
[14] Qian H, Li J, Pan X, et al. Photoperiod and temperature influence cadmium’s effects on photosynthesis-related gene transcription inChlorellavulgaris[J]. Ecotoxicology and Environmental Safety,2010,73(6):1202-1206.
[15] Perfus-Barbeoch L, Leonhardt N, Vavasseur A, et al. Heavy metal toxicity: cadmium permeates through calcium channels and disturbs the plant water status[J]. The Plant Journal,2002,32(4):539-548.
[16] Liang Y, Wong J W C, Wei L. Silicon-mediated enhancement of cadmium tolerance in maize (ZeamaysL.) grown in cadmium contaminated soil[J]. Chemosphere,2005,58(4):475-483.
[17] Lukaĉová Z,vubová R, Kohanová J, et al. Silicon mitigates the Cd toxicity in maize in relation to cadmium translocation, cell distribution, antioxidant enzymes stimulation and enhanced endodermal apoplasmic barrier development[J]. Plant Growth Regulation,2013,70(1):89-103.
[18] Song A, Li Z, Zhang J, et al. Silicon-enhanced resistance to cadmium toxicity inBrassicachinensisL. is attributed to Si-suppressed cadmium uptake and transport and Si-enhanced antioxidant defense capacity[J]. Journal of Hazardous Materials,2009,172(1):74-83.
[19] Suhayda C G, Haug A. Organic acids reduce aluminum toxicity in maize root membranes[J]. Physiologia Plantarum,1986,68(2):189-195.
[20] Boominathan R, Doran P M. Organic acid complexation, heavy metal distribution and the effect of ATPase inhibition in hairy roots of hyperaccumulator plant species[J]. Journal of Biotechnology,2003,101(2):131-146.
[21] Kidd P S, Llugany M, Poschenrieder C H, et al. The role of root exudates in aluminium resistance and silicon-induced amelioration of aluminium toxicity in three varieties of maize (ZeamaysL.)[J]. Journal of Experimental Botany,2001,52(359):1339-1352.
TheEffectandMechanismofSilicononSorghumSeedlingsGrowthUnderCadmiumStress
LIU Peng1, YIN Li-na1,2, WANG Shi-wen1,2, DENG Xi-ping1,2
(1.StateKeyLaboratoryofSoilErosionandDrylandFarmingontheLoessPlateau,InstituteofSoilandWaterConservation,ChineseAcademyofSciencesandMinistryofWaterResources,Yangling,Shaanxi712100,China; 2.InstituteofSoilandWaterConservation,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
Although the effects of silicon on cadmium resistance are wildly reported, the underlying mechanism is still unclear. In the present study, we investigated the effect and mechanism of silicon on sorghum seedling growth under cadmium stress. The result indicated silicon application alleviated cadmium-induced decrease in fresh weight and dry weight both of shoot and root. The result indicated that the anti-oxidant enzyme activity was not affected by silicon under control condition. However under cadmium stress, the CAT and POD activity were significantly increased by silicon. The SOD activity was not influenced by silicon. Corresponding to this result, MDA was decreased by silicon. The result indicated that 3 types of organic acids (OA) including oxalic acid, propanedioic acid and succinic acid were detected in leaf. All of them were increased by silicon under cadmium stress. In the root, 4 types of OA such as oxalic acid, malic acid, propanedioic acid and citric acid were detected. Oxalic acid and propanedioic acid contents were increased by silicon. Citric Acid content was not influenced by silicon. However, the malic acid was decreased by silicon. All of the results indicated that the enhancement of anti-oxidant enzyme activity and OA content involved in the silicon-induced sorghum seedlings cadmium resistance.
silicon; cadmium; anti-oxidant enzyme; organic acid
2014-05-16
:2014-07-04
国家自然科学基金(31101597);教育部高校基本科研业务费(QN2012048)
刘朋(1983—),男,山东泰安市人,博士,主要研究方向为植物生理生态。E-mail:412315121@qq.com
邓西平(1959—),男,陕西西安市人,博士,研究员,主要研究方向为植物生理生态。E-mail:dengxp@ms.iswc.ac.cn
Q945.78
:A
:1005-3409(2014)06-0329-05
