柴达木盆地不同生长期菊芋叶片绿原酸含量变化规律研究
2014-09-20,,,,
,,,,
(中国科学院藏药研究重点实验室,中国科学院西北高原生物研究所,青海西宁 810008)
柴达木盆地不同生长期菊芋叶片绿原酸含量变化规律研究
岳会兰,毕宏涛,于瑞涛,张本印,陶燕铎*
(中国科学院藏药研究重点实验室,中国科学院西北高原生物研究所,青海西宁 810008)
本研究以柴达木盆地不同生长期菊芋叶片为研究材料,建立了菊芋叶片绿原酸HPLC快速定量检测方法,并对柴达木盆地菊芋叶片绿原酸含量随生长期变化规律进行研究。在选择流动相时,本文对测定条件进行优化,获得了较好的分离度,并进行了标准曲线的绘制。对不同采集时间菊芋叶片绿原酸含量测定结果表明,不同生长期菊芋叶片绿原酸含量差异显著,最高月份含量可达到最低月份含量的2倍,8月1日至10月15日菊芋叶片绿原酸含量呈上升趋势,至10月15日达到最高(叶片干重的0.83%),随后逐渐降低。以上实验数据表明,柴达木地区作为绿原酸提取原料的菊芋叶片采收期以10月15日左右为宜。
菊芋,绿原酸,含量,变化规律
菊芋(HelianthustuberosusL.),属菊科向日葵属多年生宿根草本植物,因其地上似菊,地下为芋而得名,俗名洋姜、鬼子姜等。原产自北美洲,于17世纪传入欧洲,后传入伊朗、中国和日本。全球的热带、温带、寒带以及干旱、半干旱地区都有菊芋的分布[1]。近几年,我国对能源植物的开发和利用极大地促进了菊芋的大面积种植及开发项目的启动,需求量日趋增大,逐渐形成了很多较为规范化、规模化的菊芋种植园区和深度开发项目,并形成了规模日趋扩大的较为完整的“菊芋块茎种植加工产业”链。但在菊芋产业链中,菊芋地上部分的利用程度不高。绿原酸(Chlorogenic acid)类化合物广泛存在于植物中,是植物体在有氧呼吸过程中经莽草酸途径产生的一种苯丙素类化合物,为多酚类化合物,是菊芋的重要生理活性成分[2-3],具有降压、利胆、清除自由基、抗肿瘤、抗氧化、抗衰老等多种药理学功能[4-5]。目前,医药产业中所需的绿原酸主要来源于金银花和杜仲的叶片中[6-7],而菊芋叶片绿原酸的研究还处于起步阶段[8-10]。因此,为了明确菊芋叶片绿原酸含量变化规律,更好的将其应用于医药领域,本研究将建立HPLC菊芋叶片绿原酸快速定量检测方法,并对柴达木盆地菊芋叶片绿原酸含量随生长期变化规律进行研究,以期为菊芋叶片中绿原酸的高效利用提供依据。
1 材料与方法
1.1材料与仪器
菊芋品种J1 由兰州大学刘建全教授课题组提供;菊芋叶片采集于青海省海西蒙古族藏族自治州都兰县西河滩村菊芋种植基地(海拔2830m;N36.386,E98.024),分别于2012年8月至11月期间每月1日和15日采集7份样本(样本编号:QHDL-1、QHDL-2、QHDL-3、QHDL-4、QHDL-5、QHDL-6和QHDL-7),洗净后低温烘干备用;绿原酸对照品 购于中国药品生物制品检测所;乙腈为色谱纯 山东禹王;其它试剂均为分析纯。
Agilent 1200高效液相色谱仪,紫外检测器Agilent化学工作站 美国安捷伦公司;UPT-I-5超纯水机 成都超纯科技有限公司;AG204电子分析天平 梅特勒公司;烘箱 上海一恒科学仪器有限公司;WP800SL23-2微波实验仪 南京汇研微波系统工程有限公司。
1.2色谱条件
色谱柱:Dikma SynerSi 4u Fusion-RP 80R 250×4.6mm 4 micron;柱温:30℃;流速:1.0mL/min;检测波长:327nm;流动相:0.2%磷酸∶乙腈=82∶18;进样量10μL。
1.3对照品溶液制备
用精密称取绿原酸对照品10mg,用60%乙醇溶解并定容于50mL容量瓶,摇匀,得到0.2mg/mL储备液。再分别稀释到0.1、0.08、0.06、0.04、0.02mg/mL和0.01mg/mL,用60%乙醇定容于25mL容量瓶摇匀待用。
1.4菊芋叶片绿原酸待测溶液制备
各样品分别取菊芋叶片烘干、粉碎,过80目筛。精密称取粉碎的菊芋叶片1g(3份),加入20mL 60%乙醇,微波回流提取2次,每次25min,合并滤液,定容至50mL。将提取液过0.45μm滤膜,作为样品溶液。
2 结果与分析
2.1线性关系考察
精密吸取对照品溶液10μL注入高效液相色谱仪,测定其峰面积,见图1。以峰面积积分值为纵坐标(Y),样品重量(μg)为横坐标(X),绘制标准曲线,结果表明绿原酸在0.1~1.0μg范围内呈良好的线性关系。回归方程为y=1503.3x+183.62,相关系数R2为0.9994。
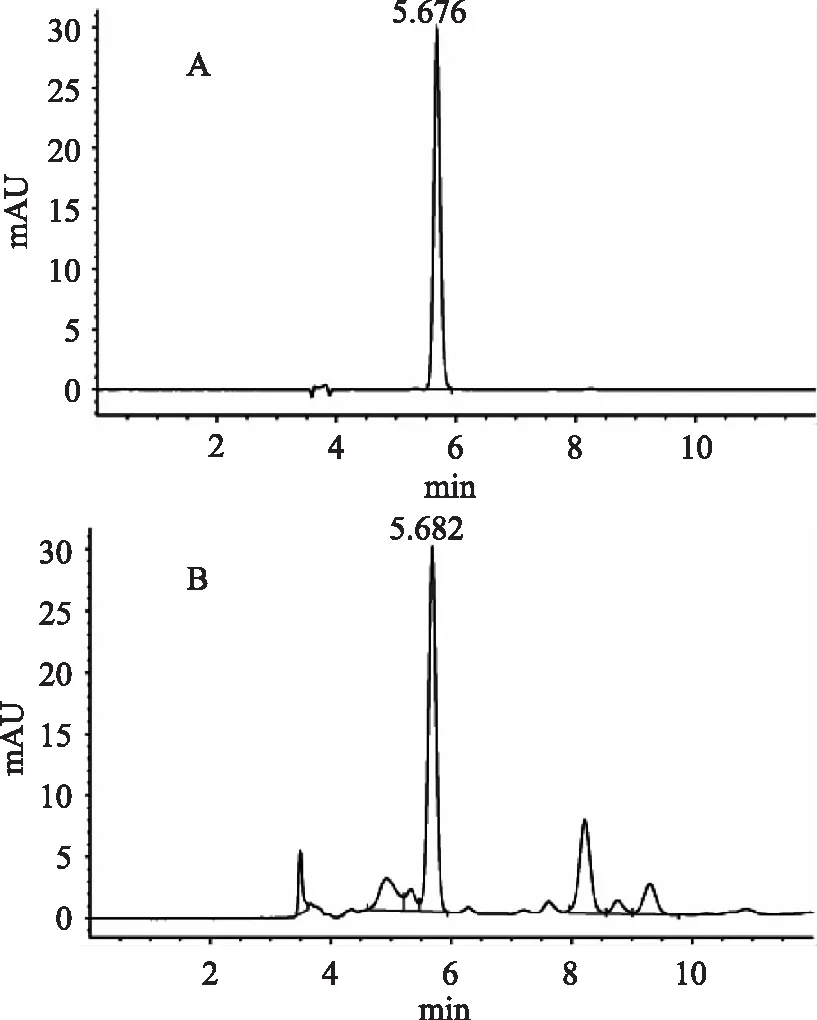
图1绿原酸对照品(A)和菊芋叶样品(B)HPLC图谱
2.2精密度实验
精密吸取对照品溶液10μL注入高效液相色谱仪,重复进样6次,测定其峰面积,RSD为0.291%,精密度良好,结果见表1。
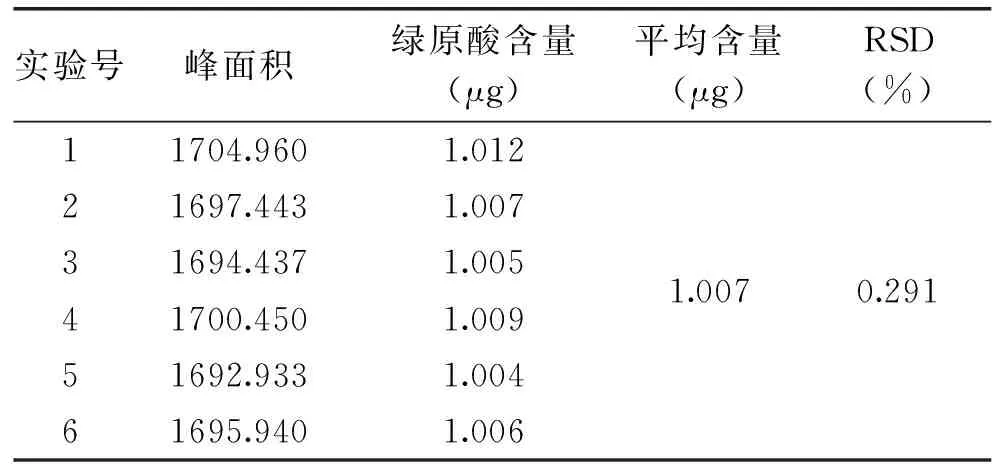
表1 精密度实验
2.3稳定性实验
取上述对照品溶液,每隔4h进样,每次进样10μL,测定其峰面积,结果表明在24h内绿原酸基本稳定,结果见表2。
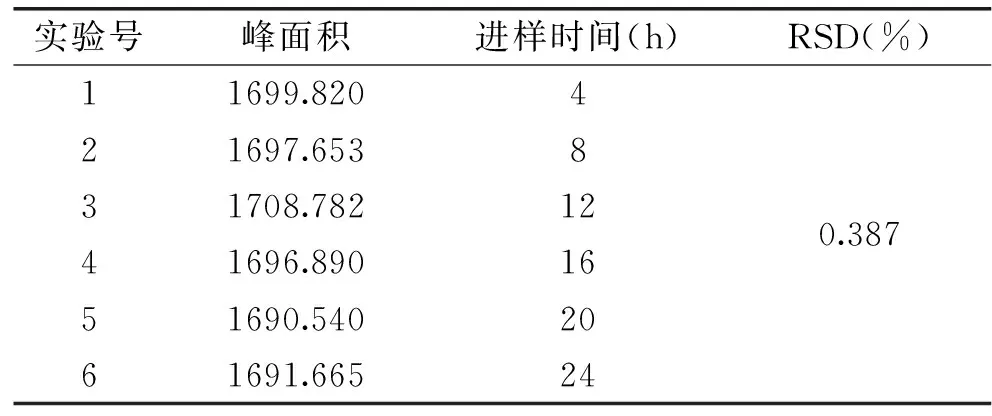
表2 稳定性实验
2.4重复性实验
精确称取QHDL-6样品6份,依1.5方法制备样品溶液,每次进样10μL,分别在相同条件下测定绿原酸的含量,结果见表3,QHDL-6样品的平均含量为0.829%,RSD=0.366%,结果表明实验重复性良好。
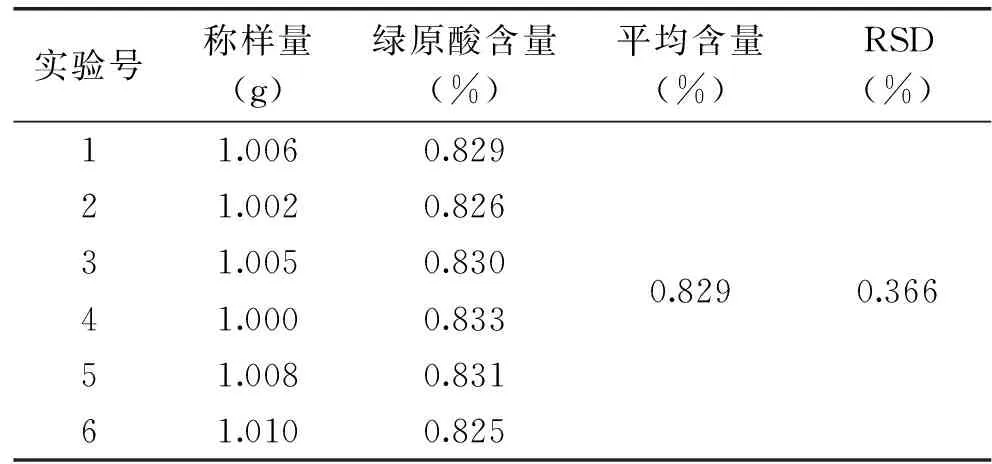
表3 重复性实验
2.5加样回收率实验
在样品中加入一定浓度的绿原酸对照品溶液,按“样品测定溶液的制备”项下操作,在上述色谱条件下进行测定,分别计算加样回收率,结果见表4,绿原酸的平均回收率为96.4%,RSD=0.871%。

表4 绿原酸回收率
2.6样品含量的测定
分别称取菊芋叶片粉末,按“1.5”的方法制备供试液,测定含量,结果见表5。

表5 菊芋叶片材料编号与采集日期及其绿原酸含量
注:表中p值表示该采集日期与前一日期含量比较的差异显著性。
对样品绿原酸含量的测定结果显示,柴达木地区菊芋叶片绿原酸含量随其生长期变化明显。菊芋叶片绿原酸含量从8月1日干重的0.42%增长到10月15日的0.83%,随后下降至11月1日的0.73%。而10月1日至11月1日期间,正是菊芋块茎的关键膨大期,块茎增重明显,其中10月15日至11月1日期间,柴达木地区气温骤降,地上部分逐渐失水,至11月1日后,叶片完全失水变脆。地上部分绿原酸类化合物的合成可能与其块茎的膨大有一定的关系。
3 结论
本研究在选择流动相时,参照张海娟等[10]的测定条件,并进行了优化,降低了甲醇-水-磷酸体系中磷酸浓度。根据前期预实验结果本实验选择0.2%的磷酸为流动相条件,不仅可以减少高浓度磷酸对柱填料的伤害,同时也能获得较好的分离度。此外,采用峰面积积分值为纵坐标(Y),样品重量(μg)为横坐标(X)做标准曲线,避免进样体积对含量测定的影响。
对不同采集时间菊芋叶片绿原酸含量测定结果表明,不同生长期菊芋叶片绿原酸含量差异显著,8月1日至10月15日菊芋叶片绿原酸含量呈上升趋势,至10月15日达到最高(叶片干重的0.83%),随后逐渐降低。以上实验数据说明,柴达木地区作为绿原酸提取原料的菊芋叶片采收时期以10月15日左右为宜。目前还没有文献报道过菊芋叶片中绿原酸随时间变化规律的研究,尤其是青海产菊芋叶片中绿原酸的相关研究尚未见报道。本研究对青海产菊芋叶片中绿原酸的采收和高效利用提供了重要的理论指导。
[1]Stanley JK,Stephen FN. Biology and Chemistry of Jerusalem Artichoke[M]. New York:CRC Press,2008,55.
[2]Tchone M,Barwald G,Annemuller G,etal. Separation and identification of phenolic compounds in Jerusalem artichoke(Helianthus tuberosus L.)[J]. Science Des Aliments,2006,26(5):394-408.
[3]Jaiswal R,Deshpande S,Kuhnert N. Profiling the chlorogenic acids of Rudbeckia hirta,Helianthus tuberosus,Carlina acaulis and Symphyotrichum novae-angliae leaves by LC-MSn[J]. Phytochemical Analysis,2011,22(5):432-441.
[4]Zhao YY,Wang JK,Ballevre O,etal. Antihypertensive effects and mechanisms of chlorogenic acids[J]. Hypertension Research,2012,35(4):370-374.
[5]Mubarak A,Bondonno CP,Liu AH,etal. Acute effects of chlorogenic acid on nitric oxide status,endothelial function,and blood pressure in healthy volunteers:a randomized trial[J]. Journal of Agricultural and Food Chemistry,2012,60(36 SI):9130-9136.
[6]兰小艳,张学俊,龚桂珍. 杜仲叶中绿原酸的研究进展[J].中国农学通报,2009,25(21):86-89.
[7]罗磊,郭晓园. 金银花中绿原酸的研究进展[J]. 农产品加工,2008,8:60-62.
[8]袁晓艳,高明哲,王锴,等. 高效液相色谱-质谱法分析菊芋叶中的绿原酸类化合物[J]. 色谱,2008,l26(3):335-338.
[9]张海娟,刘玲,郑晓涛,等. 菊芋叶片绿原酸的提取工艺条件优化研究[J]. 食品工业科技,2011,32(5):261-265.
[10]张海娟,黄增荣,隆小华,等. HPLC法测定不同品种不同产地菊芋叶片中绿原酸的含量[J]. 天然产物研究与开发,2011,23(5):1107-1109.
Research of the contents variation of chlorogenic acid in the leaves ofHelianthustuberosusL. during different growth stages in Chaidamu
YUEHui-lan,BIHong-tao,YURui-tao,ZHANGBen-yin,TAOYan-duo*
(Key Laboratory of Tibetan Medicine Research,Northwest Institute of Plateau Biology, Chinese Academy of Sciences,Xining 810008,China)
In this study,the rapid HPLC quantitative detection method of chlorogenic acid,and the contents variation of chlorogenic acid in the leaves ofHelianthustuberosusL. during different growth stages in Chaidamu were studied. In the choice of the mobile phase,the determination conditions were optimized,and obtained a better resolution. In addition,the standard curveand was carried out. The results showed that the chlorogenic acid contents in the leaves ofHelianthustuberosusL. during different growth stages had significant differences. The chlorogenic acid contents in the leaves ofHelianthustuberosusL. during August 1st to October 15th had an upward trend,and the highest content was reached on October 15th. The above experimental data indicated that the harvest period ofHelianthustuberosusL. should be determined around the October 15th.
HelianthustuberosusL.;chlorogenic acid;content;variation
2013-07-15 *通讯联系人
岳会兰(1981-),女,博士,助理研究员,主要从事药物化学及新药研发。
青海省省科技厅“菊芋适宜性栽培技术研究”(2011-N-515)。
TS201.2
:A
:1002-0306(2014)01-0283-03
