榨前分离苹果皮多糖的鉴定及抗氧化活性研究
2014-09-20,,,,,
,,,,,
(陕西师范大学食品工程与营养科学学院,陕西西安 710062)
榨前分离苹果皮多糖的鉴定及抗氧化活性研究
窦姣,郭玉蓉*,薛战锋,陈玮琦,李锦运,孟永宏
(陕西师范大学食品工程与营养科学学院,陕西西安 710062)
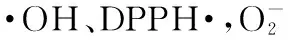
苹果皮,多糖,分离纯化,抗氧化活性
多糖又称多聚糖(polysaccharides),由10个以上单糖残基通过糖苷键连接而成,是一类广泛存在于动植物、微生物细胞中的重要的生物大分子物质[1]。随着对多糖生物活性研究的深入及其在医药领域的广泛应用,消费者对多糖的需求日趋增加[2-3]。苹果多糖是植物多糖的重要种类之一,苹果渣可以作为苹果多糖来源之一,我国作为世界的苹果浓缩汁生产大国,每年都有上百万吨的苹果渣资源急需再利用[4]。榨前分离技术是采用冷破碎设备在果汁压榨前实现果皮、果核、果籽与果肉的分离,从而提高果汁的外观品质,方便苹果皮、肉的分别利用[5]。苹果果皮是苹果的重要组成部分,其中多糖含量丰富,是一种有开发前景的提取多糖的材料。目前,粗多糖中常含有单糖、低聚糖、游离蛋白质、色素等杂质,不但会影响多糖生物活性,还会影响多糖的定量、定性分析及结构测定,因此多糖的分离纯化成为多糖研究和利用的重要内容之一[6]。另外,多糖的生物活性也是研究的热点之一,国内外对苹果多糖生物活性的研究主要集中在降血脂、抗癌、预防肥胖和降低胆固醇水平等方面[7],但对苹果皮多糖的研究尚未见报道。本实验主要通过对榨前分离苹果皮中的多糖进行提取、分离、纯化并进一步研究其不同组分的抗氧化活性,旨在对我国苹果皮资源的开发利用提供一些新思路。
1 材料与方法
1.1材料与仪器
苹果皮 陕西师范大学冷破碎制汁生产线提供;透析袋 华美生物工程公司上海分公司;Cellulose DE-52纤维素柱填料、Sephadex G-200 medium凝胶柱填料 北京索莱宝科技有限公司提供;无水乙醇、石油醚、乙醚、NaCl、苯酚、浓硫酸、邻苯三酚、三羟甲基氨基甲烷(Tris)、1,1-二苯基-2-三硝基苯肼(DPPH)、三氯乙酸、Na2HPO4、NaH2PO4、硫酸亚铁铵、铁氰化钾、邻二氮菲、H2O2均为分析纯。
实验DBS-100部分自动收集器、DHL-B电脑横流泵 上海沪西仪器厂;RE 52-99旋转蒸发仪 上海亚荣生化仪器厂;LGJ-18C冷冻干燥机 北京四环科学仪器厂;WFJ2100型分光光度计 尤尼科仪器有限公司上海分公司;TU-1810紫外可见分光光度计 北京普析通用仪器厂;PHS-3C精密PH计 上海精密科学仪器有限公司;高速万能粉碎机 北京科伟永兴仪器有限公司;SGW-1自动旋光仪 湖北省自动化研究所。
1.2实验方法
1.2.1 榨前分离苹果皮多糖的提取制备 苹果皮→55℃干燥→粉碎(过60目筛)→乙醚∶石油醚(1∶4)回流脱脂→超声辅助提取(120min,料液比1∶40,70℃,超声功率200W)→95%乙醇沉淀(4℃,静置过夜)→离心20min(4000r/min)→沉淀物用无水乙醇、丙酮洗涤2次→真空冷冻干燥→苹果皮粗多糖。
1.2.2 榨前分离苹果皮多糖的分离纯化 苹果皮多糖的分离:苹果皮粗多糖→用蒸馏水溶解→过DE-52纤维素柱→不同浓度NaCl溶液梯度洗脱→收集不同组分苹果皮多糖→浓缩(原体积的1/6)→透析→浓缩→真空冷冻干燥→不同组分苹果皮多糖半纯品。
苹果皮多糖的纯化:苹果皮多糖半纯品→用蒸馏水溶解→过G-200凝胶柱→蒸馏水洗脱→收集不同组分苹果皮多糖→浓缩(原体积的1/4)→透析→浓缩→真空冷冻干燥→不同组分苹果皮多糖纯品[8]。
1.2.3 不同组分苹果皮多糖的鉴别反应
1.2.3.1 多糖的纯度鉴定 将分离纯化得到的不同组分多糖纯品配制成10mg/mL溶液,以化学方法进行淀粉、多肽、蛋白质和氨基酸等杂质的检验。茚三酮反应鉴别是否含氨基酸、肽类或蛋白质等杂质;苯酚-硫酸法鉴定是否为糖类物质;三氯化铁反应鉴别是否含酚类物质;碘-碘化钾反应鉴别是否含淀粉类杂质;硫酸-咔唑法鉴定是否含有糖醛酸[9]。
1.2.3.2 比旋光度的测定 不同种类的多糖在相同条件下的比旋光度不同,通过测定不同组分多糖溶液的比旋光度来鉴定分离出的多糖是否是同一多糖[10]。每一组分多糖的比旋光度测定8次取平均值。
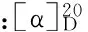
1.2.3.3 不同组分多糖紫外光谱扫描 蛋白质、多肽、核酸等物质在260~280nm处有明显吸收峰,通过紫外扫描鉴别多糖中是否含有蛋白质类杂质[11]。
1.2.4 榨前分离苹果皮多糖体外抗氧化活性研究
1.2.4.1 测定不同组分多糖对·OH的清除能力 应用邻二氮菲-Fe2+-H2O2法检测[12]。以不同组分苹果皮多糖为自由基清除剂,测定苹果皮多糖对·OH的清除能力。反应体系中分别加入邻二氮菲、pH7.4的磷酸缓冲液、FeSO4溶液、不同组分和浓度的苹果皮多糖。苹果皮多糖的浓度设定为1.0、2.0、4.0、6.0、8.0、10.0mg/mL。实验设置加样管、氧化管、对照管,37℃水浴锅中保温60min,在510nm处测定吸光值,每个处理进行三次重复,以Vc作对照,计算清除率。邻二氮菲-Fe2+-H2O2反应体系组成见表1。
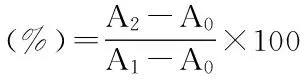
式中:A0表示氧化管的吸光值;A1表示对照管的吸光值;A2表示加样管的吸光值。
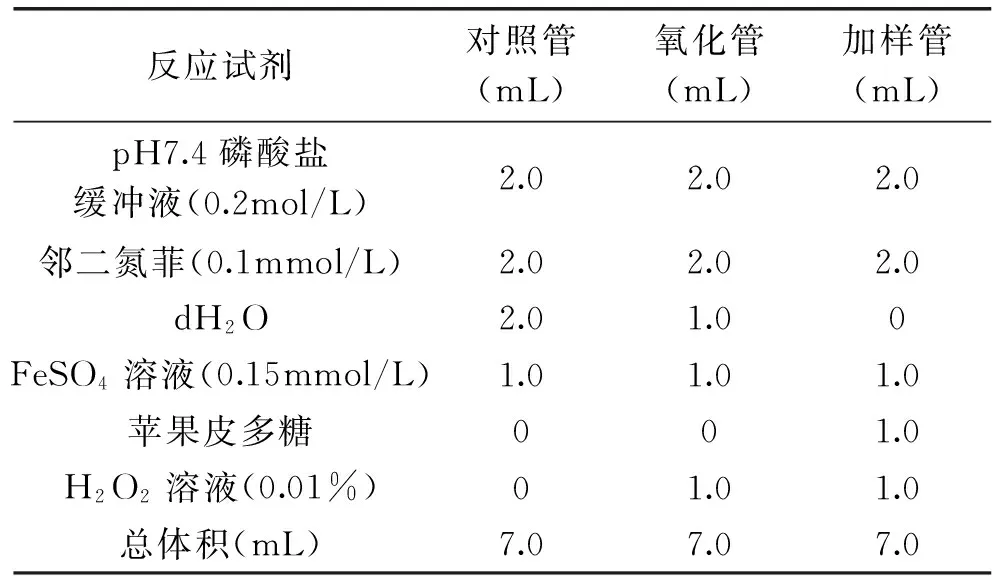
表1 邻二氮菲-Fe2+-H2O2反应体系组成表Table 1 The composed table of the1,10-phenanthroline-Fe2+-H2O2 reaction system

式中:A0表示自氧化管氧化速率;A1表示加样管氧化速率。
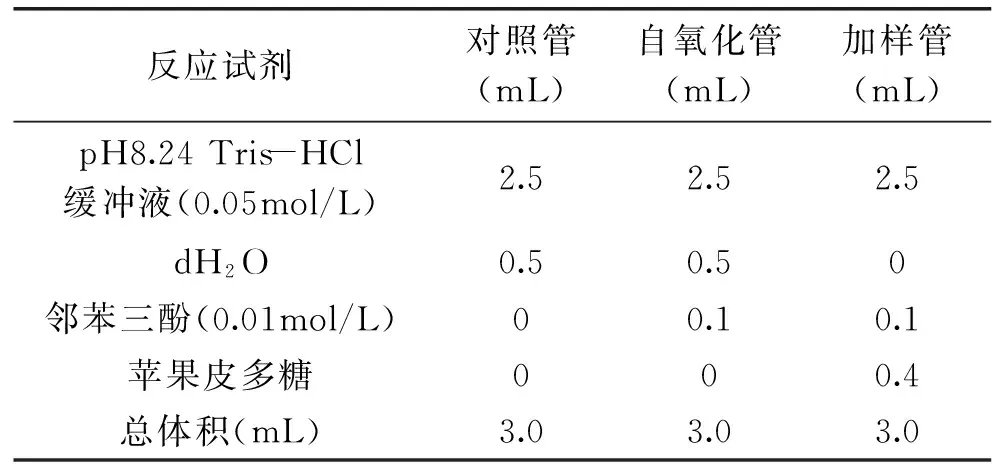
表2 邻苯三酚自氧化反应体系组成表Table 2 The composed table of the self-oxidation of1,2,3-phentriol reaction system
1.2.4.3 测定不同组分多糖对DPPH·的清除能力 分别配制浓度为1.0、2.0、4.0、6.0、8.0、10.0mg/mL的不同组分多糖溶液。移取各浓度的糖溶液2.0mL于小试管中,分别加入0.2mmol/L的DPPH溶液2.0mL并摇匀,静置40min,以体积分数为50%乙醇作空白调零[14],在525nm处测定吸光值,每个处理重复三次,以VC作对照,计算清除率。
式中:A0为未加苹果皮多糖DPPH溶液的吸光值;Ai为加苹果皮多糖后DPPH溶液的吸光值;Aj为对应多糖溶液自身的吸光值。
1.2.4.4 不同组分多糖总还原力的测定 分别配置浓度为1.0、2.0、4.0、6.0、8.0、10.0mg/mL的多糖溶液。取1mL多糖溶液,加入2.5mLpH6.6的磷酸盐缓冲液,再加入2.5mL1%的铁氰化钾混匀,50℃水浴20min,立即加入2.5mL10%的TCA终止反应,4000r/min离心10min。取上清液2.5mL于试管中,先加入2.5mL无水乙醇,再加入质量分数0.1%的FeCl3溶液0.5mL,混匀,以蒸馏水作空白调零,以VC作对照,在700nm处测定吸光值[15]。
2 结果与分析
2.1榨前分离苹果皮多糖的分离纯化
苹果皮粗多糖(applepeelpolysaccharides,APPS)过DE-52纤维素柱,利用不同浓度的NaCl溶液梯度洗脱得到三个含量较大的洗脱峰,分别为蒸馏水洗脱峰、0.3mol/LNaCl洗脱峰、0.9mol/LNaCl洗脱峰,0.1、0.5、0.7mol/LNaCl洗脱未得到明显的洗脱峰,将各组分再过SephadexG-200层析柱进一步纯化后,分别得到单一的洗脱峰,说明得到的三个组分均为分子量相同的同一组分,将其依次命名为APPS-H2O(水洗组分)、APPS-0.3mol/L(0.3mol/LNaCl洗脱组分)和APPS-0.9mol/L(0.9mol/LNaCl洗脱组分)。APPS-0.3mol/L、APPS-H2O和APPS-0.9mol/L三种组分多糖的得率分别为:19.3%、12.1%、8.2%。

图1 苹果皮多糖过Sephadex G-200 的洗脱曲线
2.2三种不同组分多糖的纯度鉴定结果
对分离得到的三种不同组分苹果皮多糖进行紫外光谱扫描,结果见图2。发现在260~280nm处没有明显的吸收峰,且茚三酮反应结果为阴性,说明分离得到的三种多糖均不含蛋白质和核酸类物质;苯酚-硫酸法和硫酸-咔唑反应结果均为阳性,说明三种组分由糖醛酸类糖组成;三氯化铁反应和碘-碘化钾反应均呈阴性,说明三种组分不含酚类物质,是非淀粉多糖。
不同多糖具有不同的比旋光度,利用这一原理可以鉴定三种多糖是否为同一多糖。此外,不同多糖在不同浓度的乙醇溶液中具有不同的溶解度,多糖水溶液经不同浓度的乙醇沉淀,如所得沉淀物具有相同的比旋光度则证明该多糖为均一组分。通过对APPS-H2O,APPS-0.3mol/L和APPS-0.9mol/L三种多糖的比旋光度测定,发现三种多糖具有不同的比旋光度,说明分离纯化得到的三种组分不是同一种多糖。经不同浓度的乙醇沉淀,所得沉淀物的比旋光度基本相同,说明三种多糖均为均一多糖。

图2 三种不同组分苹果皮多糖的紫外扫描图谱
2.3榨前分离苹果皮多糖体外抗氧化能力测定结果
2.3.1 三种不同组分多糖对·OH的清除能力 由图3可以看出,粗多糖及分离纯化得到的三种组分多糖均具有一定的清除·OH能力,其清除能力与多糖浓度在一定范围内呈正相关,浓度越高其清除能力越强。APPS-H2O清除·OH能力强于APPS-0.3mol/L和APPS-0.9mol/L,而后两者清除·OH的能力相当。原因可能是多糖对·OH的清除能力与多糖的极性有关,而水洗组分APPS-H2O为复合有酚类基团的弱极性组分,所以其抗氧化活性强于盐洗组分APPS-0.3mol/L和APPS-0.9mol/L[9]。
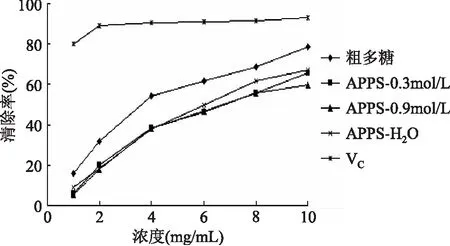
图3 三种不同组分多糖清除·OH的能力

图4 三种不同组分多糖清除·的能力
2.3.3 三种不同组分多糖对DPPH·的清除能力 由图5可以看出,三种组分多糖均有一定的清除DPPH·能力,其清除DPPH·能力与多糖浓度在一定的浓度范围内呈正相关。APPS-H2O清除DPPH·能力强于APPS-0.3mol/L和APPS-0.9mol/L。这可能与多糖的极性有关,水洗组分APPS-H2O的极性比盐洗组分APPS-0.3mol/L和APPS-0.9mol/L低,极性越弱,其清除能力越强,抗氧化活性越高。这一结果与前人在多糖纯化中取得的结果相同[9]。
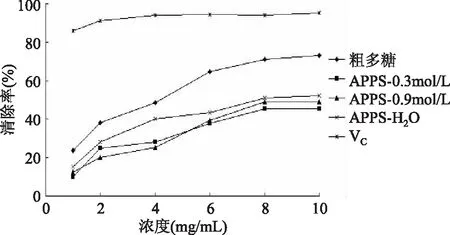
图5 三种不同组分多糖清除DPPH·的能力
2.3.4 三种不同组分多糖的总还原力测定 由图6可以看出,三种组分多糖均有一定的还原力,但是OD值均很小。在相同浓度下,APPS-H2O的还原力略高于APPS-0.3mol/L和APPS-0.9mol/L,而后两者的还原力较接近,在一定浓度范围内表现出量效关系,即随着多糖浓度的增加,其还原力也逐渐增加。多糖经过纯化后,还原力均比粗多糖要低,且低于Vc。原因可能为:在纯化过程中粗多糖中抗氧化能力较强的酚类物质被滞留而与纯品组分分离,导致纯品的总还原力降低[17]。
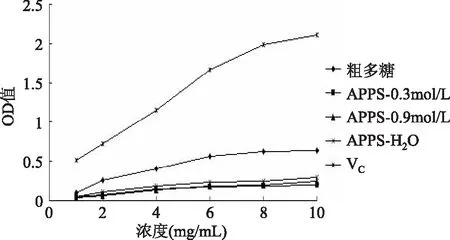
图6 三种不同组分还原力测定结果
3 结论
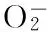
[1]Schepetkin I A,Quinn M T.Botanical polysaccharides:Macrophage immunomodulation and therapetic potential[J]. International Immuno Pharmacology,2006,6(3):317-333.
[2]Tao Y W,Tian G Y.Studies on the physicochemical properties,structure and antitumor activity of polysaccharide YhPS-1 from the root of Cordalisyanhusuo Wang[J].Chinese Journal of Chemistry,2006,24(2):235-239.
[3]Ge Y,Duan Y F,Fang G Z,etal. Study on biological activities of physalis alkekengi var francheti polysaccharide[J].J Sci Food Agric,2009,89(9):1593-1598.
[4]Zhang Y W,Wu C Y,Cheng J T,etal. Merit of astragalus polysaccharide in the improvement of early diabetic nephropathy with an effect on mRNA expressions of NF-κ B and I κ B in renal cortex of streptozotoxin-induced diabetic rats[J].Journal of Ethnopharmacology,2007,114:387-392.
[5]李锦运,郭玉蓉,董守利.冷破碎苹果皮渣中多糖提取工艺优化及除杂方法研究[J].食品工业科技,2011,32(7):274-277.
[6]李巧枝.生物化学实验技术[M].北京:中国轻工业出版社,2007:33-34.
[7]孙立军,郭玉蓉,田兰兰.苹果果胶研究进展[J].食品工业科技,2012,33(4):445-449.
[8]弥曼,李汾,任利君,等.百合多糖的分离纯化及抗肿瘤作用[J].西安交通大学学报:医学版,2009,30(2):177-180.
[9]马惠玲,盛义保,张丽萍,等.苹果渣果胶多糖的分离纯化和与抗氧化活性研究[J].农业工程学报,2008,24:218-222.
[10]张维杰.复合多糖生化研究技术[M].杭州:浙江大学出版社,1984.
[11]朱芳坤,范文秀,祝勇,等.南瓜多糖的性质及光谱分析[J].光谱实验室,2009,26(3):609-613.
[12]林奇龄,温其标,欧仕益,等.阿拉伯糖阿魏酸酯体外清除羟自由基[J].华南理工大学学报:自然科学版,2010,38(10):110-114.
[13]张兰杰,王洪宽,李铁纯,等.盘锦河蟹卵和蟹肉中脂肪酸成分分析及其对超氧阴离子自由基的抑制作用[J].食品科学,2010,31(5):108-110.
[14]滕道祥,马利华,秦卫东.电子顺磁共振技术研究牛芬多糖清除DPPH·自由基作用[J].粮油加工,2010(8):132-134.
[15]马虎飞,王思敏,杨章民.陕北野生枸杞多糖的体外抗氧化活性[J].食品科学,2011,32(3):60-63.
[16]苏钰琦.苹果多糖的分离纯化与抗氧化活性深入研究[D].杨凌:西北农林科技大学,2008.
[17]Amit K,Ghanshyam S C.Extraction and characterization of pectin from apple pomace and its evaluation as lipase inhibitor[J].Carbohydrate Polymers,2010,82(2):454-459.
Purification and antioxidative activity of polysaccharides from cold-extracting apple peel
DOUJiao,GUOYu-rong*,XUEZhan-feng,CHENWei-qi,LIJin-yun,MENGYong-hong
(Shaanxi Normal University,College of Food Engineering and Nutritional Science,Xi’an 710062,China)
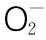
apple peel;polysaeeharides;isolation and purification;antioxidative activity
2013-07-09 *通讯联系人
窦姣(1990-),女,硕士,主要从事食品功能成分开发及利用方面的研究。
农业部现代苹果产业技术体系建设专项基金资助(CARS-28)。
TS201.2
:A
:1002-0306(2014)01-0111-05
