反刍动物有效纤维评价体系及需要量
2014-09-20姚军虎李发弟孙菲菲
姚军虎 李 飞,* 李发弟 孙菲菲
(1.西北农林科技大学动物科技学院,杨凌 712100;2.兰州大学草地农业科技学院,兰州 730020)
反刍动物在进化过程中形成了独特的消化结构,其前胃系统栖居着大量微生物,能够消化富含纤维素和半纤维素的植物性饲料[1]。饲粮纤维在反刍动物生产活动中发挥多种生理功能,包括维持瘤胃功能、维持乳脂率及保证动物健康等[2]。饲粮一定长度(>1.18 mm)的纤维可有效刺激动物的反刍活动、唾液分泌、瘤胃蠕动及维持瘤胃内容物的两相分层,这些功能可有效稳定瘤胃内环境并降低亚急性瘤胃酸中毒(SARA)的风险[3]。保证反刍动物饲粮足够的有效纤维是维持动物健康及高产的重要营养因素。目前的饲料营养评价体系多采用化学分析方法评定营养价值,不能反映饲料的长度和韧性等物理性状的营养学意义。NRC(2001)[4]仅推荐饲粮粗饲料中性洗涤纤维(FNDF)含量,并未考虑饲料的颗粒长度这一指标。有学者提出物理有效中性洗涤纤维(peNDF)这一营养参数用于评定饲料纤维的物理有效性[5]。近年来该领域的研究取得较多重要结果,丰富了纤维物理有效性评定体系的意义和内涵。由于评定体系较多,独立研究提出的需要量结果并不一致。因此,有必要综合该领域研究结果,为确定反刍动物饲粮合理的有效纤维含量提供理论依据。
1 饲粮纤维物理有效性评价方式及体系
一般认为,粪便中的纤维颗粒是经瘤胃逃逸的内容物部分,这部分纤维很快逃离瘤胃,不能有效刺激咀嚼活动[5]。Cardoza等[6]检测了饲喂 40种不同饲粮奶牛粪便中纤维长度,发现3.35 mm以上筛层的粪便颗粒比例<5%,粪便颗粒主要分布在0.40~1.20 mm 筛孔之间。Poppi等[7]研究表明,1.18 mm筛层以上的饲料颗粒能够在山羊和奶牛的瘤胃中长时间存留。这些结果暗示,瘤胃中<1.20 mm的饲料颗粒可快速通过瘤胃,不能有效地刺激反刍活动。目前,多种方式用于评价饲粮纤维的物理有效性,其中以宾州筛(PSPS)为工具,通过评价饲粮颗粒分布并结合中性洗涤纤维(NDF)含量计算的PSPS体系,和以纤维含量、长度和韧性来确定的咀嚼指数(CI)体系(或Danish体系)[8]应用最为广泛,二者在评价纤维物理有效性上各有特点。
1.1 PSPS体系
PSPS体系将纤维物理有效性表示为peNDF,计算为PSPS 1.18或8.00 mm以上筛层NDF占饲粮干物质的比例,分别以peNDF1.18和peNDF8.00表示。PSPS一般包括1个筛底,2个(8.00和19.00 mm)或 3个筛层(1.18、8.00和 19.00 mm),一般认为1.18 mm以上筛层的NDF能有效刺激动物的咀嚼活动。PSPS体系计算的peNDF主要基于3个假设:1)不同筛层饲料NDF含量一致;2)1.18 mm不同筛层的NDF对咀嚼活动的刺激能力相同;3)不同饲料来源的NDF韧性相同。
由于其操作简单,获取和分析数据方便,可用于评定全混合日粮(TMR)的混合均匀程度。PSPS体系在北美地区及我国得到较为广泛的应用,但其基本假设存在一定的局限。PSPS体系主要应用于混合均匀的TMR,在该情况下各筛层的NDF含量基本一致,但有研究表明,PSPS各筛层NDF含量差异较大,Bhandari等[9]发现,TMR 各筛层NDF含量分别为53.9%(19.00 mm)、34.4%(8.00 mm)、29.3%(1.18 mm)和 34.6%(筛底);赵向辉[10]也发现,PSPS各筛层 NDF含量并不一致。因此,通过检测每个筛层的NDF含量计算的peNDF更为准确。1.18 mm以上筛层刺激动物咀嚼活动的能力是否相同,目前并无定量的数据。研究表明,在保证饲粮peNDF1.18含量一致情况下,改变1.18 mm以上筛层饲料颗粒分布对奶牛每公斤peNDF1.18采食量的咀嚼时间无影响[11-12]。而 Cao 等[13]对奶山羊的研究发现,尽管饲粮peNDF1.18含量一致,但1.18 mm以上分布不同刺激咀嚼活动有差异(3.98 vs.2.65 min/g peNDF1.18)。是否山羊和奶牛的咀嚼活动对饲粮颗粒分布的影响存在差异尚不清楚。Cao等[13]通过对奶山羊饲喂不同酸性洗涤纤维(ADL)含量的黑麦草发现,高ADL含量的黑麦草比低ADL含量的黑麦草更能促进咀嚼活动(4.05 vs.3.91 min/g peNDF1.18),这表明不同饲料NDF的韧性并不相同。
1.2 咀嚼指数体系
Norfor体系中的咀嚼指数是评价饲粮纤维物理有效性的另一种方式[8],该体系将每种饲料的纤维物理有效性均表示为咀嚼指数,计算为采食指数(EI)和反刍指数(RI)之和(表1)。其中采食指数由饲料的NDF含量和采食长度因子(size_E-factor,E)决定;而反刍指数取决于饲料 NDF含量、咀嚼长度因子(size_R-factor,R)和韧性因子(hardness factor,H)。其中韧性因子主要反映纤维抵抗动物咀嚼活动破坏其结构的能力。与PSPS体系相比,咀嚼指数体系特点是将动物的采食时间和反刍时间分别与饲粮相关物理结构建立回归关系,分别预测采食指数和咀嚼指数,并且在预测模型中考虑了韧性因子(表1)。
在咀嚼指数体系中,采食指数仅与粗饲料的长度有关,与韧性无关,默认精饲料的采食长度因子为0,反刍指数受饲粮精料和粗饲料的影响,但<2.00 mm的精料的长度因子为0,而对于颗粒长度>2.00 mm的精料和粗饲料,其韧性取决于不可降解NDF(iNDF)占饲粮NDF的比例。该体系的特点是针对每一种原料均有独立的咀嚼指数,根据该种原料占饲粮的比例预测出整个饲粮的咀嚼指数。同时,该体系为确定饲粮结构对饲料纤维降解的影响提出了瘤胃负荷指数(RLI)这一参数,计算公式为:
RLI=(RDS+糖)/(NDF+果胶)。
式中:RDS为瘤胃可降解淀粉。
回归结果表明,RLI与瘤胃内pH和纤维降解率呈显著的负相关,因此RLI也可作为潜在反映饲粮物理有效性的营养参数。
与PSPS体系相比,咀嚼指数体系在评价饲料的物理有效性时充分考虑了原料的韧性因子,但其默认不同饲料原料的咀嚼指数是有可加性的,且无法较为准确评价在混合后或在TMR制作过程中咀嚼指数的变化。这2种体系在纤维韧性的检测及有效纤维可加性的验证方面有待研究。
2 确定反刍动物物理有效纤维需要量的方法
剂量-响应方法是评定动物营养需要量的经典方法,其原理为饲粮中某一营养参数水平使生产性能或相关的生理参数达到预期范围或出现拐点,该水平的营养参数即为其营养需要量[14]。目前,关于反刍动物有效纤维需要量研究主要采用PSPS体系,在自变量的选择上包括 peNDF1.18、peNDF8.00和FNDF等参数。由于饲粮有效纤维主要通过影响动物的咀嚼活动改变瘤胃内环境、粗饲料消化及乳脂率等,这些指标通常作为响应参数[15]。同时,粗饲料的比例和颗粒长度影响瘤胃充盈程度和物理饱感,纤维的长度有效性会影响动物的干物质采食量(DMI),该变量也是评定饲粮有效纤维需要量的重要参数[1]。
饲粮peNDF仅能反映饲粮中和酸的能力,不能充分体现饲粮非纤维性碳水化合物(NFC)的产酸能力,有学者提出以二者相对变化值作为确定饲粮有效纤维需要量的依据,包括FNDF/RDS、peNDF/RDS、NDF/NFC、FNDF-RDS 和 peNDF-RDS等[16-19]。这些参数作为自变量用来预测瘤胃发酵和生产性能等参数可提高模型预测精度。但不同参数在反映饲粮缓冲能力、产酸潜力、饲粮结构以及动物咀嚼活动和发酵模式等方面存在差异(表2)。因此,在选择自变量前应首先确定拟优化的生理参数。
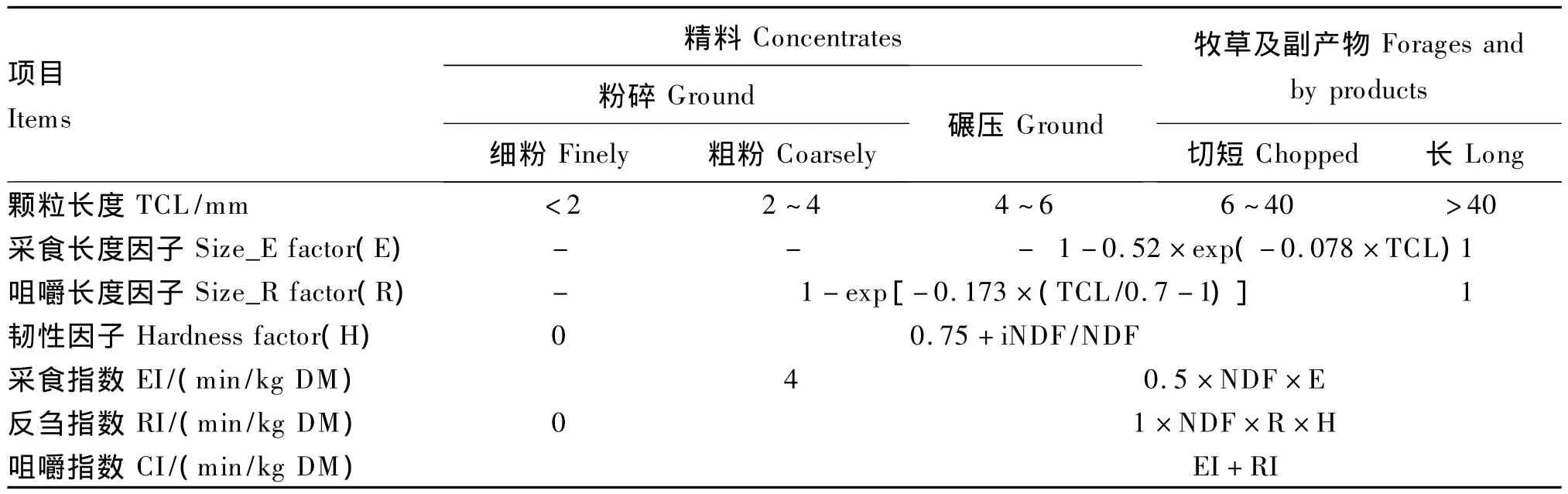
表1 咀嚼指数体系计算方法Table 1 Calculations used in the CI system[8]
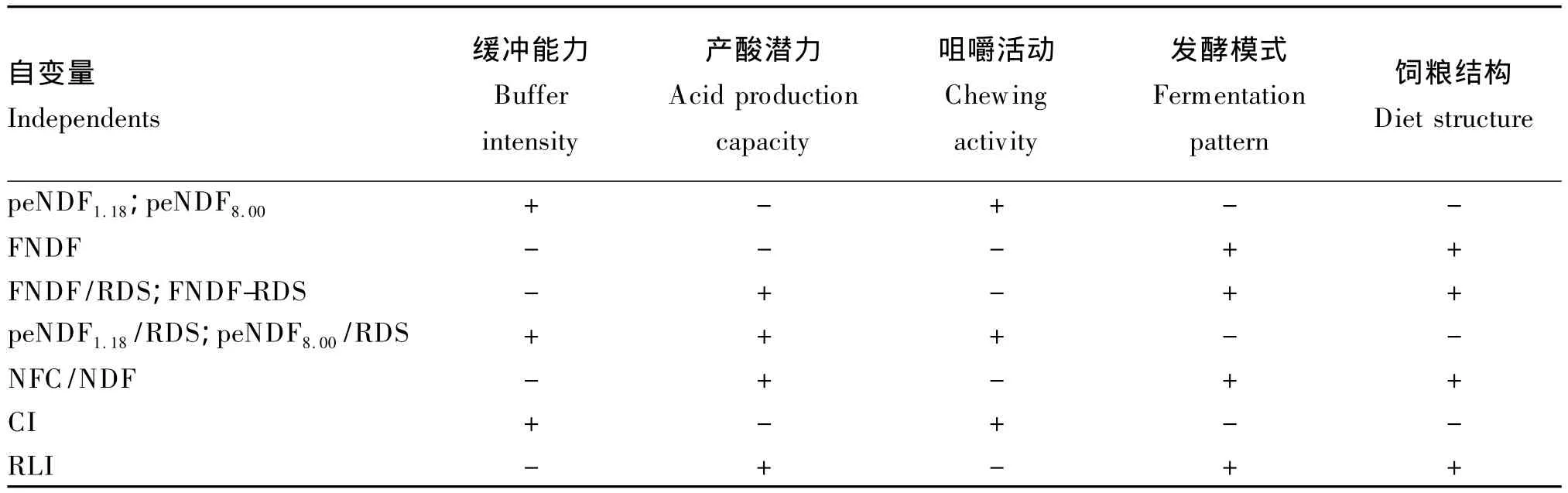
表2 不同有效纤维形式对生理参数评定的适用性Table 2 Applicability of different forms of effective fiber on physiological parameters
Meta分析是能够对同一类科学问题的多个独立研究进行方差合并及定量分析的统计方法,其原理为通过增加样本量提高参数统计功效[20-21]。近年来,Meta分析方法广泛用于评价营养素与动物生理指标的响应关系,估计饲粮最佳的营养水平[20-22]。饲粮有效纤维可通过多种途径影响瘤胃健康及生产性能,凭借单一响应参数给出其推荐量并不完善,简单回归方法不能考虑单个研究的权重。因此,基于瘤胃健康和高效发酵推荐的饲粮有效纤维推荐量需要满足以下几个原则:推荐量应考虑饲粮瘤胃可发酵碳水化合物的含量;优化目标应包括多种相关参数而不是单一参数,重点为DMI、瘤胃内pH及乳脂率;推荐的需要量应使目标参数达到某一理想范围而不是固定值;采用科学的方法(如Meta分析)汇总该领域大量的数据进行分析。
3 反刍动物有效纤维需要量
饲粮纤维是维持瘤胃功能正常、预防SARA及保证动物持续高产的关键营养因素[5]。但目前的饲养标准中对反刍动物有效纤维的需要并未给出明确的表述,相关研究主要集中于饲粮peNDF水平与瘤胃健康和生产性能的关系。其中保证瘤胃内pH、乳脂率及DMI正常是主要的优化目标。
关于反刍动物peNDF相关参数的推荐量较多(表 3),Zebeli等[17]采用 Meta 分析的方法,以peNDF1.18作为自变量,发现随饲粮peNDF1.18水平提高,奶牛瘤胃内pH线性提高,在 peNDF1.18为31.2%时出现拐点进入平台期,该范围(peNDF1.18>31.2%)能保证瘤胃内pH在6.16~6.27之间。李飞[19]利用相似的方法进行回归分析,发现饲粮peNDF1.18和peNDF8.00分别高于29.0%和13.9%可保证瘤胃平均pH高于6.20,可降低SARA的风险。咀嚼指数体系也建议饲粮咀嚼指数应高于32 min/kg DM,可保证瘤胃功能的正常。
饲料颗粒长度不仅影响动物的咀嚼活动和唾液分泌量,还会影响动物的DMI。研究表明,适当降低饲粮粗饲料粉碎长度可有效提高山羊[10](0.93 kg/d vs.1.09 kg/d)和奶牛[23]的 DMI(20.1 kg/d vs.23.4 kg/d),并可通过增加饲料的表面积提高饲料降解速率[24];但过度降低饲粮peNDF会增加SARA风险,降低纤维分解菌活力,而peNDF含量过高会降低动物DMI及饲料效率。李 飞[19]以 peNDF8.00为 自 变 量,发 现 饲 粮peNDF8.00高于18.8%时,泌乳奶牛 DMI迅速下降,在 18.8%时 DMI为 22.4 kg/d;Zebeli等[15]以奶牛DMI、瘤胃内pH及ADF降解率为优化目标,发现饲粮peNDF8.00在17.0% ~18.5%时,可保证相关指标在正常生理范围(DMI 22.3~22.7 kg/d;pH 6.15~6.22;ADF降解率>47.9%)。根据上述优化思路,李飞[15]分别以饲粮 peNDF1.18和peNDF8.00为自变量,DMI、瘤胃内 pH、乳脂率和饲料效率为优化目标,确定了泌乳奶牛饲粮适宜的peNDF范围(peNDF1.1827.59% ~35.62%;peNDF8.0012.83% ~18.80%)。
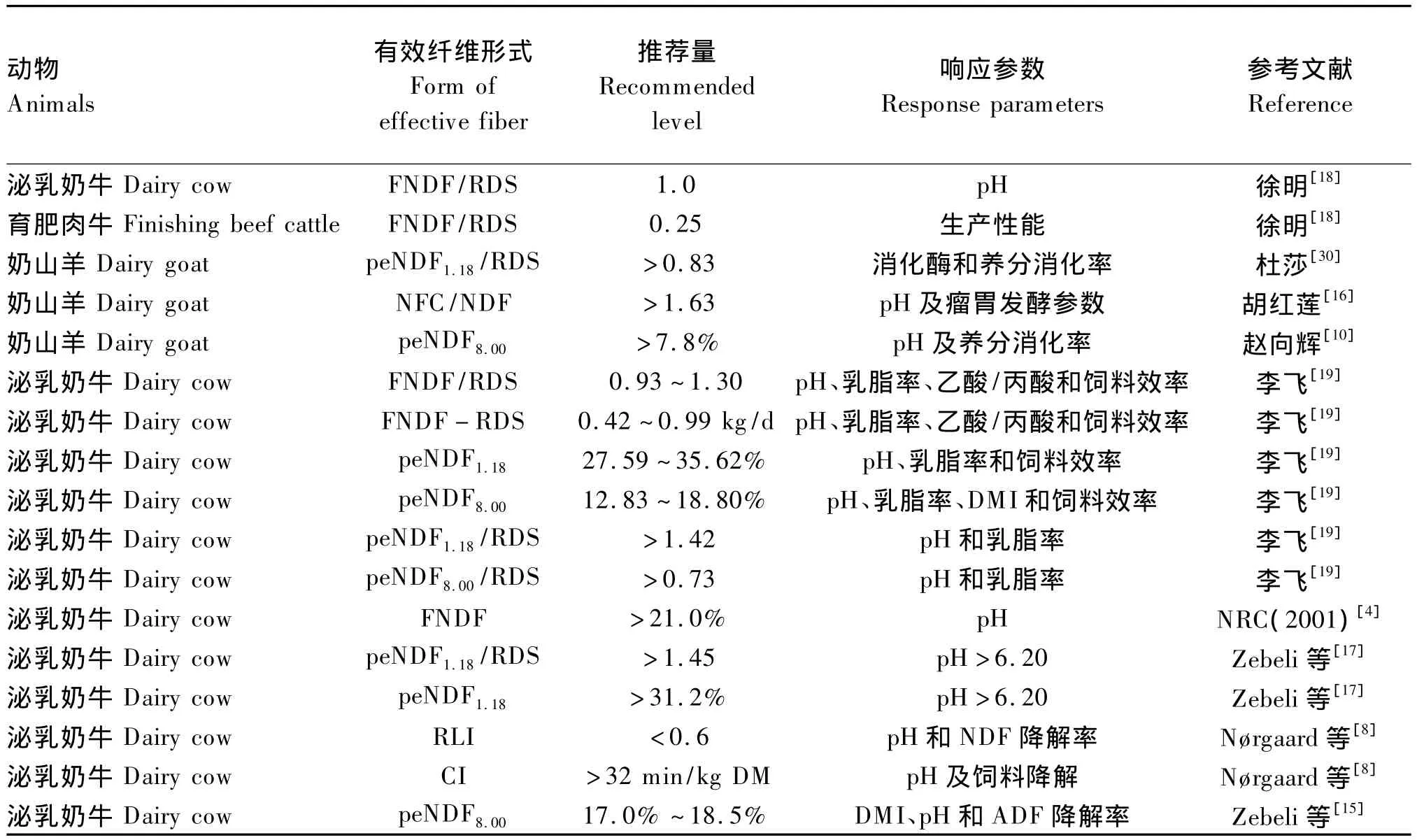
表3 反刍动物有效纤维推荐形式和推荐量Table 3 Recommended forms and levels of effective fiber for ruminants
瘤胃内pH受瘤胃唾液分泌量、挥发性脂肪酸(VFA)浓度、瘤胃上皮吸收VFA速度和瘤胃内容物外流速率等多因素的影响[25],其中谷物类饲料瘤胃降解能力是影响反刍动物有效纤维需要量的决定性因素[2]。与以玉米为主要能量饲料的饲粮相比,小麦替代玉米更易诱发奶牛 SARA[7,26],Tafaj等[27]饲喂奶牛玉米为基础的精料(60%)未造成瘤胃消化功能的紊乱,而Ametaj等[28]为奶牛提供大麦为基础的精料(40%)引起SARA,并提高了瘤胃异常代谢物含量。因此,确定饲粮有效纤维需要量应考虑饲粮的谷物降解能力。在PSPS体系中,饲粮peNDF取决于饲料的颗粒长度分布和NDF含量,不能反映饲粮的可降解NFC比例和产酸能力,为充分反映饲粮在瘤胃中的中和能力和 产 酸 能 力,徐 明[18]提 出 以 FNDF/RDS 或peNDF/RDS作为碳水化合物平衡指数(CBI),研究饲粮中和能力和产酸能力的相对变化调控反刍动物瘤胃发酵和饲料降解的机理。徐明[18]采用直线-折线模型分别研究奶牛和育肥牛瘤胃内pH与饲粮FNDF/RDS的回归关系,发现保证瘤胃健康和较高生产性能的FNDF/RDS分别为1.0和0.25(表3),该研究采用简单回归方法,数据变异较大,增加了预测模型的误差。Zebeli等[17]采用Meta分析的方法,以peNDF1.18/RDS作为自变量与瘤胃内pH进行回归,保证瘤胃内pH在6.20~6.27的peNDF1.18/RDS为1.45。
研究发现,不同有效纤维表述形式在预测相关参数准确性不同,如 peNDF8.00预测 DMI较peNDF1.18更准确[2,19];而 peNDF1.18较 peNDF8.00更能准确预测咀嚼活动[10]。因此,在确定饲粮有效纤维需要量应根据优化的目标参数,选择适宜的有效纤维表现形式进行计算。在此基础上,本课题组采用Meta分析方法,以保证瘤胃健康(pH和发酵模式)和动物高产(DMI、乳脂率和饲料效率)为目标,优化出泌乳奶牛饲粮适宜的 FNDF、peNDF和 RDS的供应模式(peNDF1.18/RDS、peNDF8.00/RDS、FNDF/RDS和 FNDF-RDS等,表4)[19],完善并丰富了CBI体系。该体系是以影响瘤胃内pH的营养要素为核心,以Meta分析方法为研究手段,保证瘤胃健康前提下使动物达到高产为优化目标,为完善反刍动物碳水化合物营养需要提供定量数据。由于反刍动物不同的生产阶段其生产目标并不一致,在应用CBI体系时应首先选择拟优化的相关响应参数的次序(如pH优先于乳脂率,乳脂率优先于饲料效率),然后确定与之相关程度最好的营养参数,逐步优化饲粮各项参数。
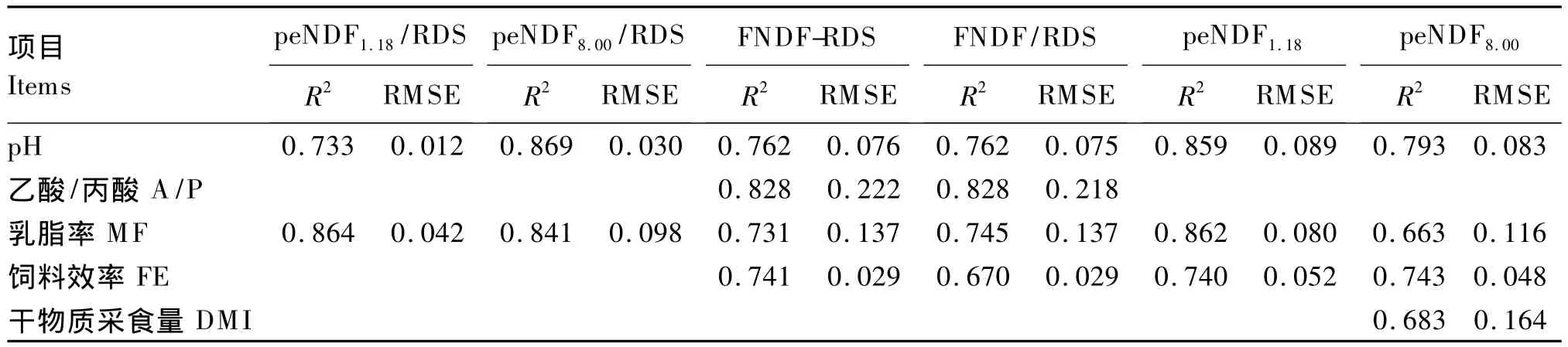
表4 碳水化合物平衡指数体系与响应参数的回归关系Table 4 Regression relationship of CBI system with response parameters[19]
不同种类反刍动物有效纤维需要是否一致尚不清楚,但有证据表明,相比于奶牛和肉牛,小反刍动物更适应高精料饲粮,可耐受较低的瘤胃内pH,这可能与小反刍动物在进化过程中独特的生态位和形态生理结构有关[29]。赵向辉[10]研究表明,饲粮peNDF8.00高于7.8%即可预防奶山羊发生 SARA,Li等[24]也发现,降低饲粮 peNDF1.18(24.3%vs.18.7%)和peNDF8.00(20.5%vs.8.4%)可降低奶山羊的瘤胃内pH,但并未降低瘤胃纤维分解菌的数量和乳脂率。杜莎[30]通过降低奶山羊饲粮粗饲料长度减小饲粮peNDF1.18/RDS,发现保证山羊较高消化酶活力和养分降解率饲粮适宜的peNDF1.18/RDS为0.83。同时,奶山羊乳脂合成过程对瘤胃脂肪氢化过程不如奶牛敏感,发现瘤胃内pH的下降对奶山羊的乳脂合成无不利影响[31]。上述试验建议山羊的peNDF推荐量均低于奶牛。因此,基于奶牛研究获得的有效纤维需要量可能并不适合小反刍动物。
4 小结
目前,反刍动物饲粮纤维的物理有效性评价尚不完善,由于评价体系、数据来源、动物种属、计算方法和优化目标不同,导致反刍动物有效纤维的明确需要量尚不确定。在确定营养素需要量的方式上应充分考虑不同评价体系的优缺点、兼顾动物健康和高产,采用科学的统计方法,多目标优化相应营养参数。目前,PSPS体系在奶牛上的应用最为广泛,相关研究较多,未来研究可以考虑以PSPS体系为基础,完善该体系对饲料韧性的评价方法,兼顾饲粮RDS含量,结合我国反刍动物生产实际,提出合理的评价体系并确定需要量范围。
[1]ALLEN M S.Relationship between fermentation acid production in the rumen and the requirement for physically effective fiber[J].Journal of Dairy Science,1997,80(7):1447-1462.
[2]ZEBELI Q,ASCHENBACH J R,TAFAJ M,et al.Invited review:role of physically effective fiber and estimation of dietary fiber adequacy in high-producing dairy cattle[J].Journal of Dairy Science,2012,95(3):1041-1056.
[3]PLAIZIER J C,KRAUSE D O,GOZHO G N,et al.Subacute ruminal acidosis in dairy cows:the physiological causes,incidence and consequences[J].The Veterinary Journal,2008,176(1):21-31.
[4]NRC.Nutrient requirements of dairy cattle[S].7th ed.Washington,D.C.:National Academy Press,2001:37.
[5]MERTENS D R.Creating a system for meeting the fiber requirements of dairy cows[J].Journal of Dairy Science,1997,80(7):1463-1481.
[6]CARDOZA R C.Threshold size and factors affecting fecal particle weight distribution[D].Master’s Thesis.Athens:University of Georgia,1985.
[7]POPPI D P,HENDRICKSEN R E,MINSON D J.The relative resistance to escape of leaf and stem particles from the rumen of cattle and sheep[J].The Journal of Agricultural Science,1985,105(1):9-14.
[8]NØRGAARD P,NADEAU E,RANDBY Å,et al.Chewing index system for predicting physical structure of the diet[M]//NorFor-the nordic feed evaluation system.Wageningen:Wageningen Academic Publishers,2011:127-132.
[9]BHANDARI S K,LI S,OMINSKI K H,et al.Effects of the chop lengths of alfalfa silage and oat silage on feed intake,milk production,feeding behavior,and rumen fermentation of dairy cows[J].Journal of Dairy Science,2008,91(5):1942-1958.
[10]赵向辉.日粮peNDF水平对山羊咀嚼活动、瘤胃发酵和养分消化率的影响[D].硕士学位论文.杨凌:西北农林科技大学,2009:13.
[11]YANG W Z,BEAUCHEMIN K A.Increasing physically effective fiber content of dairy cow diets through forage proportion versus forage chop length:chewing and ruminal pH[J].Journal of Dairy Science,2009,92(4):1603-1615.
[12]YANG W Z,BEAUCHEMIN K A.Physically effective fiber:method of determination and effects on chewing,ruminal acidosis,and digestion by dairy cows[J].Journal of Dairy Science,2006,89(7):2618-2633.
[13]CAO Y C,GAO Y,XU M,et al.Effect of ADL to aNDF ratio and ryegrass particle length on chewing,ruminal fermentation,and in situ degradability in goats[J].Animal Feed Science and Technology,2013,186(1/2):112-119.
[14]刘国华,蔡辉益.肉鸡生长性能及营养需要预测技术研究进展[M]//动物营养研究进展.北京:中国畜牧兽医学会动物营养学分会,2012:7.
[15]ZEBELI Q,MANSMANN D,AMETAJ B N,et al.A model to optimise the requirements of lactating dairy cows for physically effective neutral detergent fibre[J].Archives of Animal Nutrition,2010,64(4):265-278.
[16]胡红莲.奶山羊亚急性瘤胃酸中毒营养生理机制的研究[D].博士学位论文.呼和浩特:内蒙古农业大学,2008.
[17]ZEBELI Q,DIJKSTRA J,TAFAJ M,et al.Modeling the adequacy of dietary fiber in dairy cows based on the responses of ruminal pH and milk fat production to composition of the diet[J].Journal of Dairy Science,2008,91(5):2046-2066.
[18]徐明.反刍动物瘤胃健康和碳水化合物能量利用效率的营养调控[D].博士学位论文.杨凌:西北农林科技大学,2007:53.
[19]李飞.奶山羊亚急性瘤胃酸中毒模型构建与奶牛日粮CBI优化[D].博士学位论文.杨凌:西北农林科技大学,2014:49-67.
[20]SAUVANT D,SCHMIDELY P,DAUDIN J J,et al.Meta-analyses of experimental data in animal nutrition[J].Animal,2008,2(8):1203-1214.
[21]张国华.精准饲养模式下生长育肥猪赖氨酸动态需要量的评估[D].博士学位论文.杨凌:西北农林科技大学,2011:29.
[22]ST-PIERRE N R.Meta-analyses of experimental data in the animal sciences[J].Revista Brasileira de Zootecnia,2007,36:343-358.
[23]KONONOFF P J,HEINRICHS A J.The effect of reducing alfalfa haylage particle size on cows in early lactation[J].Journal of Dairy Science,2003,86(4):1445-1457.
[24]LI F,LI Z J,LI S X,et al.Effect of dietary physically effective fiber on ruminal fermentation and the fatty acid profile of milk in dairy goats[J].Journal of Dairy Science,2014,97(4):2281-2290.
[25]PENNER G B,STEELE M A,ASCHENBACH J R,et al.Ruminant nutrition symposium:molecular adaptation of ruminal epithelia to highly fermentable diets[J].Journal of Animal Science,2011,89(4):1108-1119.
[26]LI F,YANG X J,CAO Y C,et al.Effects of dietary effective fiber to rumen degradable starch ratios on the risk of sub-acute ruminal acidosis and rumen content fatty acids composition in dairy goat[J].Animal Feed Science and Technology,2014,189:54-62.
[27]TAFAJ M,ZEBELI Q,MAULBETSCH A,et al.Effects of fibre concentration of diets consisting of hay and slowly degradable concentrate on ruminal fermentation and digesta particle size in mid-lactation dairy cows[J].Archives of Animal Nutrition,2006,60(3):254-266.
[28]AMETAJ BN,ZEBELI Q,SALEEM F,et al.Metabolomics reveals unhealthy alterations in rumen metabolism with increased proportion of cereal grain in the diet of dairy cows[J].Metabolomics,2010,6(4):583-594.
[29]CLAUSS M,HUME I D,HUMMEL J.Evolutionary adaptations of ruminants and their potential relevance for modern production systems[J].Animal,2010,4(7):979-992.
[30]杜莎.日粮碳水化合物平衡指数对山羊消化道酶活性和养分瘤胃降解率的影响[D].硕士学位论文.杨凌:西北农林科技大学,2008:36.
[31]SHINGFIELD K J,BERNARD L,LEROUX C,et al.Role of trans fatty acids in the nutritional regulation of mammarylipogenesis in ruminants[J].Animal,2010,4(7):1140-1166.
