3.0 T MR扩散加权成像在不同分化程度胃癌中的诊断价值
2014-09-19李婷朱凯郭玉林何花张小彪田兆荣
李婷,朱凯,郭玉林*,何花,张小彪,田兆荣
MR扩散加权成像(DW-MRI)是近年来腹部MRI检查技术中的热门研究方向,它通过检测生物体内水分子的微观扩散运动状态的改变,间接反映组织的结构及细胞密度等信息,是目前用于观测活体内水分子运动的最好方法[1]。MR背景抑制全身扩散加权成像(WB-DWI)已广泛用于全身恶性肿瘤原发灶及转移灶的检测[2]。笔者通过分析不同分化程度胃癌DWI图像及ADC值的量化,探讨DWI在评价胃癌生物学行为中的意义。
1 材料与方法
1.1 患者资料
搜集2012年4月至2013年4月在宁夏医科大学总医院行MRI检查的胃癌患者33例,纳入标准:(1)均获得根治性手术;(2)术后病理结果证实为不同分化程度腺癌;(3)术前1周内行常规MRI及DWI检查。排除标准:(1)DWI图像存在伪影影响ADC值测量;(2)MRI检查前行相关抗肿瘤治疗。男20例,女13例,年龄37~76岁,中位年龄58岁,其中贲门癌8例,胃体癌5例,胃窦癌13例,癌肿同时累及贲门及胃体3例,同时累及胃窦及胃体4例。术后病理结果:低分化腺癌13例,中分化腺癌10例,高分化腺癌10例。
1.2 检查前准备
检查前12 h禁食禁水;检查前1 h饮1000 ml的温开水,以使肠道充盈;如无禁忌证,检查前5~10 min肌注盐酸山莨菪碱(654-2) 20 mg抑制胃肠蠕动;上床检查前口服纯水600~1000 ml使胃腔充盈。检查前训练患者屏气,寻找最佳的屏气耐受点,常规取仰卧位。
1.3 设备及扫描参数
采用GE Signa Excite 3.0 T MRI超导型扫描仪,梯度场强:40 mT/m,切换率:150 T/m/s,8通道Torsopa 腹部相控阵表面线圈结合ASSET技术,均使用诱导体衬垫。(1)DWI扫描参数:单次激发SE-EPI DWI(分2次屏气以完成全胃扫描):TR 1500 ms,TE 56 ms;带宽250 kHz,矩阵128×128,NEX 2,FOV 38 cm×38 cm~40 cm×40 cm,层厚6 mm,层间距1.5 mm,采用并行采集(ASSET)技术,加速因子为2,b值800 s/mm2。(2)常规MRI扫描参数: T2WI-FSE:TR 7500 ms,TE 102 ms。SSFSE:TR 2000 ms,TE 90 ms。横轴位同/反相位SPGR序列T1WI:TR 220 ms,TE 2.4/5.8 ms。多时相动态增强扫描(LAVA技术):TR 2.6 mm,TE 1.2 mm,对比剂Gd-DTPA,剂量0.2 mmol/kg,分3次屏气进行三期扫描(动脉期3个时相,门脉期2个时相,延时期1个时相)。
1.4 图像后处理
将所有数据传输至GE ADW4.3工作站,由1名高年资MRI诊断医师在未知病理结果的情况下,采用Functool 4.5.1软件包对DWI图像进行后处理。(1)判断DWI图像质量:标准为图像无明显变形,无影响ADC值测量的显著伪影,病变与邻近正常胃壁之间存在可辨别的信号差异。(2)感兴趣区(ROI)的选择:采用局部测量法[3],在DWI图像上病灶最大范围的层面内,以圆形小ROI包括扩散受限明显的均匀高亮肿瘤区。(3)正常胃壁ADC测量:选取距离癌肿较远的正常胃壁,以椭圆形划入ROI范围内,要求尽量不要超出正常胃壁范围进行ADC测量。采用Functool软件进行ADC值测量,要求同一图像由同1名医生测量3次以上取平均值。
1.5 统计学分析
采用SPSS 11.5统计软件,所有数据均以均数±标准差表示,胃癌ADC值与正常胃壁ADC值之间的差异比较采用两个独立样本t检验,首先进行两样本总体方差齐性检验(levene检验),若方差齐采用t检验,若方差不齐则采用t’检验,以P<0.05为差异具有统计学意义。低、中、高三组不同分化程度胃癌ADC值之间的差异采用单因素方差分析法比较,进行方差齐性检验,若方差齐则采用多重比较的最小显著法LSD-t法,若方差不齐则采用Tamhane’s T2法进行t检验配对比较,以P<0.05为差异具有统计学意义。
2 结果
所获得的DWI图像均较满意,无明显伪影,可进行ADC值的测量。33例胃癌患者癌组织在DWI上均呈高信号,其中23例表现为明显高信号,10例表现为不均匀高信号,所有癌肿在T2WI上呈高或稍高信号,在T1WI上呈低或等信号,LAVA动态增强扫描时癌肿均有强化,其中12例癌肿呈分层强化,21例癌肿呈不规则强化,延时期强化均有消退。正常胃壁ADC值为(3.026±0.191)×10-3mm2/s,胃癌组胃壁ADC值为(1.113±0.183)×10-3mm2/s,进行方差齐性检验P=0.580>0.05,方差齐,独立样本t检验显示t值为-41.338,P=0.000<0.05,可认为两组之间有差异(图1~3,表1),低分化腺癌ADC值为(0.0968±0.626)×10-3mm2/s,中分化腺癌ADC值为(1.041±0.0570)×10-3mm2/s,高分化腺癌ADC值为(1.372±0.0506)×10-3mm2/s,进行方差齐性检验,P=0.882>0.05,方差齐,单因素方差分析结果F=150.392,P=0.000<0.01,三组不同分化程度胃癌ADC值不同,多重比较最小显著法LSD-t检验结果:三组中每两两组间均有显著性差别(P<0.01,表2)。
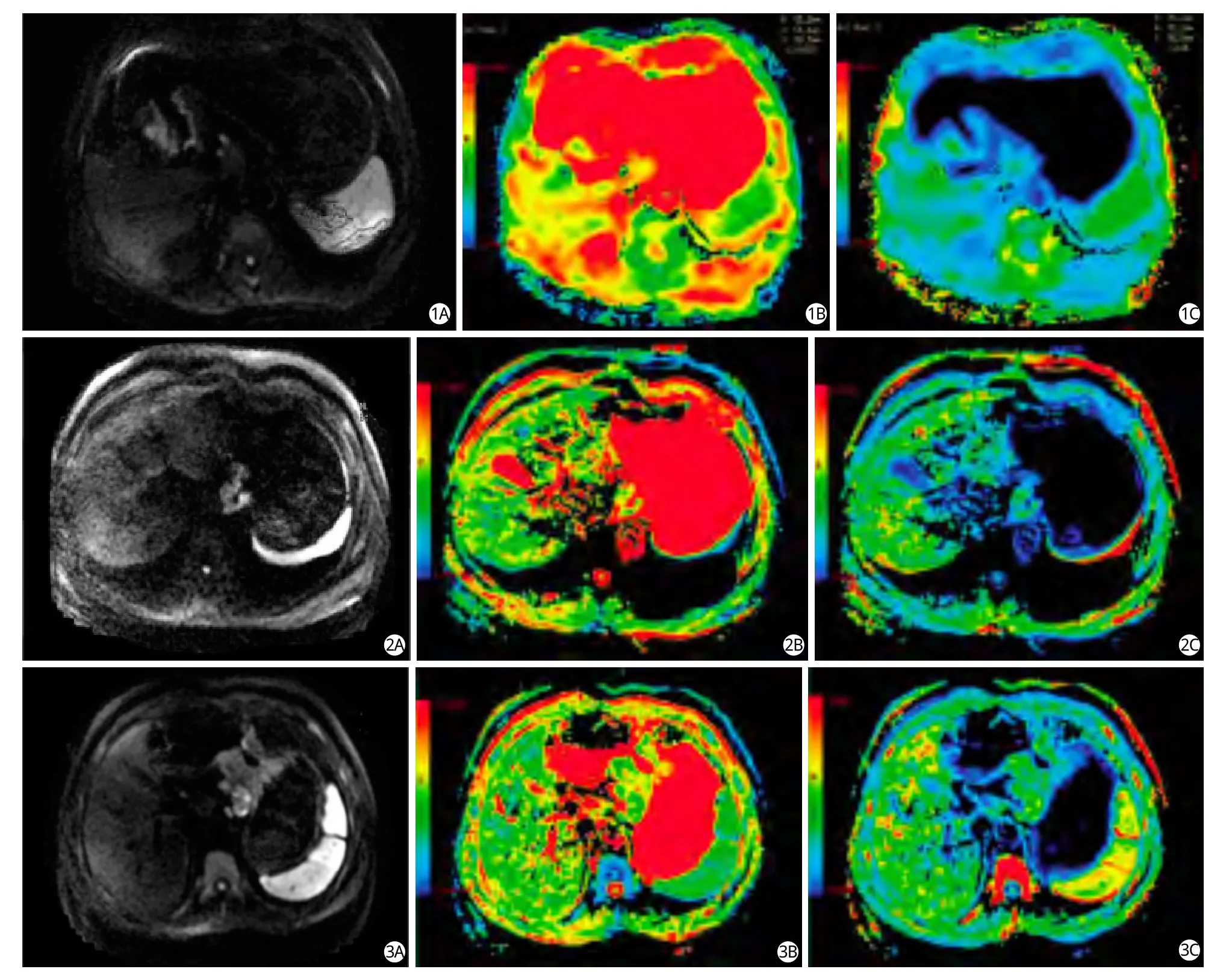
图1 胃窦高分化腺癌。A为DWI图,胃窦部胃壁明显不均匀性增厚,呈高信号,浆膜面毛糙;B为e-ADC图,胃窦处胃壁呈高信号,与正常胃壁分界清晰;C为ADC图,胃窦部胃壁扩散受限呈低信号,ADC值为1.386×10-3 mm2/s 图2 贲门低分化腺癌。A为DWI,贲门处胃壁不均匀性增厚,并呈明显的高信号表明扩散受限;B为e-ADC图,贲门处胃壁呈高信号,与正常胃壁有鲜明的界限;C为ADC图,贲门处癌肿区的胃壁扩散受限呈低信号,ADC值为0.934×10-3 mm2/s 图3 胃体中分化腺癌。A为DWI图,显示胃体前后壁明显不均匀性增厚,并突向腔内,肿瘤侵出浆膜面,周围脂肪间隙欠清,胃体小弯侧可见肿大淋巴结。DWI表现为胃体部胃壁扩散受限,小弯侧淋巴结呈不均匀性高信号,局部信号高于癌肿区的胃壁;B为e-ADC图,胃体前后壁呈明显高信号,与DWI图有很好的一致性;C为ADC图,胃体部癌肿区胃壁扩散受限呈低信号,ADC值为1.103×10-3 mm2/sFig.1 The highly differentiated carcinoma of the gastric cardia.A was a DWI map, the gastric cardia wall irregularly incrassated, presented a high signal obviously, indicated the diffusion limited.B was a e-ADC map, the gastric cardia wall also was a high signal, there was a clear boundary with the nomal gastric wall.C was a ADC map, becaused the rescricted diffusion,the gastric cardia wall presented a low signal, the ADC value was 1.386×10-3 mm2/s.Fig.2 The highly differentiated gastric antrum cancer.A was a DWI map, the gastric antrum wall irregularly incrassated obviously, presented a high signal,the chorion was coarsed.B was a e-ADC map, the gastric antrum wall also was a high signal, there was a clear boundary with the nomal gastric wall.C was a ADC map,becaused the rescricted diffusion, the gastric antrum wall presented a low signal, the ADC value was 0.934×10-3 mm2/s. Fig.3 The moderately differentiated carcinoma of the gastric body.A was a DWI map, the gastric body wall irregularly incrassated obviorsly, and into the gastric cavity, the tumor invasion the serosal surface, the surrounding fat clearance was unclear, there were lymph nodes in the lesser curvature of the gastric body, DWI presented diffusion limited, the lymph nodes were irregularly high signal, which were higher than the gastric wall of the tumor.B was a e-ADC map,the gastric body wall was the obviously hihy signal, there was the good consistency with the DWI map.C was a ADC map, becaused the rescricted diffusion, the tumor of the gastric body wall presented a low signal, the ADC value was 1.103×10-3 mm2/s.
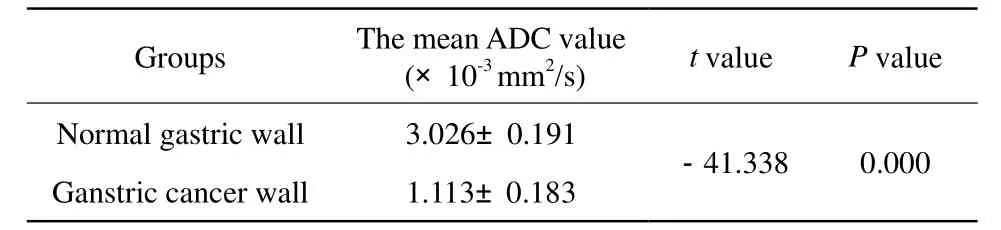
表1 正常胃壁与胃癌胃壁ADC值比较Tab.1 The compare of the ADC value in the normal gastric wall and the gastric cancer

表2 不同程度分化胃腺癌ADC值比较Tab.2 The compare of the ADC value in the different degrees differentiation of gastric adenocarcionma
3 讨论
DWI主要是依赖水分子的布朗运动,反应了组织中成分对水分子布朗运动的限制程度,是目前惟一能够在活体内探测水分子运动的影像学技术[4]。其可以较早的反应正常组织内组成信息、细胞密度以及病理状态下组织成分与水分子交换的功能状态,随着肿瘤组织的生长肿瘤细胞体积及核浆比例增大,其组织内部水分子的自由扩散运动明显受限,DWI上表现为高信号,测量其扩散系数(diffusion coefficient,DC)值可对其进行量化分析,但DC值在活体中易受到液体流动、细胞渗透性、温度、毛细血管灌注以及细胞膜通透性方向等的影响,因此,实际工作中常以ADC值来代替真正的扩散系数DC值[5]。扩散系数b值越小,ADC值稳定性越差;b值越大,ADC值越接近真实扩散值,但图像磁敏感伪影重,根据许传军等[6]报道本研究采用b值为800 mm2/s取得了较满意图像。
胃是蠕动的空腔脏器,MRI检查时极易受到胃肠蠕动、呼吸及大动脉搏动的影响而产生伪影,故对患者检查前保持空腹、肌注654-2、口服胃肠道对比剂以排空胃内潴留物,抑制胃肠蠕动,扩张胃腔从而减少运动伪影提高图像质量。本研究采用高场强3.0 T MRI提高了DWI信号强度,同时DWI序列采用SE-EPI结合ASSET技术,减少了图像的变形及伪影的发生,提高了对比度,降低灌注及T2投射效应的影响[7],提高了图像质量。
本研究所选取的33例不同分化程度胃癌中,DWI均呈高信号,T1WI呈低或等低信号,T2WI呈高或稍高信号,LAVA动态增强扫描时癌肿均有强化,其中12例癌肿呈分层强化,21例癌肿呈不规则强化,延时期强化均有消退。胃癌在不同序列上表现为不同信号可能与其病理组织成分有关[8],含纤维结缔组织较多者可能在T1WI、T2WI均为低信号,含黏液成分较多及肿瘤内部局部坏死则T2WI呈高信号,分层强化可能与肿瘤内部微血管丰富且规则有关,而不规则强化则为癌灶内微血管分布不规律结构紊乱所致。
通过测量显示正常胃壁ADC值为(3.026±0.191)×10-3mm2/s,胃癌组胃壁ADC值为(1.113±0.183)×10-3mm2/s,经统计学分析发现两者之间差异有统计学意义,胃癌组ADC值低于正常胃壁ADC值,分析原因可能与胃癌组织中肿瘤细胞生长密集,细胞异型性大,核浆比例高,细胞外水分子扩散受限有关,故DWI信号增高,ADC值降低[9]。
胃腺癌根据癌细胞的分化程度不同可分为4级:1级,高分化腺癌,属低度恶性;2级,中分化腺癌,属于中度恶性; 3级,低分化腺癌,属于高度恶性;4级,指未分化癌,癌细胞分化程度极差。本组未搜集到未分化癌,仅对低、中、高三组分化程度的腺癌进行研究分析,发现低分化腺癌ADC值为(0.968±0.0626)×10-3mm2/s处于三组中最低,分析原因低分化腺癌分化程度差,肿瘤细胞生长密集,核浆比值增高,癌细胞密度大,水分子自由扩散的空间变小,细胞间隙游离水分子也相对较少,水分子扩散能力明显受限[9],故DWI呈高信号,ADC值最低;高分化腺癌ADC值为(1.372±0.0506)×10-3mm2/s处于三组中最高,原因可能是高分化腺癌癌细胞相对分化程度较高,癌细胞密度相对较小,水分子自由扩散的空间较大,细胞外间隙也较大,水分子扩散受限程度相对较小,ADC值较高。中分化腺癌ADC值为(1.041±0.0570)×10-3mm2/s处于低、高分化腺癌两者之间,因为中分化腺癌分化程度高于低分化腺癌而低于高分化腺癌,ADC值也处于两者之间。
目前DWI及ADC已广泛的用于中枢神经系统肿瘤及前列腺肿瘤的诊断中并有助于恶性肿瘤的分级[10-11],然而对于胃癌的研究尚较少,本研究通过对正常胃壁和低、中、高三种不同分化程度胃癌ADC值的测量研究,认为ADC值有助于区分正常胃组织及不同分化程度的胃癌,评价其生物学行为,在判定胃癌恶性程度时具有重要价值。
[References]
[1]Qi LP, Zhang XP, Tang L, et al.Using diffusion-weighted MR imaging for tumor detection in the collapsed lung: a preliminary study.Eur Radiol, 2009, 19(2): 333-341.
[2]Gong JY, Zhou ZY, Deng YH, et al.The application value of whole body diffusion-weighted imaging in tumor lesions.Chin J Magn Reson Imaging, 2013, 4(6): 420-425.龚佳英, 周智洋, 邓艳红, 等.MR全身扩散加权成像技术在肿瘤病变中的应用价值.磁共振成像, 2013, 4(6): 420-425.
[3]Tang L, Sun YS, Cao K, et al.A comparison study of apparent diffusion coefficient measurement methods in patients with gastric cancer.Chin J Oncoradiol, 2010, 16(8):12-16.唐磊, 孙应实, 曹崑, 等.胃癌磁共振表观扩散系数测量方法的对照研究.中国肿瘤影像学, 2010, 16(8): 12-16.
[4]Xu YQ, Xu QY, Sun XH, et al.The value of MR whole-bady duffusion weighted imaging with background suppression (WB-DWIBS)in detecting the gastric carcinoma and in staging of lymph node metastasis.J Clin Radiol, 2012, 31(13): 1741-1745.徐艳琦, 徐芹艳, 孙西河, 等.全身磁共振背景抑制扩散成像对胃癌原发病灶筛查及N分期的价值.临床放射学杂志, 2012, 31(13):1741-1745.
[5]Cao ZH, Hao CS, Wang XR, et al.The function of the MRI DWI in dignositc of the gastric carcinoma.J Guang Dong Medical College,2009, 27(5): 527-529.曹智辉, 郝长胜, 王秀荣, 等.MR DWI在胃癌诊断中的作用.广东医学院学报, 2009, 27(5): 527-529.
[6]Xu CJ, Liu LX, Li XB, et al.The optimal b value in DWI of stomach neoplasm: a preliminary study.Chin Clin Med Imaging, 2010, 21(9):625-628.许传军, 刘林祥, 李晓波, 等.胃肿瘤MR扩散加权成像中扩散敏感因子选择的初步研究.中国临床医学影像杂志, 2010, 21(9):625-628.
[7]Tang L, Zhang XP, Sun YS, et al.Diffusion-weighted MR imaging of gastric cancer: study of parallel imaging combined with separate breath-holds and multi-NEX technique.Chin J Med Imaging Technol,2005, 21(12): 1830-1834.唐磊, 张晓鹏, 孙应实, 等.胃癌磁共振扩散加权成像:并行采集联合分次屏气多信号平均技术的临床研究.中国医学影像技术,2005, 21(12): 1830-1834.
[8]Ao P, Huang J, Zhang HJ, et al.MRI image analysis of advanced gastric cancer.Chin J Bases Clin General Surg, 2012, 19(1): 109-112.敖平, 黄娟, 张洪静, 等.进展期胃癌MRI影像分析.中国普外基础与临床杂志, 2012, 19(1): 109-112.
[9]Herneth AM, Guccione S, Bednarski M.Apparent diffusion coeffi cient:a quantitative parameter for in vivo tumor characterization.Eur J Radiol, 2003, 45(3): 208-213.
[10]Liu Y, Zeng FY, Wang CX, et al.Correlation of microarchitecture and apparent diffusion coeffi cient value in astrocytoma.Chin J Magn Reson Imaging, 2011, 2(1): 47-49.刘影, 曾飞燕, 王昌新, 等.星形细胞肿瘤内部微结构与ADC值相关性研究.磁共振成像, 2011, 2(1): 47-49.
[11]Liang YT, Jin EH, Zhang Y, et al.Diffusion-weighted imaging in the detection and differentiation of prostate cancer.Chin J Magn Reson Imaging, 2010, 1(4): 272-276.梁宇霆, 靳二虎, 张艺, 等.磁共振扩散加权成像在前列腺癌检出和鉴别诊断中的价值.磁共振成像, 2010, 1(4): 272-276.
