响应面法优化马来酸曲美布汀缓释片处方工艺
2014-09-19徐璐王永禄韩杰王栋叶雯李学明
徐璐,王永禄,2Δ,韩杰,王栋,叶雯,李学明
(1.南京工业大学 药学院,江苏 南京 211816;2.东南大学 医学院,江苏 南京 210009)
响应面法优化马来酸曲美布汀缓释片处方工艺
徐璐1,王永禄1,2Δ,韩杰1,王栋1,叶雯1,李学明1
(1.南京工业大学 药学院,江苏 南京 211816;2.东南大学 医学院,江苏 南京 210009)
目的 利用响应面分析法优化马来酸曲美布汀缓释片处方工艺。方法 通过单因素考察确定对释放度影响较大的3个因素:HPMC K4M和HPMC K100-LV的比例、酒石酸的用量、粘合剂PVP-K30的浓度,以释放度综合评分作为响应值,利用Box-Benhnken中心组合实验设计原理,采用3因素3水平的响应面分析法,确定各处方的用量。结果 筛选得到优化的处方及工艺为:骨架材料HPMC K4M和HPMC K100-LV的比例为6∶10、酒石酸的用量为22%、PVP-K30的浓度为15%,其体外释药行为较理想。结论 筛选所得的马来酸曲美布汀缓释片处方工艺稳定可行。
马来酸曲美布汀;缓释片;响应面法;体外释放度
马来酸曲美布汀是一种胃肠运动节律调节剂,它不同于抗胆碱类药物以及抗多巴胺药物,对消化道运动的兴奋和抑制具有双向调节作用[1-2]。作为临床上应用广泛的一种多离子通道调节剂,它能作用于细胞膜的K+、Na+、Ca2+等多个离子通道以此调节肠平滑肌的运动功能[3]。国外马来酸曲美布汀的主要剂型有片剂、干糖浆、软胶囊、缓释片、栓剂、溶液型注射剂、颗粒剂等[4]。2000年,国家食品药品监督管理局(SFDA)批准马来酸曲美布汀及其片剂上市。马来酸曲美布汀的半衰期较短,仅为2.7 h[5],普通片需频繁给药,血药浓度波动幅度较大[6],并且给患者带来诸多不便,因此将马来酸曲美布汀制成缓释制剂具有重要的意义,可有效保证其血药浓度和治疗效果相对稳定,并能减少患者服药次数,增加患者顺应性。本文以HPMC为亲水凝胶骨架材料,结合其他辅料制备了马来酸曲美布汀缓释片。
1 材料与方法
1.1 仪器和试剂 双光束紫外分光光度仪(TU-1901,北京普析通用仪器有限责任公司);电热鼓风干燥箱(101A-3B,上海试验仪器厂);高效液相色谱仪(LC-20AT,岛津国际贸易有限公司);电子天平(BP211D,德国赛多利斯股份公司);智能溶出试验仪(ZRS-8G,天津大学无线电厂);单冲压片机(DP3U,天津国药尤立科技有限公司);包衣机(JZ-TY-11-4,江苏泰兴制药机械二厂);智能片剂硬度仪(YD-20,天津大学无线电厂);超声仪(KQ-300DB,昆山市仪器有限公司)。
马来酸曲美布汀(广东环球制药,批号0014612);戊烷磺酸钠(日本东京化成工业株式会社);HPMC(K4M、K100-LV,上海卡乐康包衣技术有限公司);PVP-K30(上海德祥医药技术有限公司);微晶纤维素(FMC公司);硬脂酸镁(上海昌为医药辅料技术有限公司);盐酸(上海中试化工总公司);二氧化钛(上海江沪钛白化工制品有限公司);酒石酸、二氧化硅、磷酸二氢钾和醋酸铵由上海凌峰化学试剂有限公司提供;磷酸、醋酸、高氯酸、乙腈、蓖麻油、吐温80和丙二醇由国药集团化学试剂有限公司提供。
1.2 方法
1.2.1 释放度测定方法的建立
①检测波长的选择
取马来酸曲美布汀原料药适量(约10mg),置于10mL量瓶中,用纯水溶解并稀释至刻度,得到储备液;分别取储备液1 mL于50mL量瓶中,用水溶解并定容至刻度,制成适宜浓度的溶液(20μg/mL),在190~400 nm的波长范围内进行扫描。
参照主药的测定浓度,按处方比例配制辅料溶液,滤过,取续滤液在上述波长范围内扫描。
②标准曲线的绘制
精密称取马来酸曲美布汀对照品20mg,置100 mL容量瓶中,加纯水适量,超声10min,完全溶解后加水定容至刻度,摇匀,得200μg/mL的储备液。精密量取储备液为0.5、1.0、1.5、2.0、3.0、4.0mL,将其分别置于25mL容量瓶中,纯水定容,摇匀,配制成浓度分别为4、8、12、16、24、32 μg/mL的马来酸曲美布汀对照品溶液。以纯水为空白,按照紫外分光光度法(中国药典2010年版二部附录IV,A),在268 nm波长处分别测定吸光度A,将吸光度(A)与样品浓度(C)进行线性回归,绘制标准曲线。
③稳定性
精密称取马来酸曲美布汀对照品20 mg,置50 mL容量瓶中,加纯水适量,超声10min,完全溶解后加水定容至刻度,摇匀,得400μg/mL的储备液。分别精密量取储备液1.5、3.0、4.0 mL分别置50mL容量瓶中,加纯水定容,摇匀,配制成浓度分别为12、24、32μg/mL的马来酸曲美布汀供试品溶液。以相同介质纯水为空白,按照紫外分光光度法,在同一天内连续6次(每隔2 h),在268 nm波长处分别测定吸光度 A。记录,RSD值为0.41%,表明该方法重复性良好。
④回收率
精密称取马来酸曲美布汀对照品0.3 g,按照1片的处方量加入各辅料,于1000mL容量瓶中,加纯水适量,超声10min,纯水定容。0.45μm滤膜过滤,得300μg/mL储备液。分别量取1、2、3mL储备液于25mL容量瓶中,纯水定容配制浓度分别为12.0、24.0、36.0μg/mL的马来酸曲美布汀对照品溶液,在268nm处测定吸光度A,用标准曲线方程求马来酸曲美布汀含量。
⑤精密度
精密称取马来酸曲美布汀原料药20mg,置100 mL容量瓶中,加纯水适量,超声10min,完全溶解后加水定容至刻度,摇匀,再精密量取3.0mL 2次,分别置于25mL容量瓶中,加纯水定容,摇匀,配制成浓度为24μg/mL的马来酸曲美布汀对照品溶液2个。以纯水为空白,按照紫外分光光度法,在268 nm波长处分别测定吸光度A。称取马来酸曲美布汀对照品20mg,同样操作,测定吸光度。另一人用另外一台紫外做同样操作。进行测定2 d。
⑥释放介质的选择
精密称取马来酸曲美布汀对照品20 mg,置50 mL容量瓶中,加纯水适量,超声10min,完全溶解后加水定容至刻度,摇匀,得400μg/mL的储备液。分别精密量取储备液1.5、3.0、4.0 mL分别置50 mL容量瓶中,分别加纯水、盐酸溶液(pH 1.2)、pH 4.0醋酸-醋酸钠缓冲液和pH 6.8磷酸盐缓冲液定容,摇匀,配制成浓度分别为12、24、32μg/mL的马来酸曲美布汀供试品溶液。以相同介质为空白,按照紫外分光光度法,在同一天内连续6次(每隔2 h),在268 nm波长处分别测定吸光度A。记录,计算RSD值。
⑦释放度试验测定法
取本品,照释放度测定法(中国药典2010年版二部附录XD第一法)采用溶出度测定法第一法装置[7],以溶出介质纯水900mL为溶剂,转速为 50 r/min,依法操作,经 2、4、6、8、10、12 h,各取溶液10mL,用0.45μm的滤膜滤过,并及时补充相同温度的介质10mL。分别精密量取续滤液各1 mL置10mL量瓶中,加水稀释至刻度,摇匀,照分光光度法(中国药典2010年版二部附录ⅣA),在268 nm的波长处分别测定吸收度。
1.2.2 缓释片的制备
①片芯制备
按处方量称取马来酸曲美布汀、稀释剂、酒石酸以及羟丙甲纤维素,均过100目筛,混合均匀。加处方量PVP K30无水乙醇溶液作粘合剂,快速加入并混合均匀制软材,24目筛制粒,50~55℃干燥2 h左右,干颗粒24目筛整粒,加硬脂酸镁,混匀后压片,即得。
②包衣液的配制
称取处方量HPMC,用无水乙醇浸泡过夜。加入吐温80、丙二醇、蓖麻油混匀,加水使HPMC溶解,量取20%作为打光液备用。将二氧化钛混悬于剩余溶液中备用。
③包衣工艺
将片芯置于包衣锅中,转速16 r/min,喷入包衣液,吹干,交替进行。喷完后干燥即可,包衣增重2~4%。
1.2.3 处方筛选及制备工艺
①稀释剂的选择
水溶性的稀释剂例如乳糖,水不溶性的例如微晶纤维素、磷酸二钙,部分水溶性的例如部分预胶化淀粉等填充剂[8],它们通常被应用在亲水凝胶骨架片中,以提高片子的药剂性质,提高可压性,流动性以及机械强度,或者用来修饰药物释放曲线[9]。在骨架片中采用高剂量的水溶性填充剂,摄取水分更快更多,导致凝胶强度更弱,凝胶层溶蚀更高,使得药物释放的更快。水不溶性但有微弱膨胀的填充剂,保留在凝胶结构内,通常导致释放速率减慢[10]。对高、中水溶性的药物,释放速率的顺序如下:乳糖>微晶纤维素>部分预胶化淀粉。
在本实验中选用常用的乳糖和微晶纤维素进行考察,与原研公司的马来酸曲美布汀的释放曲线进行相似度对比。
②包衣对马来酸曲美布汀缓释片释放行为的影响
分别取未包衣和包衣后的同一处方片剂,用转篮法(50 r/min),以纯水为释放介质,进行释放度试验,比较包衣对马来酸曲美布汀缓释片释放行为的影响。
③响应面试验及设计
在上述单因素考察基础上,采用响应面分析法对处方作进一步筛选,以确定优化处方。确定影响马来酸曲美布汀缓释片制备的主要因素为HPMC K4M和HPMC K100-LV的比例、酒石酸的用量、粘合剂PVP-K30的浓度。上述3个因素分别选择3个水平,根据Box-Benhnken中心组合试验设计原理[11],按照制备工艺制备缓释片,依照释放度测定方法测定缓释片于2、4、8、12 h的释放度。
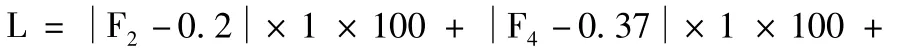
④模型的建立及显著性检验
将上述试验因素、水平、试验结果用design expert8.0统计软件进行处理[15],以综合评分指标对 K4M:K100-LV(A)、Tartrate(%)(B)、PVP-K30(%)(C)的各水平进行多元线性拟合,进行回归方程方差分析。
⑤响应面分析及最优水平的确定
根据回归方程,运用design expert 8.0统计软件作出响应面分析立体图[16]。
⑥质量研究
对最优处方制得的马来酸曲美布汀缓释片进行质量检查,观察所得缓释片外观,对其含量和有关物质进行测定。
根据日本针对仿制药研发时溶出曲线相似性的判定原则[17]:参比制剂在结束时间内平均溶出率达80%以上,f2因子应大于50;参比制剂在结束时间内平均溶出率达50%以上但未到80%,f2因子应大于55;参比制剂在结束时间内平均溶出率未达50%,f2因子应大于61。因此根据本试验的参比制剂的溶出行为,当f2因子在介质pH 1.2盐酸溶液时大于50,在介质纯水、pH 4.0醋酸盐缓冲液,f2因子大于55,在介质pH 6.8磷酸缓冲液时,f2因子大于61时,可判定仿制制剂与参比制剂在溶出介质的溶出行为具有相似性。
2 结果
2.1 释放度测定结果
2.1.1 检测波长的确定:将马来酸曲美布汀在190~400 nm波长范围内进行扫描,确定最大吸收波长为268 nm。且辅料在测定波长附近无吸收,不干扰主药测定。
2.1.2 标准曲线的绘制结果:将吸收度(A)与样品浓度(C)进行线性回归,绘制标准曲线(如图1)。
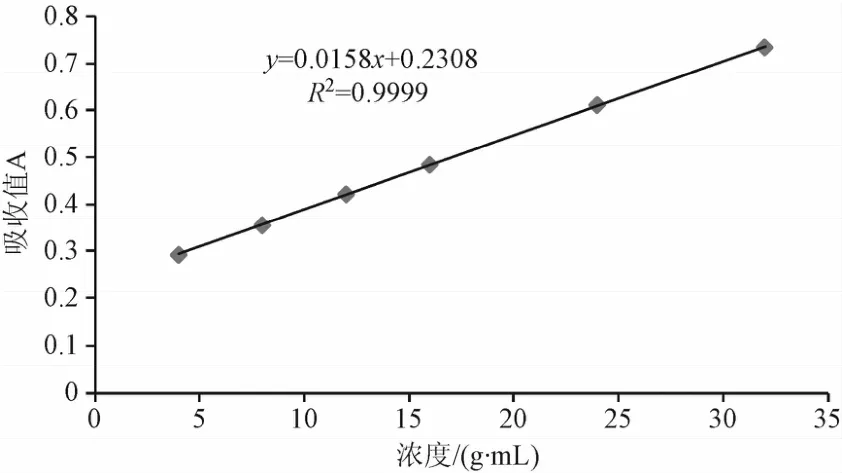
图1 马来酸曲美布汀标准曲线Fig.1 Standard curve of TMB
结果表明马来酸曲美布汀吸光度与浓度在3.94~31.91 g/mL范围内呈良好的线性关系。
2.1.3 回收率结果:回收率结果(见表1)表明此方法的回收率良好,方法准确。
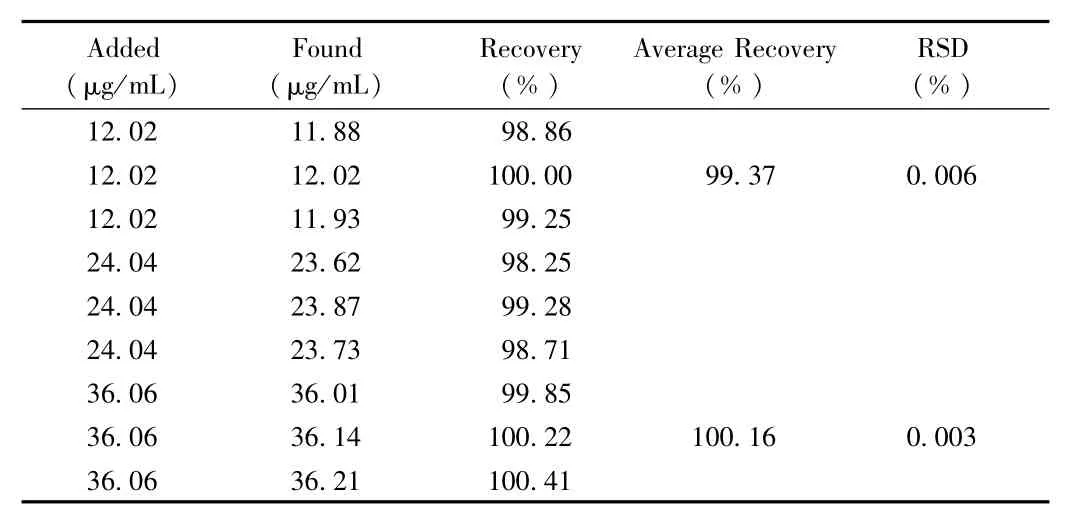
表1 马来酸曲美布汀在纯水中的回收率Tab.1 The recoveries of TMB in water
2.1.4 精密度结果:其RSD值分别为1.09%和0.60%,表明其中间精密度良好。
2.1.5 释放介质的选择结果:马来酸曲美布汀在四种不同溶剂中的稳定性结果(见表2)表明马来酸曲美布汀在纯水(A)、pH 1.2盐酸溶液(B)和pH4.0醋酸-醋酸钠缓冲液(C)中24 h内很稳定,并且稳定性A>B>C,而在pH 6.8磷酸盐缓冲液(D)中RSD值大于2%,相对不稳定,易降解。
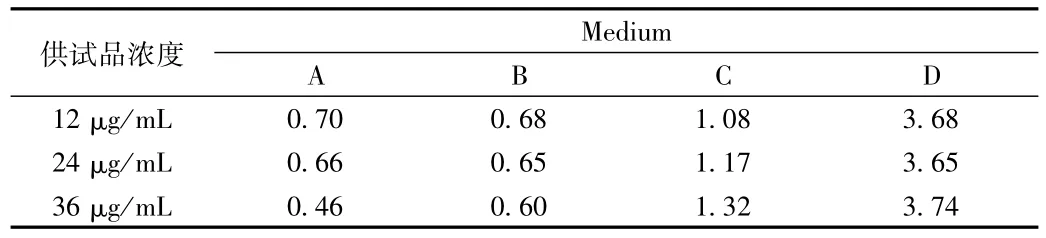
表2 马来酸曲美布汀在不同溶剂中的稳定性(RSD)Tab.2 The stability of TMB in in different solution(RSD)
马来酸曲美布汀在纯水中的溶解度为12.632mg/mL,满足释放度试验所要求的漏槽条件,且在24 h内稳定,在释放度试验期间最稳定,可以作为马来酸曲美布汀缓释片的释放度试验的释放介质,且马来酸曲美布汀在高温高湿以及光照条件下稳定。因此选择条件符合的介质纯水作为释放介质。
2.2 处方筛选及制备工艺结果
2.2.1 稀释剂的选择结果:乳糖处方与微晶纤维素处方与原研公司缓释片的释放结果见图2。用相似因子法计算乳糖与原研缓释片的f2=71.26,而微晶纤维素处方的f2=78.28。因此在考虑大生产中的成本节约上,选择微晶纤维素作为稀释剂。

图2 乳糖和微晶纤维素对马来酸曲美布汀缓释片释放度的影响Fig.2 The effect of lactose and MCC on the release rate of TMB sustained-release tablets
2.2.2 包衣对马来酸曲美布汀缓释片释放行为的影响结果:调节同一处方包衣前后释放度结果见图3。用相似因子法计算f2=79.58,大于50,2者差异无统计学意义。结果表明包衣对马来酸曲美布汀缓释片的释放度无影响。
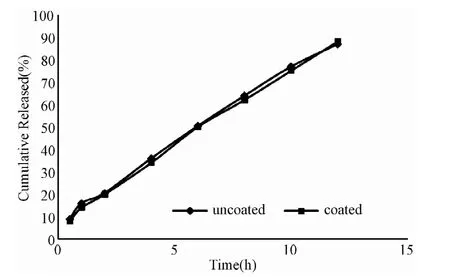
图3 包衣与未包衣对马来酸曲美布汀缓释片的影响Fig.3 The effect of coating on the release rate of TMB sustained-release tablets
2.2.3 响应面试验及设计结果:因素水平见表3,试验设计见表4。
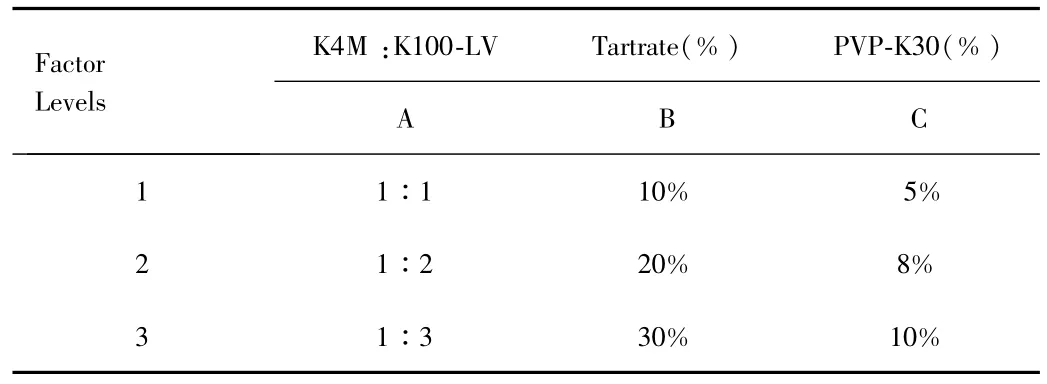
表3 因素水平表Tab.3 Factors and levels
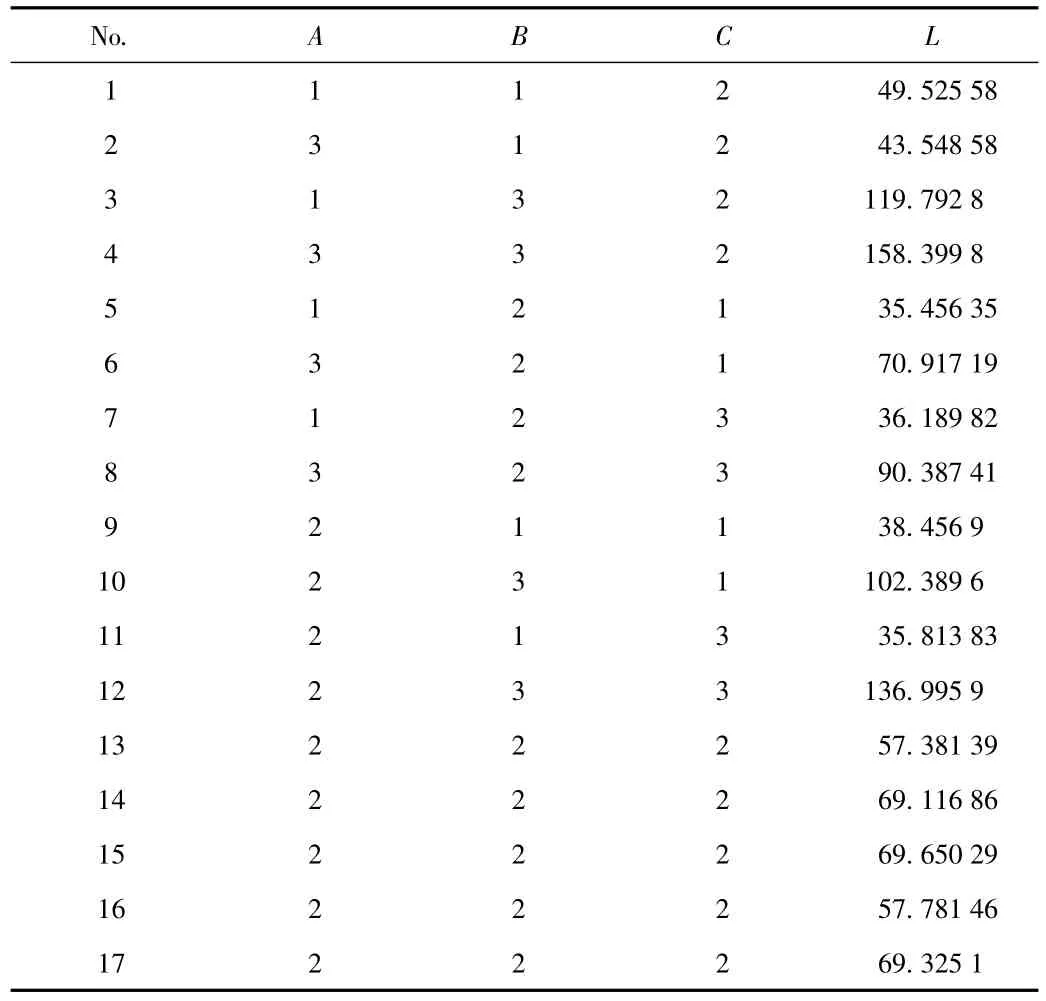
表4 中心组合试验设计及响应值表Tab.4 Central composite design and response value
2.2.4 模型的建立及显著性检验结果:将各水平进行多元线性拟合,回归方程方差分析见表5。结果表明,一次项、二次项及各交互项影响均达极显著水平。拟合方程为:L=58.94785-138.22222×A-686.60857×B+1974.01638×C-277.14013×A×B-416.64878×A×C+4027.33940×B×C+135.57182×A2+2434.28851×B2-15173.01167×C2该方程相关系数R2=0.9658,修正系数Adj R2=0.9218,表明该模型拟合良好,实测值与方程预测值有高度相关性,失拟项(P=0.0849)不显著,说明该模型选择合理,因此可以用回归方程对处方工艺进行预测和分析。

表6 回归方程方差分析Tab.6 Variance analysis of regression equation
2.2.5 响应面分析及最优水平的确定结果:由响应面分析立体图(见图4)结合响应面模型分析可知,马来酸曲美布汀缓释片的最佳处方工艺为:HPMC K4M和HPMC K100-LV的比例为61∶100、酒石酸的用量为22%、粘合剂PVP-K30的浓度为15%。考虑到实际操作的便利性,确定处方工艺为HPMC K4M和HPMC K100-LV的比例为6∶10、酒石酸的用量为22%、PVPK30的浓度为15%,由回归方程预测综合评分L为5.11。
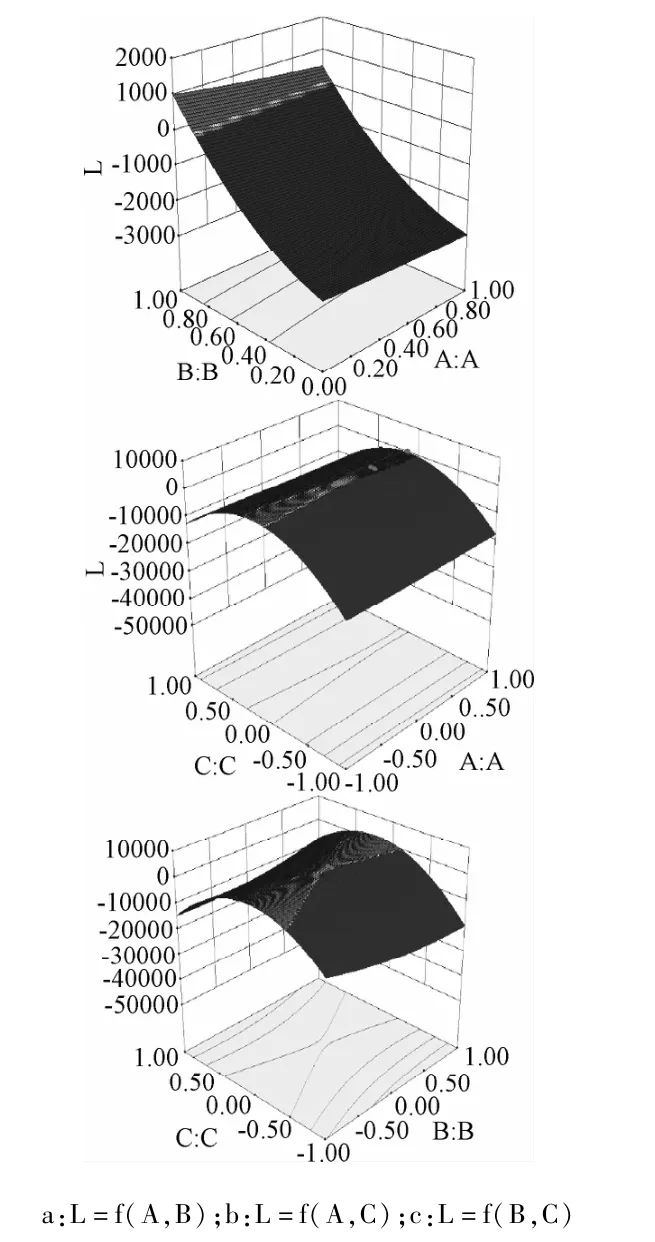
图4 HPMC K4M:HPMC K100-LV(A)、酒石酸的用量(B)、PVP-K30%(C)对释放度影响的响应面图Fig.4 the response surface plot of different factors on the release
2.2.6 质量研究结果:由最优处方制得的缓释片光洁美观,含量为97.15%,有关物质为0.45%。
自制制剂与参比制剂在介质pH 1.2盐酸溶液(A)、纯水(B)、pH 4.0醋酸盐缓冲液(C)、pH 6.8磷酸缓冲液(D)中,溶出曲线的相似因子f2分别为81.22、78.50、79.06、74.20,根据判定标准可知,自制制剂与参比制剂在上述介质中的溶出行为具有相似性。各介质与参比制剂累积释放度曲线比较见图5~8。
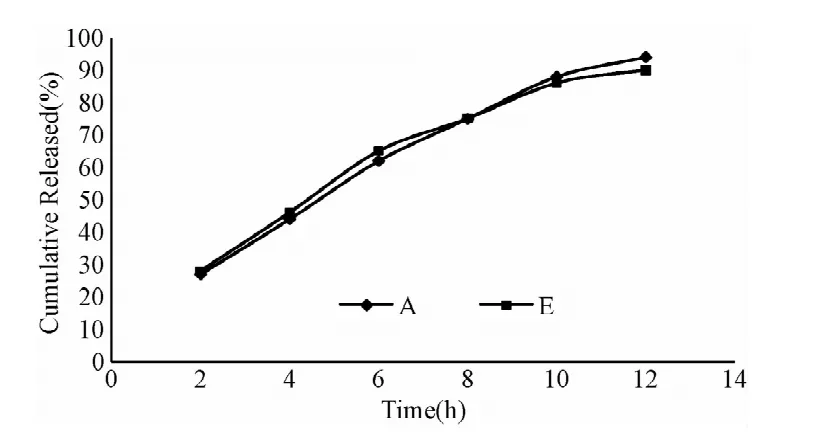
图5 自制片与原研片在pH1.2盐酸溶液中的累计释放度曲线Fig.5 The cumulative release of TMB pellets and Polybutine in pH 1.2 HCl

图6 自制片与原研片纯水中的累计释放度曲线Fig.6 The cumulative release of TMB pellets and Polybutine in water
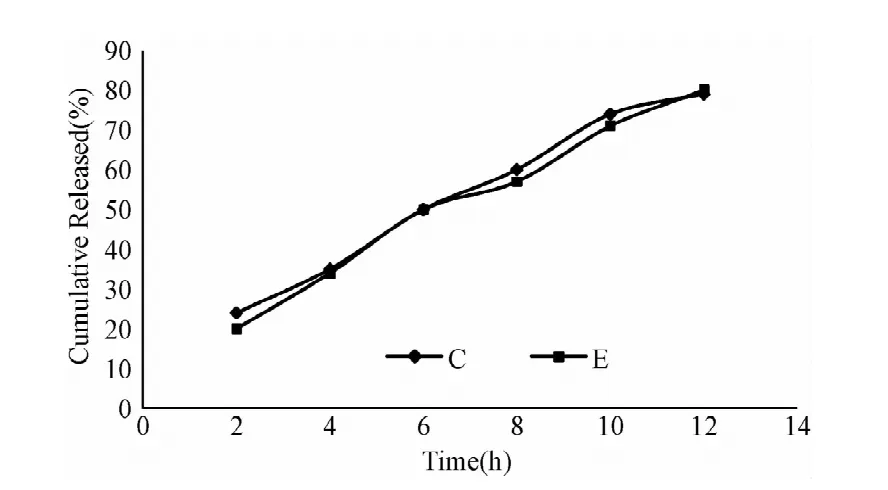
图7 自制片与原研片在pH4.0醋酸缓冲液中的累计释放度曲线Fig.7 The cumulative release of TMB pellets and Polybutine in pH 4.0
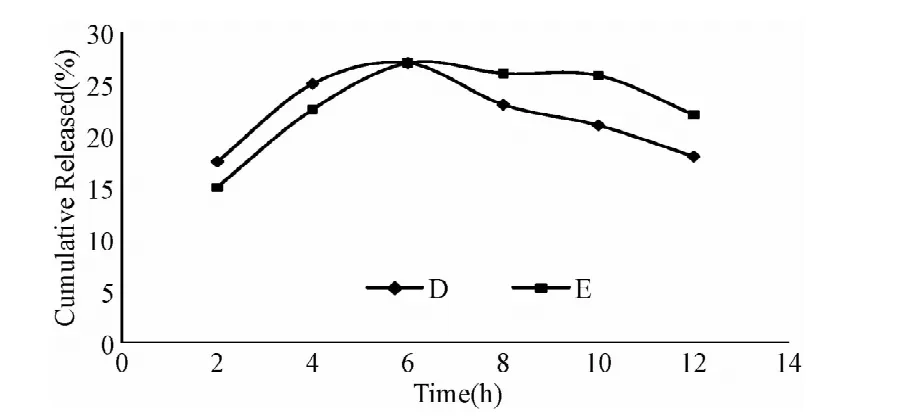
图8 自制片与原研片在pH6.8磷酸缓冲液中的累计释放度曲线Fig.8 The cumulative release of TMB pellets and Polybutine in pH 6.8
3 讨论
本文经处方单因素考察确定了马来酸曲美布汀缓释片的稀释剂为微晶纤维素,并采用响应面实验来筛选和优化处方,以缓释片的释放度为优化指标,筛选出合适的处方。通过对单因素确定的显著影响因素进行响应面实验及分析可知,HPMC K4M和HPMC K100-LV的比例、酒石酸的用量、粘合剂PVP-K30的浓度及各因素的交互作用对释放度综合评分影响显著,通过实验验证优化所得处方,释放度综合评分符合要求,说明该方法直观、精密、预测性良好。
马来酸曲美布汀及HPMC都稍有吸湿性,采用薄膜包衣的措施来提高缓释片的稳定性,包衣对马来酸曲美布汀缓释片的释放度无影响。
[1] Kamiya T,Nagao T,Andou T,et al.Effects of trimebutine maleate on gastric motility in patientswith gastric ulcer[J].JGastroenterol,1998,33(6):823-827.
[2] Simon EJ.opioid receptors and endogenous opioid peptides[J].Med Res Rev,1991(11):357-374.
[3] Tan W,Zhang H,Luo H,et al.Effects of trimebutinemaleate on colonic motility through Ca2+-activated K+channelsand L-type Ca2+channels[J].Archives of Pharmacal Research, 2011,34(6):979-985.
[4] Delaux M,Wingate D.Trimebutine:mechanism of action,effects on gastrointestinal functional and clinical results[J].J Int Res,1997,25:225-246.
[5] Lee H, Kim BJ.Trimebutine as a modulator of gastrointestinal motility[J].Archives of Pharmacal Research,2011,34(6):861-864.
[6] Saivin S,Lavit M,Michel F,et al.Pharmacokinetics and bioequivalance of two trimebutine formulation in healthy volunteers using desmethyl trimebutine levels.Arzneimittelforschung.2000,50(8):717-721.
[7] 国家药典委员会编.中华人民共和国药典(二部)[S[J].2010年版.北京:化学工业出版社,2010:附录XD.
[8] 肖秋生,蒋永培.羟丙甲基纤维素控释、缓释骨架片研究进展[J].西北药学杂志,2000,15(3):133.
[9] 沈艳,任丽莉,王丞,等.响应面法优化富马酸喹硫平缓释片处方[J].中国药房,2012(33):3108-3111.
[10]王玉鹏,赵丽华,胡容峰.缓释骨架材料在药物制剂中的应用[J].中国药房,2007,18(25):1987-1988.
[11]谢捷,李红娟,郑兴宗,等.响应面法优化厚朴酚及和厚朴酚的闪式提取工艺的研究[J].林产化学与工业,2010,30(4):20.
[12] Zhu H,Fu Y,Jiang R,etal.Optimization of Copper(II)Adsorption onto Novel Magnetic Calcium Alginate/Maghemite Hydrogel Beads Using Response Surface Methodology[J].Industrial&Engineering Chemistry Research,2014,53(10):4059-4066.
[13]王珣,孙佩男,奕琳,等.别嘌醇缓释片的制备及释药机理的初步探讨[J].沈阳药科大学学报,2007,24 (3):138.
[14]龙明立,贺丽平,曾建国.复方阿仑膦酸钠缓释片的制备及体外释放度考察[J].中国药房,2008,19 (34):2690.
[15] Lim S, Lee K T.Optimization of supercritical methanol reactive extraction by Response Surface Methodology and product characterization from Jatropha curcas L.seeds[J].Bioresource technology,2013,142:121-130.
[16] Bezerra MA, Santelli RE, Oliveira EP, et al.Response surface methodology(RSM)as a tool for optimization in analytical chemistry[J].Talanta,2008,76(5):965-977.
[17]谢沐风.溶出曲线相似性的评价方法[J].中国医药工业杂志,2009,40(4):308-310.
(编校:吴茜)
Optim izing the preparation of trimebutinemaleate sustained release tablet using response surfacemethodology
XU Lu1,WANG Yong-lu1,2Δ,HAN Jie1,WANG Dong1,YEWen,LIXue-ming1
(1.College of Pharmacy,Nanjing University of Technology,Nanjing 211816,China;2.School of Medicine,Southeast University,Nanjing 210009,China)
Objective In this article,Response Surface Analysis(RSA)was applied to optimize the formulation of trimebutine maleate sustained release tablet.Methods Single factor exploration was used to determine the three factors which have the greatest impact on the release rate.Composite score of the release behaviour was taken as the response value.Box-Benhnke design principles and 3 factors and 3 levels was used to the dosage of the ingredients.Results The optimized formulation and processwas as follows:HPMCwas selected as frameworkmaterial,and the ratio of HPMCK4M and HPMC K100-LV is 6:10,the dosage of the tartaric acid in the totalweightof the tabletwas13.5%,still15%for PVP-K30.The release behavior in vitro was ideal.Conclusion The optimized preparation process of trimebutine maleate sustained release tablet is stable,highly efficient and suitable for industrial production.
trimebutinemaleate;sustained-release tablets;response surfacemethodology;release in vitro
R94
A
1005-1678(2014)06-0163-06
国家自然科学基金资助项目(81170492);江苏省博士后科研资助计划(1301012A);江苏政府留学奖学金(2013).
徐璐,女,硕士,研究方向:药物制剂,E-mail:xulu89@126.com;王永禄,通信作者,男,博士,副教授 ,研究方向:纳米医学,E-mail:wl-761107@163.com。
