CD137L在非小细胞肺癌增殖、迁移、侵袭中的作用及机制
2014-09-19郑芳霞李学章郑卫霞程玉峰盛延兴高雯
郑芳霞,李学章,郑卫霞,程玉峰Δ,盛延兴,高雯
(1.山东大学齐鲁医院 放疗科,山东 济南 250012;2.山东省聊城市人民医院 放疗科,山东 聊城 252000;3.南京医科大学 临床医学系,江苏 南京 210029)
CD137L在非小细胞肺癌增殖、迁移、侵袭中的作用及机制
郑芳霞1,李学章2,郑卫霞2,程玉峰1Δ,盛延兴2,高雯3
(1.山东大学齐鲁医院 放疗科,山东 济南 250012;2.山东省聊城市人民医院 放疗科,山东 聊城 252000;3.南京医科大学 临床医学系,江苏 南京 210029)
目的 研究CD137L在非小细胞肺癌中的表达,及其对细胞增殖、迁移和侵袭的影响,探讨其可能的分子生物学机制。方法 通过体外构建CD137L高表达慢病毒载体[A549-TC-1(+)]及CD137L-RNA干涉慢病毒载体[A549-TC-1(-)]和空白载体(A549-control),分别转染肺癌A549细胞。采用Western blot检测3组细胞CD137L蛋白的表达;MTT法检测细胞增殖情况;Matrigel transwell小室侵袭实验研究肺癌细胞侵袭能力;ELISA方法检测细胞上清IL-6和IL-8的水平。结果 Western blot结果显示:与A549细胞相比,CD137L蛋白在A549-TC-1(+)细胞中表达明显增多,A549-TC-1(-)细胞中表达明显减少,差异有统计学意义(P<0.05),在转染A549-control中无明显变化,表明3种病毒载体可用于后续实验。MTT细胞增殖实验及Matrigel Transwell小室侵袭实验结果显示:与A549-control相比,A549-TC-1(+)细胞增殖、迁移及侵袭能力均明显增强,A549-TC-1(-)细胞增殖、迁移及侵袭能力均明显减弱,差异均有统计学意义(P<0.05)。ELISA检测结果显示:A549-TC-1(+)细胞中细胞因子 IL-6、IL-8的水平明显高于A549-TC-1(-)细胞组和正常A549细胞组。结论 CD137L对非小细胞癌细胞的增殖、侵袭具有正性调节功能,其作用机制可能与促进IL-6、IL-8的分泌进而增强肿瘤的生长、增殖和侵袭能力有关。
CD137L;非小细胞癌;增殖;迁移;侵袭
非小细胞肺癌(non-small-cell lung cancer,NSCLC)是肺癌的主要类型,未发生转移的肺癌患者其5年生存率达50%,而局部浸润或区域淋巴结转移的患者只有约20%,远处转移的患者其5年生存率仅为4%,可见侵袭和转移是造成非小细胞肺癌患者疗效差和死亡的主要原因[1-2]。CD137L及其受体CD137是一对重要的共刺激分子,在抗肿瘤免疫中起着重要的作用。主要表达于活化的T淋巴细胞和NK细胞,参与T细胞的活化,细胞因子的分泌以及调控单核细胞的增殖和分化等[3-4]。近年发现CD137L在多种肿瘤细胞株及人体肿瘤组织细胞有组成型表达,并对肿瘤细胞的生物学行为产生一定影响[5-6]。为进一步明确CD137L对非小细胞肺癌生物学行为影响的具体机制,本研究旨在通过体外构建CD137L高表达慢病毒载体及CD137L-RNA干涉慢病毒载体转染肺癌A549细胞,探讨CD137L对非小细胞肺癌侵袭转移的分子生物学机制,为临床治疗提供新思路。
1 材料与方法
1.1 主要试剂和仪器 人肺腺癌细胞系A549细胞源自中国肿瘤细胞库;CD137L高表达慢病毒、CD137L-siRNA慢病毒、空白载体慢病毒由上海生博生物医药科技有限公司构建。BCA蛋白定量试剂盒购自北京康为世纪生物科技有限公司。兔抗人CD137L抗体购自美国Santa Cruz公司;兔抗人β-actin抗体购自北京博奥森生物技术有限公司;丽春红S购自德国Serva公司;考马斯亮蓝购自美国Sigma公司;新生牛血清购自中国四季青公司;RPMI 1640购自美国 Gibco公司;IL-6、IL-8酶联吸附检测试剂盒,购自上海绿叶生物技术有限公司。玻片架购自北京华越生物科技有限公司;染色缸购自北京华越生物科技有限公司;恒温烤箱购自吴江远顺烘箱设备有限公司;孵育盒购自北京华越生物科技有限公司;倒置光学显微镜购自日本OLYMPUS公司。
1.2 方法
1.2.1 细胞培养:A549细胞用含10%新生血清及双抗(青霉素、链霉素各100 U/mL)的RPMI 1640培养液常规贴壁培养,置于5%CO2、37℃、湿度为95%培养箱内培养。选择第三代对数生长期的A549细胞,计数按2×103每孔接种于无菌24孔培养板中,继续培养12 h,用于后期实验。选取24孔板中1孔细胞计数,估算每孔中 A549细胞数量,根据细胞感染复数(multiplicity of infection,MOI)=50分别在含10%FBS及双抗的RPMI 1640培养液中添加制备的3种病毒,置于5%CO2、37℃培养12 h。用无菌PBS震荡清洗细胞3min×3次,换用常规培养液继续培养24 h。采用有限稀释法筛选转染细胞,将转染CD137L高表达病毒、CD137L-siRNA慢病毒及空白载体慢病毒的细胞分别命名为A549-CD137L(+)、A549-CD137L(-)、A549-control。
1.2.2 Western blot检测细胞CD137L蛋白表达:选取对数生长期的A549-CD137L(+),A549-CD137L(-),A549-control及对照组细胞,PBS洗涤3遍,细胞计数并离心,每1×107个细胞加入150μL RIPA Buffer,4℃裂解60 min,4℃离心20min,收集上清。利用BCA蛋白定量试剂盒对蛋白进行定量。用SDS凝胶电泳将蛋白转印到PVDF膜上。用5%脱脂奶粉封闭1 h;TBST反复洗膜3次,每次5 min。加入一抗(CD137L,1∶500;β-actin,1∶2 000,TBST稀释)浸透PVDF膜,4℃过夜,次日复温1 h;TBST洗膜3次,加入二抗(羊抗兔 IgG-HRP,1:5000,TBST稀释),室温孵育2 h,TBST洗膜3次;利用低背景化学发光检测试剂盒成像系统采集图像。以β-actin内参照条带作为参照,分析目的条带的代表的蛋白表达水平[7]。
1.2.3 MTT细胞增殖实验:取对数生长期的A549-CD137L(+),A549-CD137L(-),A549-control细胞,计数后各取1×107个细胞,按照4×103个细胞/孔转至无菌96孔板,每种细胞铺8孔,共铺8个96孔板,置入5%CO2、37℃培养箱培养。铺板后24 h取出一块板,吸出原培养液后加入含FBS及双抗的RPMI 1640培养液100μL及浓度为5 mg/m L的MTT溶液20μL。继续培养4 h,随后终止培养,吸出孔内培养液,每孔加入150μL DMSO,振荡10min,在酶联免疫检测仪上测定各孔光吸收值,波长492,记录结果。每24 h重复上述步骤1次,直至第8天。以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。实验重复3次。
1.2.4 Matrigel Transwell小室细胞侵袭实验 将Matrigel 40μL均匀铺在Transwell小室内,静置30min。取对数生长期的A549-CD137L(+),A549-CD137L(-),A549-control细胞各2×105个,加入150μL无血清含双抗的RPMI 1640培养液中,置入Transwell小室内。Transwell小室置于24孔板内,板内加入600μL含15%FBS的RPMI 1640培养液,并置于37℃恒温孵育箱培养。48 h后擦除小室内部Matrigel胶及胶上未迁出细胞,PBS液洗3min×3次,4%多聚甲醛固定0.5 h,常规HE染色。随机选取4个高倍视野(200×)计数细胞。实验重复3次。
1.2.5 IL-6、IL-8水平检测:将 A549-CD137L(+),A549-CD137L(-),A549-control3组细胞,在5%CO2、37℃培养箱培养2 d,收集细胞培养的上清液,固定到硝酸纤维素膜中;具体步骤按照ELISA酶联吸附检测试剂盒说明书操作检测IL-6、IL-8的水平。
1.3 统计学方法 采SPSS16.0统计软件进行数据分析,正态计量资料采用“±s”表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 Western blot检测细胞CD137L白表达 Western blot结果显示:与A549细胞中CD137L蛋白表达量相比,A549-TC-1(+)细胞CD137L蛋白表达明显增多,A549-TC-1(-)细胞明显减少,A549-control无明显变化差别(见图1)。表明3种载体构建成功,能用于下游实验。
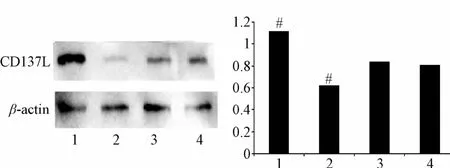
图1 4组细胞CD137L蛋白表达比较1.A549-CD137L(+);2.A549-CD137L(-);3.A549;4.A549-control#P<0.05,与3(A549组)比较Fig.1 CD137L-protein expression in four groups1.A549-CD137L(+);2.A549-CD137L(-);3.A549;4.A549-control#P<0.05,compared with A549 group
2.2 CD137L对肺癌A549细胞增殖的影响 MTT结果显示:A549-CD137L(+)细胞增殖最快,A549-CD137L(-)最慢;3组细胞数在第三天差异有统计学意义(P<0.05),第4天出现明显统计学差异(P<0.01)。表明 CD137L基因的表达对肺癌A549细胞的增殖能力有正调节效应(见图2)。
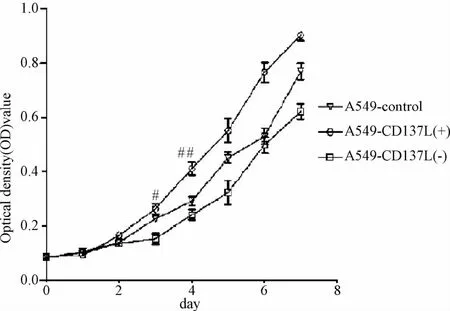
图2 3组细胞增殖能力比较#P<0.05,##P<0.01,与A549-control组比较Fig.2 Comparison of cell proliferation in three A549 cells#P<0.05,##P<0.01,compared with A549-control group
2.3 CD137L对肺癌A549细胞侵袭能力的影响 利用Transwell小室模拟血管基底膜的人工基底膜Matrigel胶,通过计数穿过Matrigel胶及Transwell小室膜的A549细胞数量来检测肿瘤细胞的体外侵袭能力。结果显示:与A549-control相比,A549-CD137L(+)细胞穿膜数量明显增加,而A549-CD137L(-)细胞穿膜数量明显降低,差异均有统计学意义(P<0.05)。提示CD137L对肺癌A549细胞的侵袭能力有正调节作用(见图3)。

图3 3组细胞侵袭能力比较#P<0.05,与A549-control组比较Fig.3 Comparison ofmigration ability in three groups#P<0.05,compared with A549-control group
2.4 CD137L对A549细胞IL-6、IL-8水平的影响 ELISA实验结果表明:与A549-control组细胞中细胞因子IL-6、IL-8的分泌水平相比,A549-CD137L(+)细胞中的IL-6、IL-8分泌量明显升高,A549-CD137L(-)细胞中IL-6、IL-8分泌量明显降低,差异均有统计学意义(P<0.01)。表明CD137L的高表达可以促进细胞因子IL-6、IL-8的分泌量(见表1)。
3 讨论
恶性肿瘤的发生、发展、转移与很多因素有关,包括肿瘤在原发部位的生长,肿瘤离开原发灶进入脉管系统,肿瘤到达远隔脏器并继续生长。其中肿瘤细胞的增殖、迁移和侵袭是其生物学行为的关键步骤。肺癌的局部增殖不仅表现为原发肿瘤的体积增大,更是原发肿瘤浸润脉管系统发生转移的重要生物学因素,而转移是导致肺癌病人死亡的主要原因,也是肺癌治疗的难点[8-9]。因此,打破肿瘤患者的免疫耐受,激活体内的免疫功能是当前肺癌免疫治疗的主要方向。CD137L作用于CD137后可以通过TRAF2、TRAF1和MAPK等途径传递细胞内信号,调节细胞因子的释放,影响生物学行为[10]。已经证实CD137L在实体瘤上有表达,主要在NSCLC细胞膜和细胞质,以及部分细胞核内表达,然而在非转换的细胞中无表达,推测肿瘤细胞表达CD137L可能诱导保护性抗肿瘤免疫的产生[11]。研究发现CD137 L在人NSCLC的表达与患者年龄、性别和病理类型等无明显的相关性,但与患者病理分期以及预后有一定的联系;且CD137L阳性表达的患者生存期较CD137L阴性表达的患者延长,说明高表达CD137L能延长患者的生存时间,为NSCLC免疫治疗提供依据[5]。研究证实CD137L在多种肿瘤细胞株及肿瘤组织上可组成性表达,CD137和CD137L的相互作用可以促进细胞株的增殖、延长其生存、并降低抗肿瘤药物的效应[12]。另外,CD137L通过与表达在T细胞表面的CD137交联可以促进T细胞的活化、增殖,增加细胞因子的分泌及活化诱导的细胞凋亡(AICD)的抑制,同时也介导反向共刺激信号,因此T细胞与巨噬细胞通过CD137/CD137L双向作用而相互活化,介导双向信号传导,促进免疫反应,可以运用于人类的肿瘤免疫治疗[13-14]。
IL-6是一种多功能蛋白,主要为单核-巨噬细胞和活化的T细胞。它不仅作用于多种免疫活性细胞,造血细胞,参与机体的炎症反应,还可以作为自分泌生长因子发挥双向性调节作用,调节机体对肿瘤细胞的免疫反应,从而加强或抑制肿瘤的生长。IL-8是趋化因子超家族中的一员,具有激活和趋化嗜中性粒细胞,参与机体炎症反应。同时也是肿瘤血管的形成因子,促进肿瘤新生血管形成,并可诱导肿瘤细胞的移动,刺激某些肿瘤细胞的生长并使细胞表达黏附分子等,在肿瘤的生长转移中发挥作用。
本文通过体外建立稳定过表达和低表达CD137L的肺癌A549细胞系,用单一因素影响肺癌细胞,研究CD137L基因对肺癌细胞生物学能力的影响。实验结果显示:CD137L对于肺癌细胞的增殖、侵袭能力具有正性调节功能,具体表现为CD137L表达增高的A549细胞其增殖、迁移及侵袭能力增强,而CD137L表达降低的A549细胞其增殖、迁移及侵袭能力减弱。说明CD137L基因的表达增高能够促进细胞增殖、迁移,并对肺癌A549细胞侵袭能力有正调节效力。各组细胞中IL-6、IL-8的水平结果显示:CD137L高表达的细胞中IL-6、IL-8分泌量明显高于CD137L低表达和正常组,说明CD137L能通过增加细胞因子IL-6的分泌,作用于肿瘤细胞,促进肿瘤的生长;增加自分泌因子IL-8的水平,促进肿瘤血管形成,从而诱导肿瘤细胞增殖,影响肿瘤细胞的侵袭和转移。
CD137L分子被认为是T细胞的共刺激分子,CD137/CD137L信号引起的生物学效应十分复杂,这种复杂的生物学效应得到初步研究。CD137配体受体之间的双向信号使许多免疫细胞与免疫细胞、免疫细胞和非免疫细胞之间产生交联,并将这种细胞之间产生的交联作用及时反馈,使调节机体作用更加精确[15]。CD137L作为共刺激分子,因其逆向信号的存在,使CD137L的作用不单是提供第二信号引起T细胞活化的功能。表明CD137L参与肿瘤的发展,通过与 CD137交联向表达CD137L的肿瘤细胞传递逆向信号,产生的效应可以是增强免疫,也可以使机体肿瘤细胞逃避免疫监视,影响机体免疫功能。CD137L对于肿瘤细胞的增殖、侵袭具体的作用机制以及相关的信号通路都还有待进一步研究,以期为肿瘤免疫治疗提供新的思路。
[1] Geiger TR,Peeper DS.Metastasis mechanisms[J].Biochim Biophys Acta,2009,17(4):293-308.
[2] 孟逸萍.环氧化酶-2在非小细胞肺癌中的表达及其与预后关系的Meta分析[J].中国生化药物杂志,2012,33(6):906-908.
[3] Zhao S,Herbert S.CD137L ligand, a member of the tumor necrosis factor family,regulates immune responses via reverse signal transduction[J].JLeuko Biol,2011,89(1):21-29.
[4] Kwajah MMS,Mustafa N,Holme AL,et al.Biphasic activity of CD137 ligand-stimulated monocytes on T cell apoptosis and proliferation[J].J Leuko Biol,2011,89(5):707-720.
[5] 承婷,刘怡茜,武常玲,等.非小细胞肺癌组织CD137L其临床意义[J].中华肿瘤防治杂志,2012,19(7):506-509.
[6] Wang Q,Zhang P,Zhang Q,et al.Analysis of CD137 and CD137L Expression in Human Primary Tumor Tissues[J].Croat Med J,2008,49(2):192-200.
[7] Gullo C,Koh LK,Pang WL,et al.Inhibition of proliferation and induction of apoptosis inmultiplemyeloma cell lines by CD137L ligand signaling[J].PLos One,2010,5(5):10845-10849.
[8] 承婷.CD137L在非小细胞肺癌上的表达及其临床意义[D].南京医科大学,2011.
[9] Scandiuzzi L,Ghosh K,Zang X.T cell costimulation and coinhibition:geneticsand disease[J].Discov Med,2011,12(63):119-128.
[10] Fernández Do Porto, Jurado DA, Pasquinelli JO, et al.CD137 differentially regulates innate and adaptive immunity against Mycobacterium tuberculosis[J].Immunol Cell Biol, 2011,90(7):449-456.
[11] 牟永告,谢海涛,彭辉,等.4-1BBL分子在脑胶质瘤组织中的表达及其临床意义[J].中国病理生理杂志,2010,26(12):2342-2346.
[12] 武常玲,承婷,刘怡茜.CD137L在肺癌细胞株的表达及其生物学功能[J].江苏医药,2012,38(11):1241-1244.
[13] S llner L,Shaqireen DO Kwajah MM,Wu JT,et al.Signal transduction mechanisms of CD137 ligand in human monocytes[J].Cell Signal,2009,19(9):1899-1908.
[14] Julia María Martínez Gómez,Vanessa Hui Qi Koh,Benedict Yan,et al.Role of the CD137 ligand(CD137L)signaling pathway during Mycobacterium tuberculosis infection[J].Immunobiology,2013,12(7):1-9.
[15] Baessler T,Charton JE,Schmiedel BJ,et al.CD137 ligand mediates opposite effects in human and mouse NK cells and impairs NK cell reactivity against human acute myeloid leukemia cells[J].Blood,2010,115(15):3058-3069.
(编校:吴茜)
The role and mechanism of CD137L in non-small cell lung cancer proliferation,m igration and invasion
ZHENG Fang-xia1,LIXue-zhang2,ZHENGWei-xia2,CHENG Yu-feng1Δ,SHENG Yan-xing2,GAOWen3
(1.Department of Radiation Oncology,Qilu Hospital of Shandong University,Jinan 250012,China;2.Department of Radiation Oncology,Liaocheng People's Hospital,Liaocheng 252000,China;3.Department of Clinical Medicine,Nanjing Medical University,Nanjing 210029,China)
Objective To study CD137L expression in non-small cell lung cancer,its effect on cell proliferation,migration and invasion and explore the molecular mechanisms of non-small cell lung cancer invasion and metastasis.Methods Lentiviral vectors of CD137L overexpression,CD137L-RNA interference and A549 controlwere constructed and transfected into A549 cell.CD137L protein expression in three groupswere detected by Western blot;cell proliferation assay were conducted by MTT;cancer cells proliferation,invasiveness were measured by Matrigel transwell chamber invasion assay;IL-6 and IL-8 levels in cell supernatants were detected by ELISA method.Results Western blot results showed that:compared with A549 cell,CD137L protein expression in A549-TC-1(+)cell increased significantly,A549-TC-1(-)cell decreased significantly,the differences were all statistically significant(P<0.05),and therewas little change in transfected A549-control cell,which indicating that three kinds of viral vectors can be used for subsequent experiments..MTT and matrigel transwell chamber invasion assay results showed that:compared with A549-control cell,A549-TC-1(+)cell proliferation migration and invasion capacitywere enhanced,and A549-TC-1(+)cellwereweakened,the differenceswere all statistically significant(P<0.05).ELISA results showed that cell serum IL-6,IL-8 levels in A549-TC-1(+)cell were all significantly higher than A549-TC-1(-)cell and normal A549 cell a groups.Conclusion CD137L can regulate non-small cancer cell proliferation and invasion positivily,the mechanism may related to increasing IL-6,IL-8 secretion and thereby enhancing tumor growth,proliferation and invasion.
CD137L;non-small cell lung cancer;proliferation;migration;invasion
R734
A
1005-1678(2014)06-0014-04
国家自然科学基金(81101759)
郑芳霞,女,硕士,主治医师,研究方向:肿瘤放疗、化疗及基础研究,E-mail:15006396314@163.com;程立峰,通信作者,男,主任医师,博士生导师,研究方向:肿瘤的放疗、化疗,E-mail:qlcyf@126.com。
