亚叶酸钙与DNA 相互作用的热力学和光谱学研究
2014-09-17徐香玉孙德志
徐香玉 孙德志
(济宁医学院生物纳米技术与医学工程研究所,山东 济宁 272067;聊城大学化学化工学院,山东 聊城 252059)
目前临床上用于治疗癌症、遗传性、病毒性疾病的许多药物的发挥作用都是基于它们与DNA 的结合[1-4]。因此,研究DNA 与药物分子的相互作用对于提高药物的药效是很有用的。药物分子与DNA 分子之间相互作用的热力学性质测定以及其作用模式的探讨,是研究药物生物学功能的重要途径[5-7]。亚叶酸钙(calcium folinate,CaFL)是叶酸的衍生物[8-10],它可以作为辅酶叶酸的前驱体,在核酸和蛋白质氨基酸生物合成中能分散到合适的基层中,可以用于怀孕期间的抗贫血维生素。CaFL的药效和生物活性受到它们和DNA 相互作用的影响。本文利用等温滴定微量热与光谱学相结合的方法研究了CaFL和小牛胸腺DNA之间的相互作用,确定了药物与DNA 的结合模式。
1 实验部分
1.1 试剂
亚叶酸钙盐水合物(纯度大于99%) 购自Sigma-Aldrich 公司,其分子结构见图1。小牛胸腺DNA(ct-DNA) 购自Sigma 公司,其溶液纯度通过A260/A280>1.8 来衡量,浓度通过260 nm 处的紫外吸收强度来计算。硫酸小檗碱(BR)未作任何处理。三羟甲基氨基甲烷、盐酸以及氯化钠都是分析试剂,实验过程中所用的蒸馏水是在高锰酸钾下制备的二次蒸馏水。其他的试剂都是分析纯试剂并且都是在浓度为0.01 M 的Tris-HCl 缓冲溶液中配制而成。
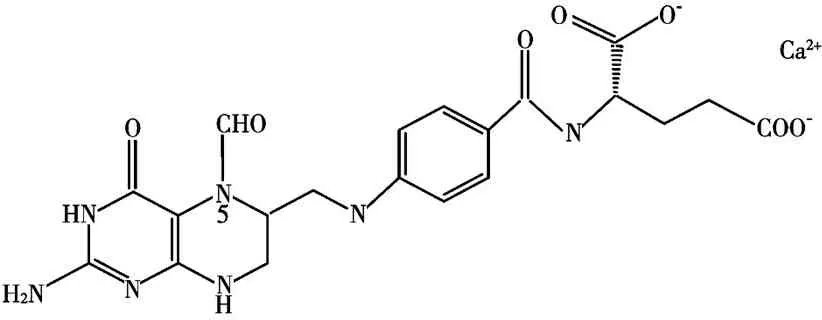
图1 CaFL的分子结构
1.2 CaFL与DNA 作用的等温滴定量热实验
滴定微量热测量是由纳瓦级滴定式微量热计TAM 2277 在Digitam 4.1 软件控制下完成的。在1ml 的样品池和参比池中分别装入500 μl 浓度为4.68 × 104M 的DNA 溶液和750 μl Tris-HCl 缓冲溶液。将20.0 mM 的CaFL溶液装入500 μl Hamilton 注射器中,用612 Lund Syringe Pump 注射泵每次滴15.0 μl,共滴定30次,滴定时间间隔足够长,(每两滴之间的时间间隔为30 min),298.15 K 下分别进行了药物向Tris-HCl 缓冲溶液中滴定和Tris-HCl 缓冲溶液向DNA 溶液中滴定的试验。
1.3 CaFL与DNA 作用的紫外光谱的测定
为了进一步了解CaFL 与DNA 的相互作用,测定了两者在波长范围220 nm到350 nm 处的吸光度,比色皿中DNA 溶液的浓度固定为42.37 μM,CaFL溶液的浓度从0.22 μM (低浓度) 变化到50.80 μM (高浓度)。利用UV-Vis 紫外分光光度计(Hp 8453,美国惠普公司)对紫外吸收光谱进行测量。
1.4 CaFL与DNA 作用的荧光光谱实验
利用荧光分光光度计(LS55,Perkin-Elmer,美国) 对DNA-BR-药物溶液体系的荧光强度进行了测量。相应的扫描波段是450~650 nm。被测溶液中药物的量是不同的,但是DNA 和BR 的浓度分别固定为70.03 mM 和 66.12 μM。
2 结果与讨论
2.1 CaFL与DNA 结合的滴定量热模型
图2是298.15 K 时CaFL 与DNA 结合的等温滴定量热曲线。利用MATLAB 7.01 软件对所得数据进行非线性最小方差拟合可以得到∑Qj对药物分子与DNA 摩尔比的拟合曲线(见图3)。通过分析试验点和拟合曲线之间的分离度可以推断在DNA 分子上有两类位点可以与药物小分子配体相结合。所以由热力学公式可以得到ΔH1°、ΔH2°、N1、N2、K1°、K2°、吉布斯自由能变(ΔG°) 和熵变(ΔS°) 等热力学参数,所得结果见表1。
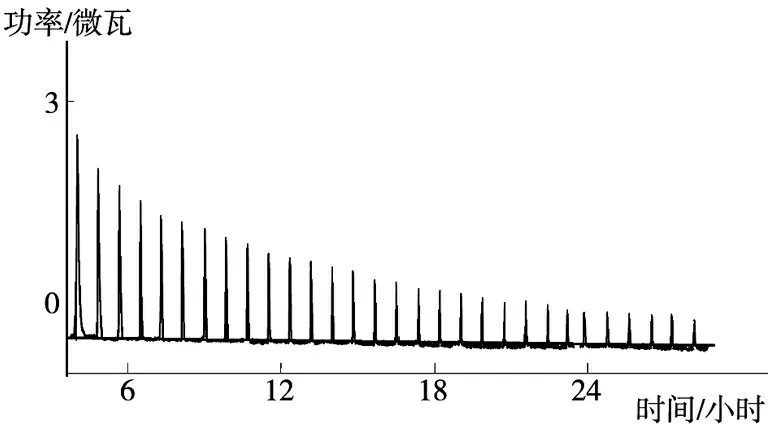

图2 CaFL溶液(20.0 mM) 与DNA溶液(4.68 × 104 M) 结合的等温滴定量热曲线

图3 结合反应热(■) 对CaFL与DNA摩尔比的非线性拟合曲线
2.2 对结合体系热力学参数的分析
从表1 的数据可知平衡常数K2°大于K1°,这表明第2类结合要比第1类结合稳定,虽然第1类结合位点数(N1) 比第2类结合位点数(N2) 大得多。从平衡常数和结合位点数所带来的信息可以得到一种合理地推断:两类结合位点之间存在着差异。如果在第1类结合位点中药物分子只是与DNA 表面的磷酸基团相互作用而不是嵌入到DNA 分子的疏水核心部分,由于弱的相互作用和较大的结合位点数,这种药物与生物大分子的结合属于第1类结合。然而,当药物分子(部分)嵌入到由DNA 双螺旋结构所形成的分子内空间并且和碱基对相结合时则属于第2类结合。
生物大分子与配体之间相互作用的作用力主要包括疏水相互作用力、氢键和静电相互作用力。对于DNA-药物体系,正的焓值和熵值表明第1类结合是一个吸热熵增过程。吸热和熵增效应表明氢键和静电相互作用力是此类结合的主要作用力。当药物分子靠近结合位点时它们将会失去其水化层中的一些水分子,并且在结合过程中药物分子将DNA 分子周围的水分子挤出。与此同时,结合位点处的DNA 分子水化层也受到部分破坏。DNA 和药物的脱水作用都是吸热的并且对熵增有正贡献。因为TΔS1° ≫ΔH1°,并且熵增效应导致了ΔG1°<0,所以第一类结合是熵驱动过程。
对第2类结合位点来说其负的焓变和正的熵变表明了此类结合是放热熵增过程。原因可能是DNA 分子的碱基对和药物配体分子之间存在直接的吸引力,这种作用力能够引起放热反应。当FL2-离子从本体相靠近DNA 分子时,它们将会失去空间自由度,这导致了由脱水效应引起的熵减绝对值大于熵增绝对值。但是在结合过程中,药物分子会将起初依附在DNA 分子周围的水分子挤出,这一水化过程对熵变有正贡献,且此正贡献要大于上述的熵减效应。总的来说,第2类结合是放热且熵增过程,也就是说,熵效应和热效应都对负的吉布斯自由能变有正贡献。又因TΔS2° ≫ |ΔH2°|,所以此类结合主要以熵驱动为主的熵焓协同驱动过程。此外,因为此类结合过程的ΔH2°> 0 且ΔS2°<0,表明疏水相互作用力是大分子和配体分子之间的主要作用力。
总的来说,负的吉布斯自由能变(ΔG1° 和ΔG2°) 表明这两类结合过程都是自发进行的,并且在溶液中可以形成DNA-FL2-超分子化合物。同时,通过比较热力学参数,可以发现两类结合位点结合行为的差异。
2.3 药物与DNA 作用的紫外吸收光谱的分析
DNA 与CaFL典型的吸收峰分别在259 nm和287 nm 处,低浓度时混合溶液的吸收峰主要在260 nm 处,而高浓度时其吸收峰主要在284 nm 处(见图4、图5)。由这些图可知,混合溶液的吸收峰不是药物和DNA 特征吸收峰的简单叠加。增色效应可能是药物小分子与DNA 相互作用导致DNA 双螺旋结构变化的结果;而减色效应则是插入剂生色团与DNA 的碱基发生静电作用的结果。由Long 理论可知,增色现象和红移效应是药物以嵌插方式与DNA 相互作用的标志,DNA 分子的π电子云和药物分子参与相互作用,最大吸收峰向长波方向移动并且吸光度增加。当小分子与DNA 以静电作用力相互作用时,吸收峰的位置不变但是峰强度时变化的。


CaFL与DNA的浓度分别为42.37 μM 和2.16 μMa:DNA;b:CaFL;c:a和b曲线的简单加和;d:混合溶液
CaFL和DNA的浓度分别为42.37 μM 和30.48 μM
a: DNA;b: CaFL;c:a和b曲线的简单加和;d:混合溶液。
图5 pH值为7.20的缓冲溶液中高浓度范围内CaFL与DNA相互作用的紫外吸收光谱图
低浓度和高浓度混合溶液的紫外光谱差异就在于红移和吸光度的大小不一样。低浓度时最大吸收峰红移了1 nm,而高浓度时则红移了23 nm。与空白DNA 溶液的光谱图相比较,加入低浓度药物时峰位置发生了轻微的红移,但是增色效应很明显;当加入高浓度药物时峰位置和增色现象都发生了显著的变化。这些结果表明CaFL-DNA 体系的相互作用在低浓度时以静电相互作用力为主,而在高浓度时则以嵌插作用力为主。
2.4 CaFL对BR与DNA 相互结合的影响
CaFL在任何溶剂中甚至是在有DNA 存在的情况下都没有荧光信号。为了更好地理解FL2-和DNA 的相互作用,将BR 用做荧光探针。在DNA 分子存在的情况下,由于小檗碱与双链DNA 碱基之间强烈的嵌插作用,它们可以产生非常强的荧光。
试验证明无DNA 存在时的自由小檗碱的荧光强度无任何变化,但是随着药物亚叶酸钙浓度的增加,小檗碱和DNA 的混合溶液呈现明显的猝灭现象。DNA-BR体系的荧光猝灭程度可以用来测定另外一种新药物分子与DNA 分子的结合程度。所以,用CaFL做猝灭剂的稳态竞争结合实验可以对研究药物与DNA 的结合反应提供更多的信息。图6 中所示的是有无药物存在时DNA 与小檗碱结合的发射光谱。从图中的曲线可知,低浓度时发射峰强度略有减少,但是随着药物浓度的增加混合溶液的猝灭程度增强。当药物溶液的浓度高达20.32 μM 时猝灭程度变得十分明显。
为了更好地理解DNA 与CaFL相互作用的机理,绘制了有无CaFL存在时小檗碱对DNA 抑制作用的Scatchard 曲线 (如图7 所示)。CaFL猝灭了DNA-BR 混合物的发射峰,Scatchard 曲线表明无论是低浓度还是高浓度此种猝灭都存在竞争性和非竞争性行为。此结果表明,药物和DNA分子 反应的结合位点与探针小檗碱与DNA 分子的不完全相同。当药物分子与DNA 分子相互作用时其会与探针小檗碱发生竞争,并且药物会以嵌插作用插入到DNA 双螺旋内部与碱基对相互作用,同时也会以静电作用与DNA 的磷酸基团相结合。

BR和DNA的浓度分别为66.12 mM,70.03 mM,箭头表示随着CaFL浓度的增加荧光强度的变化,从a到g药物CaFL的浓度为0、1.02、3.07、5.12、7.17、9.22和20.32mM

图6 随着CaFL浓度的增加脱氧核糖核酸-硫酸小檗碱的混合溶液的发射光谱图
DNA溶液的浓度为42.37 mM,BR溶液的浓度从10 mM 变化到100 mM。
图7 无药物CaFL存在时(■)BR和DNA的Scatchard 图以及药物浓度为2.16(●) μM 和 260μM (▲)时的Scatchard 图
3 结论
利用等温滴定微量热、紫外光谱以及荧光光谱相结合的方法综合性地研究了小牛胸腺DNA 与药物小分子(CaFL) 在缓冲溶液(pH=7.40) 中的相互作用。量热实验得到了各超分子体系结合过程中的结合常数、结合位点数、焓变、熵变及吉布斯自由能变等热力学数据,对这些热力学数据进行分析,研究结果表明小牛胸腺DNA 分子上有两类位点可以与CaFL的FL2-离子相结合。量热学实验以及光谱实验均表明在低浓度范围内药物主要以氢键和静电相互作用力与DNA 分子相结合;而在高浓度范围内则主要以疏水相互作用力与DNA 分子相结合。
[1] Yin Z,Wang Y,Whittell L R,et al. DNA replication is the target for the antibacterial effects of nonsteroidal anti-inflammatory drugs[J]. Chem Biol,2014,21(4):481-487.
[2] Zhao P,Xu L C,Huang J W,et al. DNA binding and photocleavage properties of a novel cationic porphyrin anthraquinone hybrid[J]. Biophys Chem,2008,134(1/2):72-83.
[3] 张碧程,胡林,刘艳辉,等. 喹诺酮药物与DNA分子相互作用的紫外光谱研究[J]. 山东大学学报(理学版),2011,46(7):11-16.
[4] 上官国强,曲晓刚.有机锗蒽酰胺和有机错萘酚倍半氧化物与DNA的相互作用[J].济宁医学院学报,2013,36(6):157-161.
[5] Shahabadi N,Maghsudi M,Mahdavi M,et al. Interaction of calf thymus DNA with the antiviral drug Lamivudine[J]. DNA Cell Biol,2012,31(1):122-127.
[6] Canotilho J,Esteves de Castro R A,Helena M,et al. Infrared study of the acidic and basic forms of betaxolol[J]. Spectrochim Acta A Mol Biomol Spectrosc,2006,64(2):279-286.
[7] Kunwar A,Simon E,Singh U,et al. Interaction of a Curcumin Analogue Dimethoxycurcumin with DNA[J]. Chem Biol Drug Des,2011,77(4):281-287.
[8] Talaulikar V,Arulkumaran S. Folic acid in pregnancy[J]. Obstetrics,Gynaecology & Reproductive Medicine,2013,23:286-288.
[9] Miller J W,Folic Acid. Encyclopedia of human nutrition[M]. 3rd Edition. Elsevier,2013,262-269.
[10] Hosseini M B,Khamnian Z,Dastgiri S,et al. Folic acid and birth defects:a case study (Iran)[J]. J Pregnancy,2011,2011:1-3.
