白藜芦醇对酒精性氧化损伤修复作用研究*
2014-09-17童春义卜晓英张志美唐凤霞刘选明
童春义 ,李 芳, 卜晓英, 蒋 斌 ,张志美 ,唐凤霞, 刘选明†
(1.湖南大学 生物学院,湖南 长沙 410082;2.植物功能基因组学与发育调控湖南省重点实验室(湖南大学),湖南 长沙 410082; 3.吉首大学 林产化工工程湖南省重点实验室,湖南 张家界 427000)
白藜芦醇是一种在植物内发现的天然抗氧化剂,主要存在于虎杖、葡萄、花生和松树等70多种植物中.国内外很多学者对白藜芦醇的生物学功能进行了深层研究,结果表明,其具有抗癌[1-2]、抗心血管疾病、抗突变、抗菌[3]、抗病毒、抗氧化[4]、诱导细胞凋亡及雌激素调节等多方面有益于人类健康的生物药理活性,研究前景广阔.但是,长期以来,学者们主要注重于白藜芦醇的预防作用研究[5],而对于白藜芦醇对损伤期间或后期的干预研究较少.因此本实验着重研究白藜芦醇作为一种潜在的有价值的药物是否有治疗效果.以模式细胞HeLa作为研究对象,以白藜芦醇作为功能药物,在构建酒精损伤细胞的模型基础上,从细胞与分子水平上研究其对酒精性细胞损伤的修复作用.
1 实验部分
1.1 实验材料与仪器
1.1.1 实验试剂
白藜芦醇(w白>98%,长沙唯尔生物科技公司);无水乙醇(分析纯,北京鼎国生物技术公司);RPMI 1640培养基和小牛血清(HyClone);噻唑蓝(MTT,Genview),Hoechst33342和溴化丙锭(Sigma),总超氧化物歧化酶(T-SOD)与丙二醛(MDA)检测试剂盒均购自南京建成生物工程研究所.
Hela细胞购自中南大学细胞库,在本实验室保存并培养.
1.1.2 主要仪器
CO2培养箱(美国Thermo公司);倒置荧光显微镜(日本Nikon公司);低温高速离心机(德国Eppendorf公司);全自动酶标分析仪 (美国Thermo公司);紫外-可见分光光度计(北京莱伯科仪器有限公司);超声波细胞粉碎机(宁波新芝生物科技股份有限公司);荧光定量PCR仪(日本安捷伦公司);超净工作台(江苏苏净集团安泰公司).
1.2 实验方法
1.2.1 酒精损伤细胞模型的建立与白藜芦醇的干预
根据本实验室前期筛选结果表明,当体积分数为4.8%的乙醇作用于Hela细胞12 h时,细胞具有一定的恢复,而浓度过高或者处理时间延长,细胞均出现无法恢复的情况,为此本实验选择体积分数为4.8%的乙醇作用于Hela细胞12 h时建立酒精损伤模型[6].细胞换液时将白藜芦醇(DMSO溶解)加入新鲜培养基中,按不同剂量(终浓度10~100 μM)分别在酒精损伤之前预处理细胞24 h(前处理组)、与酒精同时加入处理细胞12 h(同时处理组)、在损伤之后加入处理细胞24 h(后处理组),检测白藜芦醇对酒精损伤的干预作用.每组实验不少于3个平行,设置酒精损伤模型组与正常培养细胞组为对照组.选出修复效果最佳组合为干预组进行后续实验.
1.2.2 细胞形态学观察
将正常对照组、酒精损伤组与白藜芦醇干预组的细胞用D-hank's清洗3遍,然后加入hoechst33342染液,终浓度为5 μg/mL,在室温下避光染色10 min,继续加入PI染液,终浓度为15 μg/mL,4 ℃下避光反应10 min,D-hank's稍清洗一遍即可在倒置荧光显微镜下观察并照相,观察比对各组细胞的凋亡情况.
1.2.3 流式细胞术分析
将正常对照组、酒精损伤组与白藜芦醇干预组的细胞用D-hank's清洗后,胰酶消化,D-hank's吹打均匀后4 ℃ 1 000 r/min离心5 min,去上清液,4 ℃预冷的70%酒精重悬细胞,4 ℃过夜后用流式细胞仪检测细胞凋亡率.
1.2.4 氧化损伤的生化指标检测
将正常对照组、酒精损伤组与白藜芦醇干预组的细胞用D-hank's清洗3遍用胰酶消化,生理盐水吹打均匀后,置于冰水混合物中超声波破碎细胞,12 000 r/min低温高速离心5 min后转移上清液,上清液即为所提蛋白质,用考马斯亮蓝法测量蛋白浓度后,按丙二醛(MDA)、总超氧化物歧化酶(T-SOD)检测试剂盒的说明书进行生化活性指标的检测,评估白藜芦醇干预酒精损伤的Hela细胞的机制是否与氧化损伤有关.其中细胞MDA水平反映脂质过氧化程度,T-SOD水平反映内源抗氧化能力的大小.
1.2.5 荧光定量PCR
按实验指导书中操作步骤提取各组细胞总RNA,逆转录为cDNA后,以cDNA为模板做荧光定量PCR,分析各基因表达情况.反应条件为:94 ℃预变性3 min后进入循环,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共45个循环,最后72 ℃延伸5 min.其中用到的相应引物序列如表1所示.

表1 荧光定量PCR中用到的引物
1.2.6 统计学处理

2 结果与讨论
2.1 白藜芦醇对细胞受酒精损伤干预作用
在酒精损伤细胞前、中、后3个时期分别加入一系列浓度白黎芦醇,以细胞存活率考查其干预效果,结果如图1所示.白藜芦醇先处理细胞和与酒精同时处理细胞,细胞都出现存活率下降的情况,而在酒精损伤后加入低剂量白藜芦醇(10~50 μM),细胞存活率出现一定程度的提高(相对于损伤模型,存活率提高0%~10%),说明低剂量的白藜芦醇减轻了酒精对细胞的损伤,或者说修复了酒精对细胞造成的部分损伤.为此,在酒精损伤细胞12 h后,加入20 μM白藜芦醇处理24 h为白藜芦醇干预组,来进一步研究白藜芦醇对酒精致氧化损伤细胞的修复作用.

RES浓度/μm
2.2 细胞形态学分析白藜芦醇修复作用
对正常培养组细胞(a)、酒精损伤模型组细胞(b)和白藜芦醇干预组细胞(c)进行hoechst33342/PI染色,倒置荧光显微镜观察细胞形态,如图2所示,正常培养的Hela细胞呈规则梭形,细胞核呈淡蓝色(图2(a));经酒精损伤后自我修复的细胞有近半数呈圆形,呈现凋亡形态,细胞核被染成红色,说明半数细胞处在凋亡晚期或死亡(图 2(b));而白藜芦醇干预的细胞仍大多呈梭形,细胞核大多变为淡蓝色为正常细胞,少数为亮蓝色的凋亡早期细胞,极个别带红色为凋亡细胞(图2(c)).由此结果我们推测,酒精损伤后细胞的自我修复能力差,损伤的细胞大多走向凋亡晚期甚至死亡;而在白藜芦醇作用下,提高了细胞修复这种损伤的能力,使得细胞在培养过程中渐渐得到恢复,从而呈现早期凋亡或已恢复正常的细胞核状态.可见,白藜芦醇有助于细胞恢复状态,提高了细胞自我修复的能力.
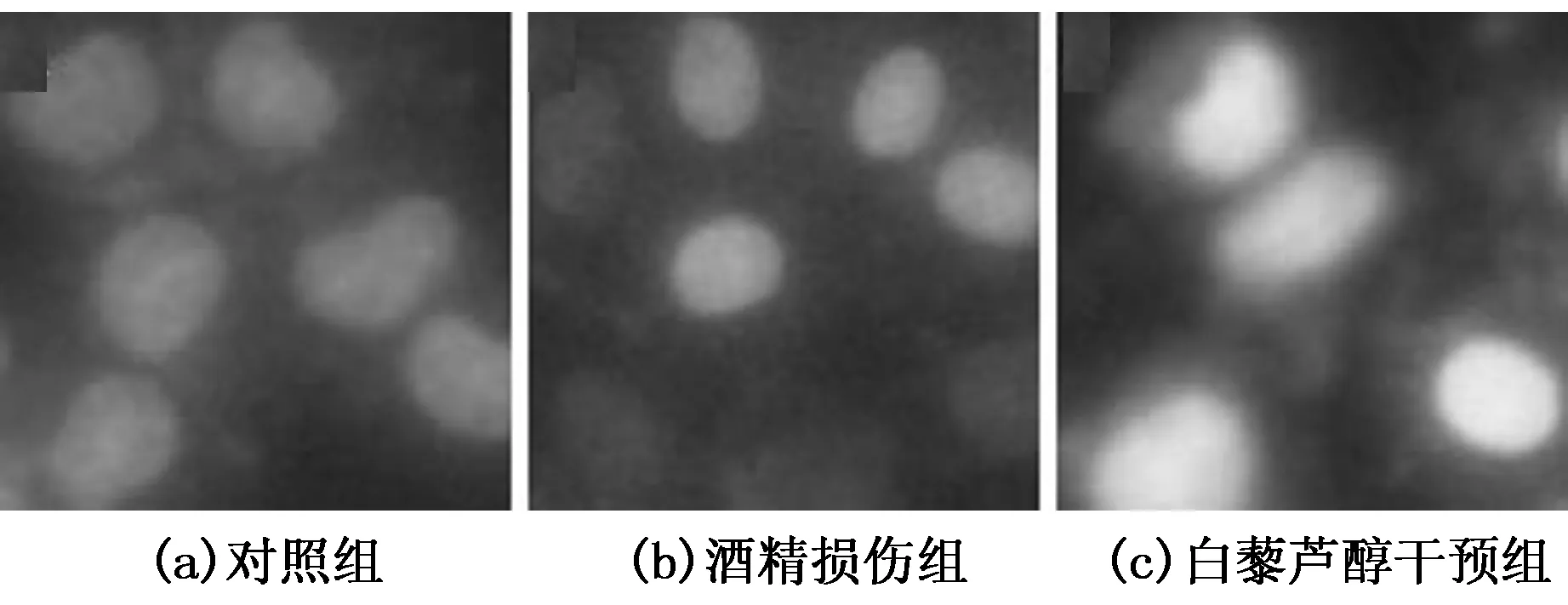
图2 Hela细胞形态的变化(200×)
2.3 白藜芦醇干预对细胞周期的影响
通过流式细胞仪对正常培养组细胞、酒精损伤组细胞和白藜芦醇干预组细胞进行细胞周期分析,结果如图3所示.正常培养组细胞没有出现明显的凋亡峰(图3(a));酒精损伤组细胞出现明显的凋亡峰(图3(b));而白藜芦醇干预组细胞的凋亡峰明显变小(图3(c)).这说明白藜芦醇的干预能够降低细胞凋亡率,说明在受到酒精损伤后,细胞自身24 h的恢复能力有限,而白藜芦醇的干预能通过增强细胞活力来提高应对损伤的能力,抑制了损伤细胞的凋亡.对细胞周期分析可知(如图3(d)),酒精损伤组细胞主要是将细胞阻滞在S期,而白藜芦醇的干预能消除这种阻滞,促进细胞的分裂增殖从而达到修复细胞损伤的效果.
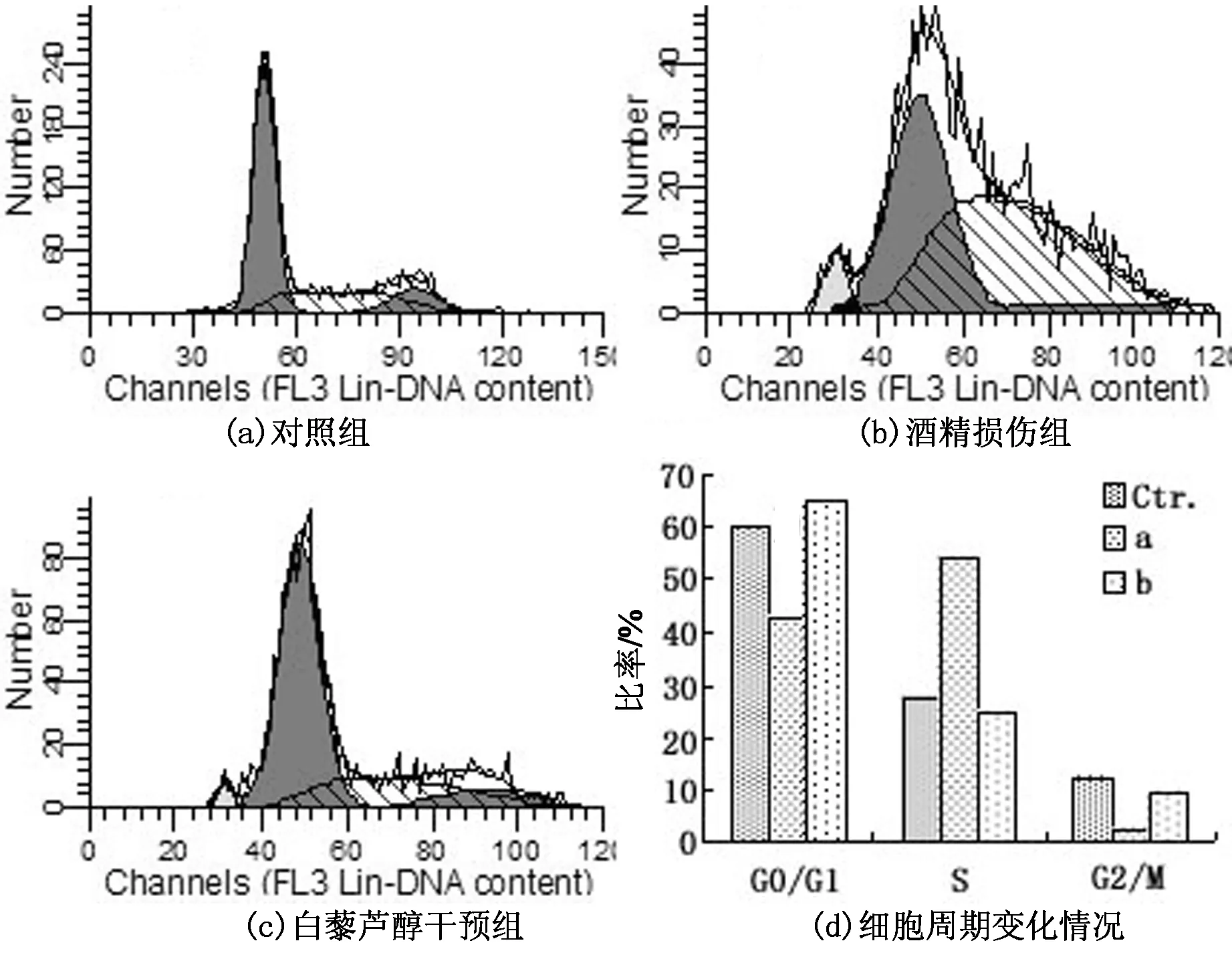
图3 流式细胞术分析结果
2.4 白藜芦醇干预对细胞内生化指标的影响
MDA[7]是脂质氧化损伤的经典标志物,其含量高低反映了细胞内脂质过氧化的程度,而T-SOD[8]活性变化情况反映了细胞清除氧自由基的能力,测定MDA和T-SOD等细胞内生化指标,从生化角度验证白藜芦醇作用机理.结果如表2所示.酒精损伤组细胞的MDA含量相比于正常培养组细胞显著增加,而经白藜芦醇干预组细胞则与正常培养的细胞无明显差异.这说明酒精处理细胞引起脂质过氧化物堆积,而细胞自身的修复能力有限,不足以清除这些多余的脂质过氧化物,造成氧化损伤,白藜芦醇的加入能显著减少脂质过氧化物堆积,减轻甚至修复了由酒精造成的氧化损伤.另外,酒精损伤组细胞内T-SOD的活性与正常培养组细胞无显著差异,这也说明细胞的自身修复效果不明显,而白藜芦醇可能大大增强了T-SOD的活性,提高了细胞抗氧化的能力,可以更好地修复酒精造成的氧化损伤.

表2 细胞内MDA水平与T-SOD活性的变化
2.5 白藜芦醇干预对氧化相关基因的影响
OGG1编码的OGG1蛋白[9]主要识别和切除氧化损伤所产生的8-oxoG,一般认为,OGG1的表达量增加,OGG1蛋白的活性增强,修复氧化损伤能力越强.而ALDH2[10]是将乙醛继续代谢成CO2和H2O的一种酶,ALDH2的表达量增加,ALDH2酶的活性增强,越能降低体内乙醛堆积,减轻氧化损伤.采用定量PCR的方法检测各实验组细胞OGG1和ALDH2的mRNA水平表达量,结果如图4所示,酒精损伤组的细胞OGG1和ALDH2的mRNA水平表达量略有下调,说明细胞的自我修复能力较弱,不足以修复酒精造成的损伤;而加入白藜芦醇后的细胞OGG1和ALDH2的表达量均大大的上调,是正常培养组细胞的2倍左右,比损伤组细胞高出2~4倍,说明白藜芦醇可通过上调这些基因的表达来增强细胞内减轻和修复氧化损伤的能力.

图4 白藜芦醇干预对OGG1和ALDH2 mRNA水平表达量的影响
3 结 论
酒精进入机体后,主要由细胞中的乙醇脱氢酶、乙醛脱氢酶、过氧化氢物分解酶等进行代谢,乙醇在细胞代谢中产生乙醛,乙醛在代谢过程中产生大量活性氧自由基,攻击细胞膜脂质、蛋白和核酸,使细胞处于促氧化物质明显增多和抗氧化物质明显减少的氧化应激状态、最终损害细胞的结构与功能,形成酒精致氧化损伤.白藜芦醇能通过修复氧化损伤途径来减轻甚至修复酒精对细胞造成的损伤.从细胞和生化角度看,白藜芦醇能通过减少细胞内氧化产物MDA的生成和增强抗氧化酶T-SOD的活性来抵御酒精对细胞造成的氧化损伤,表现为恢复细胞正确的细胞周期和减少凋亡;从分子水平看,白藜芦醇通过上调氧化损伤修复基因OGG1与ALDH2的表达,提高细胞修复氧化损伤的能力.综合上述结果推测,白藜芦醇是一个很有价值的潜在修复氧化损伤药物,本研究为白藜芦醇作为治疗药物应用提供了初步理论支持.
[1] ATHAR M, BACK J H, TANG X W,etal. Resveratrol: A review of preclinical studies for human cancer prevention[J]. Toxicology and Applied Pharmacology, 2007, 224(3): 274-283.
[2] GUPTA S C, KANNAPPAN R, REUTER S,etal. Chemosensitization of tumors by resveratrol [J]. Annals of the New York Academy of Sciences,2011, 1215: 150-160.
[3] 李永军,李巍伟,王鑫,等.白藜芦醇对葡萄球菌抗菌活性研究[J].中国实验诊断学,2008, 12(1): 58-60.
LI Yong-jun, LI Wei-wei, WANG Xin,etal. Study of in vitro antibacterial activity of resveratrol[J]. Chinese Journal of Laboratory Diagnosis, 2008,12(1): 58-60.(In Chinese)
[4] YAN Y, YANG J Y, CHEN G L,etal. Protection of resveratrol and its analogues against ethanol-induced oxidative DNA damage in human peripheral lymphocytes [J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2011, 721 (2): 171-177.
[5] ZHENG Y, LIU Y H, GE J Y,etal. Resveratrol protects human lens epithelial cells against H2O2-induced oxidative stress by increasing catalase, SOD-1, and HO-1 expression [J]. Molecular Vision,2010, 16: 1467-1474.
[6] AKBAY T T, SEHIRLI O, ERCAN F,etal. Resveratrol protects against methotrexate-induced hepatic injury in rats [J].Journal of Pharmacy & Pharmaceutical Sciences, 2010, 13 (2): 303-310.
[7] ABOUL-ELA H M, SAAD A A, EL-SIKAILY A M A,etal.Oxidative stress and DNA damage in relation to transition metals overload in Abu-Qir Bay, Egypt[J]. Journal of Genetic Engineering and Biotechnology, 2011, 9(1): 51-58
[8] AKSENOV M Y, AKSENOVA M V, BUTTERFIELD D A,etal. Protein oxidation in the brain in Alzheimer’S disease[J]. Neuroscience, 2001, 103(2):373-383.
[9] 夏春波, 蒋常文, 刘源劼, 等. OGG1 mRNA在鼻咽癌组织中的表达及其意义[J]. 实用医学杂志,2010, 26(5): 729-731.
XIA Chun-bo, JIANG Cang-wen, LIU Yun-jie,etal. Expression of OGG1 mRNA in nasopharyngeal carcinoma and its significance[J]. The Journal of Practical Medicine 2010, 26(5): 729-731.(In Chinese)
[10]哈斯图雅,毕力夫,苏秀兰.乙醛脱氢酶2(ALDH2)基因研究进展[J]. 中国优生与遗传杂志, 2007,15(5): 3-4 .
HASITUYA, BL Li-fu, SU Xiu-lan. Progress on aldehyde dehydrogenase2(Aldh2) gene[J]. Chinese Journal of Birth Health & Heredity,2007,15(5): 3-4.(In Chinese)
