植物花青素苷转运机制的研究进展
2014-09-16王璐1戴思兰1金雪花1黄河1洪艳1
王璐1,戴思兰1,金雪花1,2,黄河1,洪艳1
植物花青素苷转运机制的研究进展
王璐,戴思兰,金雪花,黄河,洪艳
1 北京林业大学园林学院,北京 100083 2 昆明理工大学现代农业工程学院,云南昆明 650500

王璐, 戴思兰, 金雪花, 等. 植物花青素苷转运机制的研究进展. 生物工程学报, 2014, 30(6): 848−863.Wang L, Dai SL, Jin XH, et al.Advances in plant anthocyanin transport mechanism. Chin J Biotech, 2014, 30(6): 848−863.
花青素苷的合成过程是生物学上研究得较为清楚的代谢通路之一,但其最后阶段的分子机制即花青素苷从细胞质被转运至中央液泡的过程却仍不清晰。最近研究者们刚刚开始对类黄酮化合物的转运过程进行动态的描绘,迄今共提出了4种花青素苷转运模型,发现了4类与花青素苷转运过程相关的转运蛋白:谷胱甘肽转移酶、多药耐药抗性相关蛋白、多药和有毒化合物排出家族和同源于哺乳动物的胆红素易位酶同族体,并对这4种转运体及相关基因的功能进行了初步研究。尽管已经提出了不同的花青素苷转运模型,但仍然缺乏对不同物种不同类型花青素苷向液泡转运及在液泡中沉积的细胞学和亚细胞学研究。根据获得的信息,可以通过开展基因序列分析、基因表达分析、亚细胞定位和互补试验等,探求转运蛋白的功能及其作用位置,更好地解析植物体内花青素苷的转运机制。
花青素苷,转运,转运蛋白,跨膜运输,液泡积累,谷胱甘肽转移酶,多药耐药抗性相关蛋白,多药和有毒化合物排出家族
花色是观赏植物重要的观赏性状之一,花色改良一直是育种工作者重要的育种目标。植物体内人们可以感知有颜色的化合物被称为色 素。植物体内主要含有3大类色素,即类黄酮、类胡萝卜素及生物碱类色素。花青素苷属于类黄酮化合物,是一类水溶性色素,在细胞质中合成但在液泡中积累,产生的颜色范围是从红色到紫色。花青素根据其基本结构分类很多,至今已知的花青素超过550种,但92%是由矢车菊色素 (Cyanidin)、飞燕草色素 (Delphindin)、天竺葵色素 (Pelargonidin)、锦葵色素 (Malvidin)、芍药色素 (Peonidin)、矮牵牛色素 (Petunidin) 6种花青素衍生而来的,其中以前3种最为常见 (图1)。花青素苷的结构、助色素、金属离子和液泡pH值均影响花青素苷的颜色。被子植物中大约88%的科的花色是由花青素苷决定的。类胡萝卜素位于质体中,是一类脂溶性色素,它产生的颜色范围是黄色—红色,可以与花青素共同存在并决定花色。生物碱类色素包括小檗碱、罂粟碱和甜菜碱等,其中甜菜碱包括产生红色或紫色的甜菜素和产生黄色的甜黄质,存在于藜科和石竹科植物中,不与花青素苷同时存在。
花青素苷的生物合成途径包括近20步化学反应,涉及约15个结构基因和3类转录因子。
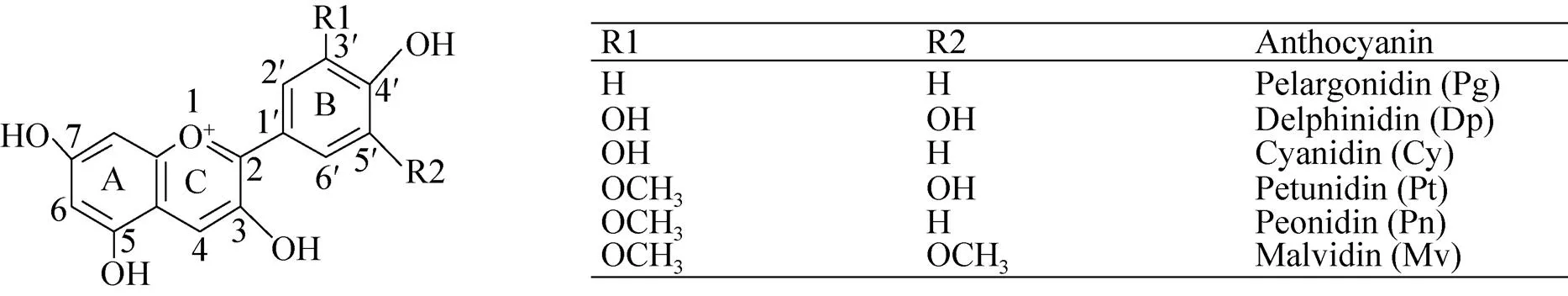
图1 花青素骨架结构及常见的6种花青素[6]
在高等植物中普遍存在着花青素-3-葡萄糖苷的合成通路(图2)。在不同物种中,花青素苷合成途径上的相关结构基因存在着表达差异,每种植物通常只表达1套特定的基因,合成底物特异性的酶,因此只积累有限种类的花青素,呈现出特定的花色。
花青素苷是由位于细胞质内的多酶复合体催化合成的,多酶复合体通过细胞色素单加氧酶P450固定在内质网上,但花青素苷却在液泡中储存且植物细胞内分布广泛,说明植物体内存在高效的花青素苷转运机制,可以将其穿越不同的有膜区室。从植物自身角度讲,一方面,植物组织要想呈现出具有吸引力的颜色,合成的花青素苷必须在液泡这个酸性细胞器中进行区划;另一方面,花青素苷具有很高的生物化学反应活性,对细胞具有毒害作用,合成的花青素苷必须被转运到液泡中予以汇集与贮存,减少对细胞的损害。因此,人们推测植物细胞中存在可以将花青素苷从细胞质转运至液泡的转运机制。

图2 类黄酮类色素的生物合成途径[12]
1 花青素苷的转运机制
花青素苷的转运和积累很大程度上影响植物的颜色表型,但花青素苷从细胞质被转运至液泡的过程却仍不清晰。目前共提出了4种花青素苷转运模型,发现了4类蛋白即GST、MRP、MATE和BTL-homologue可能参与花青素苷向液泡的转运。这4种模型可能并不是相互排斥的。
1.1 GST和MRP共同介导的花青素苷的转运
最完整的一种可能的花青素苷转运机制是由位于细胞质的谷胱甘肽转移酶 (Glutathione-Transferase, GST) 和位于液泡膜上的多药耐药抗性相关蛋白 (Multidrug resistance- associated protein, MRP) 共同完成的。花青素苷在细胞质合成后,GST催化谷胱甘肽(Glutathione, GSH) 和花青素苷共价结合,形成谷胱甘肽交联复合物 (Glutathione-conjugate)。这相当于给花青素苷加了标签,其可被液泡膜上的MRP (一种谷胱甘肽-交联结合泵 (GSH-conjugate (GS-X) pump)) 识别,MRP通过疏水基间的交互作用结合花青素苷,将其跨膜转运至液泡。然而,这个机制仍不清晰,有研究表明,是GST蛋白本身而不是GST的催化活性,为花青素苷转运所必需。即GST不是催化GSH同花青素苷结合,而是直接和花青素苷结合,充当花青素苷的运输载体,将花青素苷转运至液泡膜,再由位于液泡膜上的MRP将花青素苷跨膜转运至液泡。
1.1.1 GST
在每种植物中均以基因超家族的形式出现,如拟南芥中有47个成员,但功能各异,主要表现在底物特异性和转运靶向 (液泡、胞外等) 不同。很多研究表明,GST参与花青素苷的转运(表1)。玉米是最早发现与花青素苷转运有关的家族成员,其编码谷胱甘肽转移酶GSTIII,可以把谷胱甘肽 (GSH) 转移到花青素苷上,形成一个谷胱甘肽交联复合物,将花青素苷转运至液泡膜。功能分析表明,对花青素苷在液泡中的扣押是必需的,缺失,花青素苷不能被运输进液泡而保留在细胞质中。矮牵牛编码谷胱甘肽转移酶GSTI,是Bronze2的同源蛋白,可以结合花青素苷并运输至液泡膜。相较于Bronze2将GSH同花青素苷结合,矮牵牛中AN9蛋白直接和花青素苷结合,没有谷胱甘肽交联复合物的形成。矮牵牛突变体的表型可以转玉米基因互补。拟南芥编码一个谷胱甘肽转移酶,可以将花青素苷运输至液泡膜。突变体的花青素苷转运功能可以通过表达矮牵牛基因互补,但其只能弥补花青素苷的积累,而不能弥补原花青素的积累,即种皮中没有褐色色素的积累,表明只参与花青素苷的转运,而既参与花青素苷的转运,又参与原花青素的转运。
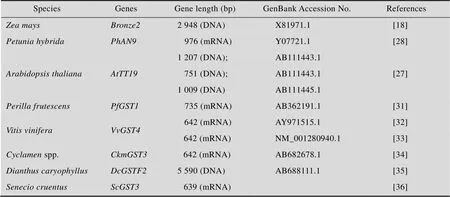
表1 不同植物中与花青素苷转运有关的GST家族成员信息
1.1.2 MRP
多药耐药抗性相关蛋白 (Multidrug resistance-associated protein, MRP/ABCC) 亚家族属于ABC (ATP-binding cassette) 超家族。ABC超家族是一类数量多、功能广泛的蛋白质,其不同的亚家族在植物次生代谢产物的跨膜转运中起着不同但重要的作用。拟南芥ABC转运蛋白总共可分为13个亚家族。其中属于全分子ABC转运蛋白的有4个亚家族:MDR (22)、MRP (15)、PDR (13) 和AOH (1);属于半分子ABC转运蛋白的有5个亚家族,分别为:PMP (2),WBC (29),ATH (16),ATM (3) 和TAP (2);属于可溶性ABC转运蛋白的可分为3个亚家族:RLI (2)、GCN (5) 和SMC (4)。另外还有15个可溶性蛋白由于在其他生物中没有发现同源蛋白,被归入NAP亚家族。
MRP亚家族的某些成员充当液泡膜上的谷胱甘肽-交联结合泵,参与花青素苷的跨膜转运。Lu等发现,拟南芥、均参与花青素苷的跨膜转运。Goodman等提出玉米与花青素苷转运有关,抑制的表达,花青素苷的积累量下降,这是目前较为完整的一个花青素苷转运相关MRP候选蛋白的报道。Zhu等提出,水稻是玉米的一个同源基因,可能与花青素苷的转运有关。在葡萄中,ABCC1被认为是定位于液泡膜上负责向液泡转运花青素3-O-葡萄糖苷的转运体。目前只在这4种植物中找到可能与花青素苷转运有关的MRP亚家族成员 (表2)。
虽然对与花青素苷转运有关的MRP亚家族成员研究的比较少,但其所属的ABC超家族跨膜转运蛋白的工作模型已非常清晰,是以直接水解ATP供能介导的次生代谢物的转运:高亲和力的底物与跨膜域结合导致ABC转运蛋白复合物的构象改变,进而引起ATP水解,由此导致被转运的底物分子转移到一个低亲和力的结合位点。之后底物分子被释放到膜外间隙或者膜的另一侧。随之,第二个ATP结合位点上的ATP水解使ATP转运蛋白恢复至原来的构象,为结合另一个底物分子做准备。ABC转运蛋白的核心单元由4个结构域组成:2个跨膜结构域 (Transmembrane domain, TMD) 和2个核苷酸结合区域 (Nucleotide binding domains, NBD)(图3)。
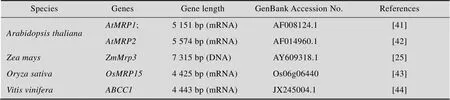
表2 不同植物中与花青素苷转运有关的MRP亚家族成员信息
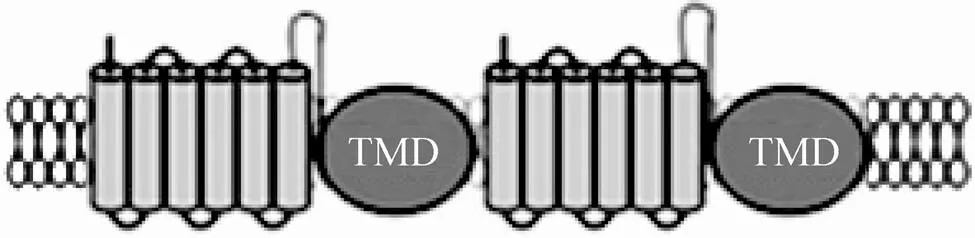
图3 ABC转运蛋白的二级结构[47]
1.2 MATE介导的花青素苷转运机制
另外一种可能的花青素苷转运机制是通过定位在液泡膜上的多药和有毒化合物排出家族 (Multidrug and toxic compound extrusion, MATE) 完成的。其介导的花青素苷跨膜转运机制是依赖于H/Na的逆向转运机制。ATP存在时,液泡膜上的MATE转运蛋白利用膜两侧的H/Na浓度梯度作为推动力,将花青素苷向液泡内转运,同时将质子泵出液泡外(图4,图5)。
1.2.1 MATE
MATE转运蛋白是一类跨膜转运蛋白,在大多数原核生物和真核生物中执行着相对保守、基础的转运功能。MATE花青素苷转运蛋白相关研究在拟南芥、葡萄和蒺藜苜蓿中都有报道(表3)。拟南芥中,MATE家族共有56个成员,其中编码的MATE转运蛋白控制着内种皮中原花青素向液泡转运的过程。Debeaujon等通过T-DNA技术克隆到了。该基因含有7个内含子,外显子编码507个氨基酸,其蛋白有12个跨膜域,用于与液泡膜结合。在合成原花色素的细胞内特异表达,在液泡膜上作为质子逆向转运蛋白调节花青素苷向液泡内的转运。拟南芥突变体液泡中所积累的花青素苷要明显少于正常植株。在葡萄中,MATE不能转运天竺葵素-3糖苷或矢车菊素-3糖苷,只能转运酰基化的花青素苷,意味着酰基化对MATE转运是必需的。
1.2.2 H-ATPase在花青素苷转运中的作用
由于MATE利用膜两侧的梯度 (植物中一般是H浓度梯度) 作为驱动力完成底物的跨膜运输,故它们的功能和活性很大程度上依赖于不同类型的H-ATPase提供并保持液泡膜两侧的H浓度梯度。H-ATPase在花青素苷转运中起着重要作用,H-ATPase关键酶的突变会导致产生透明种皮 (Transparent testa,)表型或花朵颜色的变化。P型的H-ATPase提供并保持细胞质膜两侧的H浓度梯度,而V型H-ATPase或液泡焦磷酸酶 (Vacuolar pyrophosphatase, V-PPase) 质子泵提供并保持液泡膜两侧的H浓度梯度。
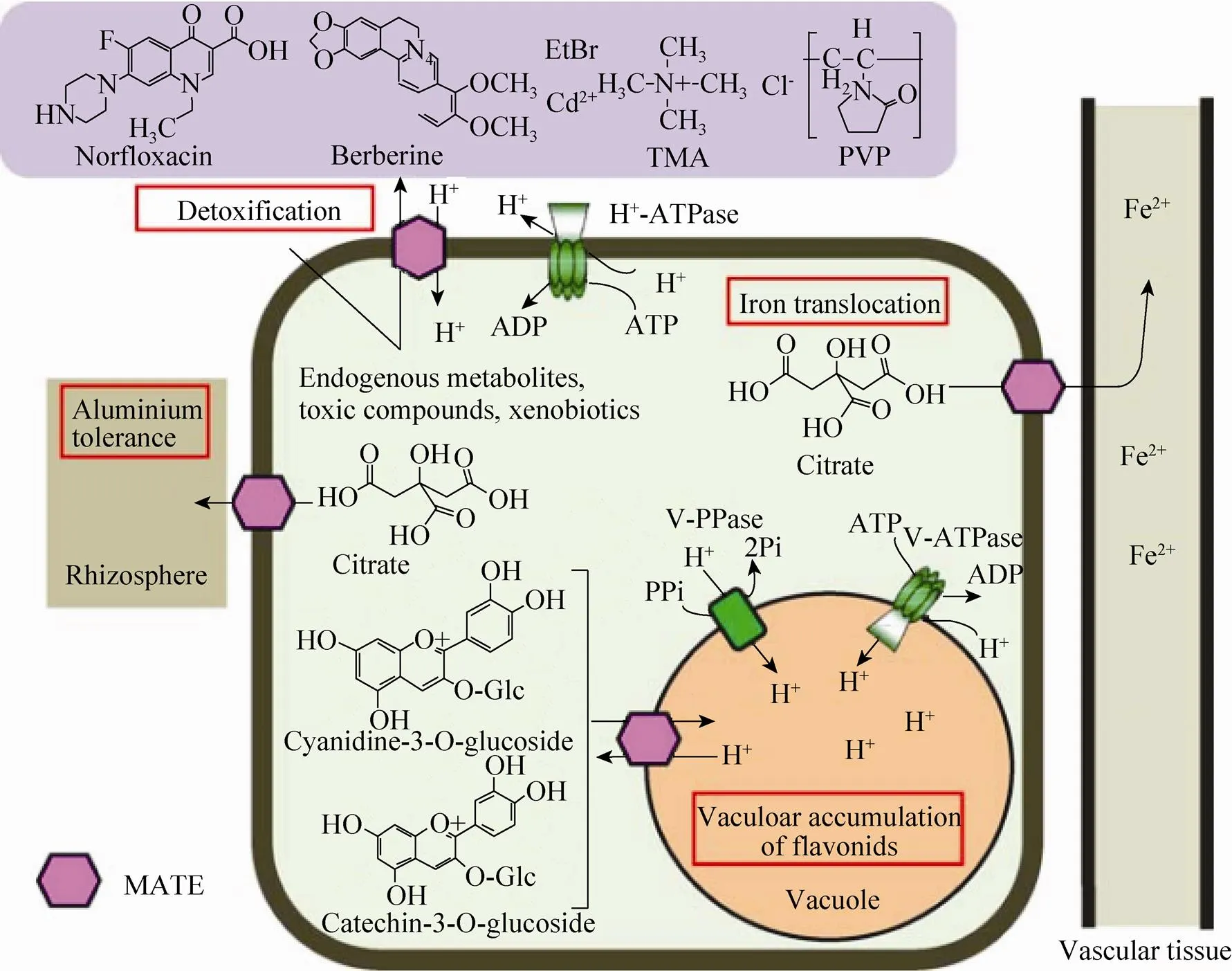
图4 植物体内MATE转运体的生理功能和推断的模型[50]
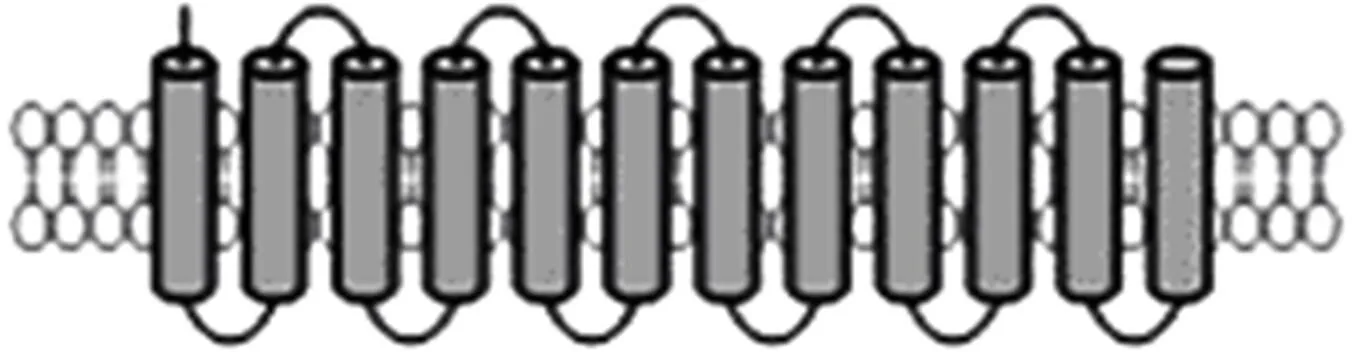
图5 MATE转运蛋白的二级结构[47]

表3 不同植物中与花青素苷转运有关的MATE家族成员信息
1.3 囊泡介导的花青素苷的转运
还有一种花青素苷的转运机制是由囊泡介导的花青素苷的转运。研究表明,花青素苷在内质网合成以后,首先在细胞质聚集成有膜包裹的泡状体 (Anthocyanoplast, ACPs),ACPs被包含在前液泡组成体 (Prevacuolar compartments, PVCs) 中。通过PVCs和中央大液泡的移动,ACPs被运输至中央大液泡。接着ACPs破裂,花青素苷在液泡中排列成条状,最后形成具有不规则形状的、动态的、无膜包裹的花青素苷液泡内涵体 (Anthocyanic vacuolar inclusions, AVIs)。除此之外,ACPs还可以被蛋白质储存泡 (Protein storage vacuoles, PSVs) 包裹并随其移动被运输至中央大液泡。花青素苷还可通过高尔基体的囊泡运输网络被转运至液泡。3种囊泡转运途径均相互独立(图6)。对此转运机制的研究大多基于显微镜观测。
这些不同的区室是怎么起始?基因、蛋白质和植物化学物质如何调控此转运机制?这些尚不清楚,还需要进一步的研究给予解答。
1.3.1 AVIs
液泡中的花青素苷聚集于大小不一的AVIs中。AVIs主要存在于花瓣的表皮细胞中,其在花青素苷的积累而不是转运中发挥重要作用。虽然AVIs包含膜脂类及能同花青素苷结合的蛋白质,但AVIs是无膜包裹的、动态的结构。其内部非常浓缩,外部则相对松散。研究表明,随着液泡的成熟,AVIs的数量变少、体积增大。在甘薯细胞的悬浮培养中,大量小体积的AVIs逐渐融合形成体积较大的AVIs。
已在甘薯、鼠尾草、拟南芥、金鱼草、石竹、桔梗、飞燕草、康乃馨、葡萄、玉米等植物中观察到了AVIs。对蓝灰色康乃馨和紫色龙胆中AVIs的研究表明,AVIs可以增深花朵颜色及产生蓝移,其存在还能提高花青素苷的含量。蓝移的花色表型在康乃馨中表现的尤为奇特,原本为粉色的天竺葵素却产生了一种蓝灰色的表型。对蓝灰色康乃馨花瓣表皮细胞的镜检发现,每个细胞液泡中只有1个深红色的AVI,而在液泡的其他地方几乎没有色素。此外,研究表明,康乃馨花瓣细胞液泡中的AVIs可以优先聚集糖基化和酰基化的花青素苷。在悬浮培养的葡萄细胞中,AVIs选择性地优先聚集酰基化的花青素 苷。在诱导产生大量花青素苷的拟南芥植株中也发现了类似AVIs的结构。拟南芥中,AVIs的形成与矢车菊3–葡萄糖苷及其衍生物有密切关系。在拟南芥花青素苷形成中缺少5-0位糖基化突变体中发现,几乎每个子叶表皮细胞中都有AVIs的积累,而在普通的野生型幼苗中只有一小部分细胞中有AVIs。自我吞噬过程缺失的拟南芥突变体中,AVIs的含量很少,花青素的积累也减少了,表明花青素苷从细胞质进入到液泡中可能与自噬小体的吞噬作用有关。
1.3.2 VP24介导的花青素苷在液泡中的积累
VP24 (24-kDa vacuolar protein) 是一种由893个氨基酸组成的前体蛋白,其位于AVIs中,C-末端前肽包含8个跨膜区,含有多重跨膜结构域。成熟VP24可能在含有大量花青素苷的液泡中参与AVIs的形成,通过与花青素苷的相互作用参与蓝色颗粒的形成及大量转运至液泡的花青素苷的积累,但其C-末端区域的生物学功能迄今仍是未知。
在甘薯的AVIs中分离出了一个光诱导的金属蛋白酶VP24,参加液泡中花青素苷的转运和汇集。光诱导3个不同甘薯细胞系的的表达,通过免疫印迹法分析发现,它们分别以不同的速率产生花青素苷,无VP24的细胞系的液泡不产生花青素苷,说明光诱导的表达与花青素苷的积累密切相关。在体外,VP24可以很容易与花青素苷结合。
目前,大多数研究者认为GST及MRP介导的花青素苷转运、MATE介导的花青素苷跨膜转运和囊泡介导的花青素苷转运是植物体内最主要的三种花青素苷转运方式(图7)。
1.4 BTL-homologue介导的花青素苷的转运
有研究表明,在康乃馨的花瓣中发现了一种定位于液泡膜、同源于哺乳动物的胆红素易位酶同族体 (Bilitranslocase-homologue, BTL- homologue) 可能与花青素苷的跨膜转运有关。胆红素易位酶是一类可以转运血红素降解产物 (胆红素) 和花青素苷的蛋白质。在葡萄中,胆红素易位酶同族体可能与花青素苷转运有关 (图8)。可能的花青素苷转运机制是BTL-homologue与吸收四溴酚酞磺酸钠 (Bromosulfalein, BSP) 的产电过程有关,与抗体一起对一段BTL序列呈现出交叉反应性。但有关BTL-homologue介导的花青素苷转运的信息还很少,需要对其进一步研究。
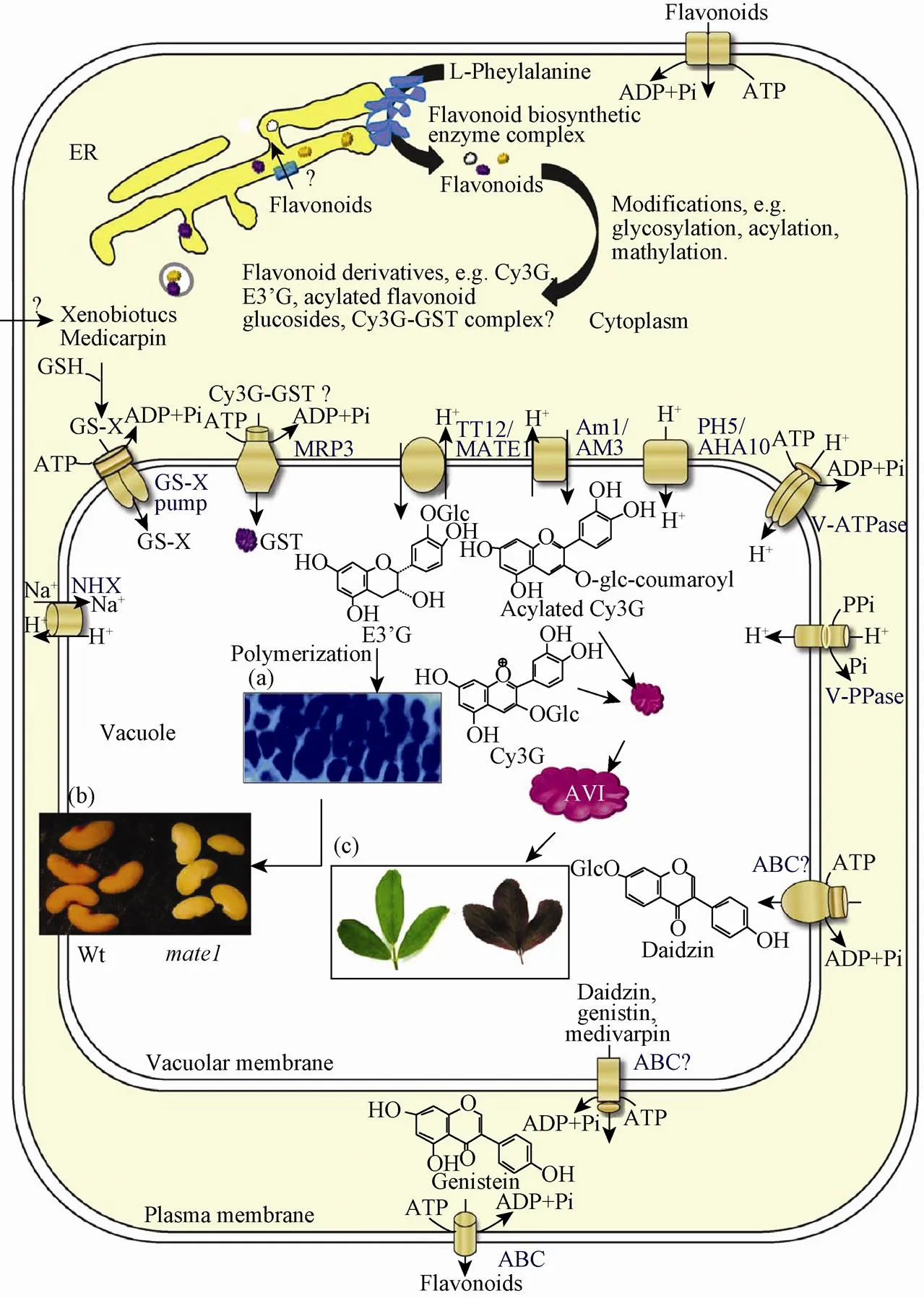
图7 花青素苷转运模型[13]

图8 葡萄中推测可能的类黄酮转运机制模型[65]
综合近年来的研究进展,我们推测了几种可能的花青素苷转运机制:1) GST催化GSH和花青素苷结合或GST充当运输载体将花青素苷从内质网运输至液泡膜,位于液泡膜上的MRP类转运蛋白识别花青素苷并将其跨膜转运至液泡;2) 液泡膜上的MATE转运蛋白将花青素苷跨膜转运到液泡中;3) 囊泡直接介导花青素苷的转运;4) 液泡膜上的BTL-homologue介导花青素苷的跨膜转运。这几种花青素苷转运机制可能共同存在并同时发生作用。实验证明,结构基因及转录因子调控花青素合成量,而转运蛋白则对花青素苷的积累起着非常重要的作用,单个转运蛋白基因缺失会导致花青素和原花青素缺陷,并伴随着中央液泡的功能紊乱。
2 小结与展望
近十多年来,有关花青素苷生物合成的结构基因和调节基因在分子结构和基因表达方面的研究取得了很大的进步。尤其是合成途径末期步骤中如ANS、修饰酶、转运体、液泡沉积与CHS、CHI、ANS三维结构方面的研究给阐明花青素苷等类黄酮次生代谢物的生物合成提供了新的信息。然而,花青素合成后的修饰、转运、汇集及转录因子的相互作用机制等方面的研究尚处于起步阶段。就花青素苷转运来说,到目前为止,仍不可能总结出所有花青素苷的转运机制。目前我们对花青素苷转运的了解仅仅关于花青素苷被转运至液泡的过程,对花青素苷如何流出液泡,进出细胞,被转运至细胞核、叶绿体、亚细胞区室却了解较少,但这些转运过程可能对植物生长、发育、繁殖及抗逆都有重要的作用。只有我们了解更多介导次生代谢物流出液泡的转运体,才能知道细胞调控花青素苷进出液泡的机制。对此一个可能的模型是在特定的细胞区室中代谢物积累到一定水平后能激活某个信号转导途径,继而调控特定转运基因的表达。很多编码转运体的基因,如ABC转运体就受到很多信号的调控。
虽然关于花青素苷转运还存在很多疑问,但基因组学的快速发展为更加快速地研究提供了希望。新的信息学手段加快了转运体的功能预测。能激活整个类黄酮合成和转运通路的转录因子,又能为候选基因的发掘提供有力工具。相信随着生物化学、细胞生物学、分子生物学、蛋白质组学的发展,转录因子的进一步分离、鉴定,突变体资源以及基因工程技术应用,将进一步阐明花青素合成、转运、沉积的调控网络,有效地调控植物中花青素苷合成工作的开展,实现改良植物遗传性状的目标。研究花青素苷的转运机制不仅对次生代谢产物转运机制的理论研究有一定积极意义,还能帮助理解和描绘花青素苷从合成到积累完整的代谢通路,此外还有利于类黄酮化合物代谢工程学的研究,达到提升作物农学特性及食物营养品质的目的。
REFERENCES
[1] Xu QY, Dai SL. Blue flowers’ molecular breeding. Molecular Plant Breeding, 2004, 2(1): 93–99 (in Chinese).徐清燏, 戴思兰. 蓝色花的分子育种. 分子植物育种, 2004, 2(1): 93–99.
[2] Tanaka Y, Sasaki N, Ohmiya A. Biosynthesis of plant pigments: anthocyanins, betalains and carotenoids. Plant J, 2008, 54(4): 733–749.
[3] Hu K, Han KT, Dai SL. Regulation of plant anthocyanin synthesis and pigmentation by environmental factors. J Integr Plant Biol, 2010, 45(3): 307–317 (in Chinese).胡可, 韩科厅, 戴思兰. 环境因子调控植物花青素苷合成及呈色的机理. 植物学报, 2010, 45(3): 307–317.
[4] Han KT, Zhao L, Tang XJ, et al. The relationship between the expression of key genes in anthocyanin biosynthesis and the color of chrysanthemum. Acta Hortic Sin, 2012, 39(3): 516–524 (in Chinese).韩科厅, 赵莉, 唐杏娇, 等. 菊花花青素苷合成关键基因表达与花色表型的关系. 园艺学报, 2012, 39(3): 516–524.
[5] You Q, Wang B, Chen F, et al. Comparison of anthocyanins and phenolics in organically and conventionally grown blueberries in selected cultivars. Food Chem, 2011, 125(1): 201–208.
[6] Ge CL, Huang CH, Xu XB. Research on anthocyanins biosynthesis in fruit. Acta Hortic Sin, 2012, 39(9): 1655–1664 (in Chinese).葛翠莲, 黄春辉, 徐小彪. 果实花青素生物合成研究进展. 园艺学报, 2012, 39(9): 1655–1664.
[7] Weiss MR. Floral color change: a widespread functional convergence. Am J Bot, 1995: 167–185.
[8] Han KT, Hu K, Dai SL. Flower color breeding by molecular design in ornamentals. Molecular Plant Breeding, 2008, 6(1): 16–24 (in Chinese).韩科厅, 胡可, 戴思兰. 观赏植物花色的分子设计. 分子植物育种, 2008, 6(1): 16–24.
[9] Hu K, Meng L, Han KT, et al. Isolation and expression analysis of key genes involved in anthocyanin biosynthesis of Cineraria. Acta Hortic Sin, 2009, 36(7): 1013–1022 (in Chinese).胡可, 孟丽, 韩科厅, 等.瓜叶菊花青素合成关键结构基因的分离及表达分析. 园艺学报, 2009, 36(7): 1013–1022.
[10] Grotewold E. The genetics and biochemistry of floral pigments. Annu Rev Plant Biol, 2006, 57: 761–780.
[11] Katsumoto Y, Fukuchi-Mizutani M, Fukui Y, et al. Engineering of the rose flavonoid biosynthetic pathway successfully generated blue-hued flowers accumulating delphinidin. Plant Cell Physiol, 2007, 48(11): 1589–1600.
[12] Koes R, Verweij W, Quattrocchio F. Flavonoids: a colorful model for the regulation and evolution of biochemical pathways. Trends Plant Sci, 2005, 10(5): 236–242.
[13] Zhao J, Dixon RA. The ‘ins’ and ‘outs’ of flavonoid transport. Trends Plant Sci, 2010, 15(2): 72–80.
[14] Winkel-Shirley B. Evidence for enzyme complexes in the phenylpropanoid and flavonoid pathways. Physiol Plantarum, 1999, 107(1): 142–149.
[15] Grotewold E. The challenges of moving chemicals within and out of cells: insights into the transport of plant natural products. Planta, 2004, 219(5): 906–909.
[16] Hrazdina G. Compartmentation in aromatic metabolism//Phenolic Metabolism in Plants. New York: Plenum Press, 1992: 1–23.
[17] Ibrahim RK. Immunolocalization of flavonoid conjugates and their enzymes//Phenolic Metabolism in Plants. New York: Plenum Press, 1992: 25–61.
[18] Marrs KA, Alfenito MR, Lloyd AM, et al. A glutathione-transferase involved in vacuolar transfer encoded by the maize gene. Nature, 1995, 395: 397–400.
[19] Klein M, Weissenböck G, Dufaud A, et al. Different energization mechanisms drive the vacuolar uptake of a flavonoid glucoside and a herbicide glucoside. J Biol Chem, 1996, 271(47): 29666–29671.
[20] Li ZS, Alfenito M, Rea PA, et al. Vacuolar uptake of the phytoalexin medicarpin by the glutathione conjugate pump. Phytochemistry, 1997, 45(4): 689–693.
[21] Grotewold E, Chamberlin M, Snook M, et al. Engineering secondary metabolism in maize cells by ectopic expression of transcription factors. Plant Cell, 1998, 10(5): 721–740.
[22] Zhao J, Dixon RA. MATE transporters facilitate vacuolar uptake of epicatechin 3′--glucoside for proanthocyanidin biosynthesis inand. Plant Cell, 2009, 21(8): 2323–2340.
[23] Pourcel L, Irani NG, Lu Y, et al. The formation of anthocyanic vacuolar inclusions inand implications for the sequestration of anthocyanin pigments. Mol Plant, 2010, 3(1): 78–90.
[24] Mueller LA, Goodman CD, Silady RA, et al. AN9, a petunia glutathione-transferase required for anthocyanin sequestration, is a flavonoid-binding protein. Plant Physiol, 2000, 123(4): 1561–1570.
[25] Goodman CD, Casati P, Walbot V. A multidrug resistance–associated protein involved in anthocyanin transport in. Plant Cell, 2004, 16(7): 1812–1826.
[26] Wagner U, Edwards R, Dixon DP, et al. Probing the diversity of the Arabidopsis glutathione-transferase gene family. Plant Mol Biol, 2002, 49(5): 515–532.
[27] Kitamura S, Shikazono N, Tanaka A.is involved in the accumulation of both anthocyanins and proanthocyanidins in. Plant J, 2004, 37(1): 104–114.
[28] Alfenito MR, Souer E, Goodman CD, et al. Functional complementation of anthocyanin sequestration in the vacuole by widely divergent glutathione-transferases. Plant Cell, 1998, 10(7): 1135–1149.
[29] Zhao J, Huhman D, Shadle G, et al. MATE2 mediates vacuolar sequestration of flavonoid glycosides and glycoside malonates in. Plant Cell, 2011, 23(4): 1536–1555.
[30] Sun Y, Li H, Huang JR.TT19 functions as a carrier to transport anthocyanin from the cytosol to tonoplasts. Mol Plant, 2012, 5(2): 387–400.
[31] Yamazaki M, Shibata M, Nishiyama Y, et al. Differential gene expression profiles of red and green forms ofleading to comprehensive identification of anthocyanin biosynthetic genes. FEBS J, 2008, 275(13): 3494–3502.
[32] Conn S, Curtin C, Bézier A, et al. Purification, molecular cloning, and characterization of glutathione-transferases (GSTs) from pigmentedL. cell suspension cultures as putative anthocyanin transport proteins. J Exp Bot, 2008, 59(13): 3621–3634.
[33] Gomez C, Conejero G, Torregrosa L, et al. In vivo grapevine anthocyanin transport involves vesicle-mediated trafficking and the contribution of anthoMATE transporters and GST. Plant J, 2011, 67(6): 960–970.
[34] Kitamura S, Akita Y, Ishizaka H, et al. Molecular characterization of an anthocyanin-related glutathione--transferase gene in cyclamen. J Plant Physiol, 2012, 169(6): 636–642.
[35] Sasaki N, Nishizaki Y, Uchida Y, et al. Identification of thegene responsible for flower color intensity in carnations. Plant Biotechnol, 2012, 29: 223–227.
[36] Jin XH, Hong Y, Huang H, et al. Isolation and expression analysis ofgene encoding glutathione-transferase from. Acta Hortic Sin, 2013, 40(6): 1129–1138 (in Chinese).金雪花, 洪艳, 黄河, 等. 瓜叶菊谷胱甘肽转移酶基因的分离及表达分析. 园艺学报, 2013, 40(6): 1129–1138.
[37] Rea PA. MRP subfamily ABC transporters from plants and yeast. J Exp Bot, 1999, 50(Special Issue): 895–913.
[38] Theodoulou FL. Plant ABC transporters. BBA-Biomembranes, 2000, 1465(1): 79–103.
[39] Yazaki K. Transporters of secondary metabolites. Curr Opin Plant Biol, 2005, 8(3): 301–307.
[40] Jin HB, Liu DH, Zuo KJ, et al. Plant ABC transporters and their roles in the transmembrane transport of secondary metabolites. J Agric Sci Technol, 2007, 9(3): 32–37 (in Chinese).金宏滨, 刘东辉, 左开井, 等. 植物ABC转运蛋白与次生代谢产物的跨膜转运. 中国农业科技导报, 2007, 9(3): 32–37.
[41] Lu YP, Li ZS, Drozdowicz YM, et al. AtMRP2, an Arabidopsis ATP binding cassette transporter able to transport glutathione-conjugates and chlorophyll catabolites: functional comparisons with AtMRP1. Plant Cell, 1998, 10(2): 267–282.
[42] Lu YP, Li ZS, Rea PA.gene ofencodes a glutathione-conjugate pump: isolation and functional definition of a plant ATP-binding cassette transporter gene. Proc Natl Acad Sci USA, 1997, 94(15): 8243–8248.
[43] Zhu QL, Xie XR, Zhang J, et al.analysis of a MRP transporter gene reveals its possible role in anthocyanins or flavonoids transport in. AJPS, 2013, 4: 555–560.
[44] Francisco RM, Regalado A, Ageorges A, et al. ABCC1, an ATP binding cassette protein from grape berry, transports anthocyanidin 3--glucosides. Plant Cell, 2013, 25(5): 1840–1854.
[45] Schulz B, Kolukisaoglu HÜ. Genomics of plant ABC transporters: the alphabet of photosynthetic life forms or just holes in membranes? FEBS Lett, 2006, 580(4): 1010–1016.
[46] Verrier PJ, Bird D, Burla B, et al. Plant ABC proteins–a unified nomenclature and updated inventory. Trends Plant Sci, 2008, 13(4): 151–159.
[47] Xie XD, Cheng TC, Wang GH, et al.ABC and MATE transporters of plant and their roles in membrane transport of secondary metabolites. Plant Physiol J, 2011, 47(8): 752–758 (in Chinese).谢小东, 程廷才, 王根洪, 等. 植物ABC和MATE转运蛋白与次生代谢物跨膜转运. 植物生理学报, 2011, 47(8): 752–758.
[48] Debeaujon I, Peeters AJM, Léon-Kloosterziel KM, et al. Thegene of Arabidopsis encodes a multidrug secondary transporter-like protein required for flavonoid sequestration in vacuoles of the seed coat endothelium. Plant Cell, 2001, 13(4): 853–871.
[49] Marinova K, Kleinschmidt K, Weissenböck G, et al. Flavonoid biosynthesis in barley primary leaves requires the presence of the vacuole and controls the activity of vacuolar flavonoid transport. Plant Physiol, 2007, 144(1): 432–444.
[50] Yazaki K, Sugiyama A, Morita M, et al. Secondary transport as an efficient membrane transport mechanism for plant secondary metabolites. Phytochem Rev, 2008, 7(3): 513–524.
[51] Gomez C, Terrier N, Torregrosa L, et al. Grapevine MATE-type proteins act as vacuolar H-dependent acylated anthocyanin transporters. Plant Physiol, 2009, 150(1): 402–415.
[52] Gaxiola RA, Fink GR, Hirschi KD. Genetic manipulation of vacuolar proton pumps and transporters. Plant Physiol, 2002, 129(3): 967–973.
[53] Verweij W, Spelt C, Di Sansebastiano GP, et al. An HP-ATPase on the tonoplast determines vacuolar pH and flower colour. Nat Cell Biol, 2008, 10(12): 1456–1462.
[54] Zhang H, Wang L, Deroles S, et al. New insight into the structures and formation of anthocyanic vacuolar inclusions in flower petals. BMC Plant Biol, 2006, 6(1): 29.
[55] Irani NG, Grotewold E. Light-induced morphological alteration in anthocyanin-accumulating vacuoles of maize cells. BMC Plant Biol, 2005, 5(1): 7.
[56] Markham KR, Gould KS, Winefield CS, et al. Anthocyanic vacuolar inclusions—their nature and significance in flower colouration. Phytochemistry, 2000, 55(4): 327–336.
[57] Conn S, Zhang W, Franco C. Anthocyanic vacuolar inclusions (AVIs) selectively bind acylated anthocyanins inL. (grapevine) suspension culture. Biotechnol Lett, 2003, 25(11): 835–839.
[58] Wu J, Cheng JW, Yang FC. Transcriptional regulation of anthocyanin biosynthesis in plants. Chinese Journal of Cell Biology, 2006, 28: 453–456 (in Chinese).吴江, 程建徽, 杨夫臣. 植物花色素苷生物合成的转录调控. 中国细胞生物学学报, 2006, 28: 453–456.
[59] Nozue M, Yamada K, Nakamura T, et al. Expression of a vacuolar protein (VP24) in anthocyanin-producing cells of sweet potato in suspension culture. Plant Physiol, 1997, 115(3): 1065–1072.
[60] Xu W, Moriya K, Yamada K, et al. Detection and characterization of a 36-kDa peptide in C-terminal region of a 24-kDa vacuolar protein (VP24) precursor in anthocyanin-producing sweet potato cells in suspension culture. Plant Sci, 2000, 160(1): 121–128.
[61] Nozue M, Baba S, Kitamura Y, et al. VP24 found in anthocyanic vacuolar inclusions (AVIs) of sweet potato cells is a member of a metalloprotease family. Biochem Eng J, 2003, 14(3): 199–205.
[62] Xu W, Shioiri H, Kojima M, et al. Primary structure and expression of a 24-kD vacuolar protein (VP24) precursor in anthocyanin-producing cells of sweet potato in suspension culture. Plant Physiol, 2001, 125(1): 447–455.
[63] Passamonti S, Cocolo A, Braidot E, et al. Characterization of electrogenic bromosulfophthalein transport in carnation petal microsomes and its inhibition by antibodies against bilitranslocase. FEBS J, 2005, 272(13): 3282–3296.
[64] Passamonti S, Vrhovsek U, Mattivi F. The interaction of anthocyanins with bilitranslocase. Biochem Bioph Res Co, 2002, 296(3): 631–636.
[65] Braidot E, Zancani M, Petrussa E, et al. Transport and accumulation of flavonoids in grapevine (L.). Plant Signal Behav, 2008, 3(9): 626–632.
[66] Naoumkina M, Farag MA, Sumner LW, et al. Different mechanisms for phytoalexin induction by pathogen and wound signals in. Proc Natl Acad Sci USA, 2007, 104(46): 17909–17915.
[67] Stein M, Dittgen J, Sánchez-Rodríguez C, et al.PEN3/PDR8, an ATP binding cassette transporter, contributes to nonhost resistance to inappropriate pathogens that enter by direct penetration. Plant Cell, 2006, 18(3): 731–746.
[68] Jasinski M, Ducos E, Martinoia E, et al. The ATP-binding cassette transporters: structure, function, and gene family comparison between rice and. Plant Physiol, 2003, 131(3): 1169–1177.
(本文责编 陈宏宇)
Advances in plant anthocyanin transport mechanism
Lu Wang, Silan Dai, Xuehua Jin, He Huang, and Yan Hong
1 College of Landscape Architecture, Beijing Forestry University, Beijing 100083, China 2 Faculty of Modern Agricultural Engineering, Kunming University of Science and Technology, Kunming 650500, Yunnan, China
Anthocyanin biosynthesis is one of the thoroughly studied enzymatic pathways in biology, but little is known about the molecular mechanisms of its final stage: the transport of the anthocyanins into the vacuole. A clear picture of the dynamic trafficking of flavonoids is only now beginning to emerge. So far four different models have been proposed to explain the transport of anthocyanins from biosynthetic sites to the central vacuole, and four types of transporters have been found associated with the transport of anthocyanins: glutathione S-transferase, multidrug resistance-associated protein, multidrug and toxic compound extrusion, bilitranslocase-homologue. The functions of these proteins and related genes have also been studied. Although different models have been proposed, cellular and subcellular information is still lacking for reconciliation of different lines of evidence in various anthocyanin sequestration studies. According to the information available, through sequence analysis, gene expression analysis, subcellular positioning and complementation experiments, the function and location of these transporters can be explored, and the anthocyanin transport mechanism can be better understood.
anthocyanin, transport, transporter, membrane transport, vacuolar accumulation, glutathione-transferase, multidrug resistance- associated protein, multidrug and toxic compound extrusion
October 9, 2013; Accepted:December 10, 2013
National Natural Science Fundation of China (No.31071823).
Silan Dai. Tel:+86-82371556-8023; E-mail: silandai@sina.com
国家自然科学基金(No. 31071823) 资助。
网络出版时间:2014-02-24
http://www.cnki.net/kcms/doi/10.13345/j.cjb.130515.html
