拜氏梭菌Clostridium beijerinckii NCIMB 8052发酵玉米皮生产丁醇
2014-09-15沈兆兵刘晓洁史吉平
沈兆兵, 刘晓洁, 刘 莉, 史吉平
1.中国科学院上海高等研究院, 上海 201210;
2.车用生物燃料技术国家重点实验室, 河南 南阳 473000;
3.中国科学院大学, 北京 100049
丁醇是一种重要的C4平台化合物,主要用于邻苯二甲酸正丁酯、磷酸丁酯、丙烯酸丁酯及醋酸丁酯等的合成,还可用作油脂、医药和香料的提取溶剂以及醇酸树脂的添加剂等。随着生物质能源的多元化发展,近年来的研究表明,丁醇也是一种优质燃料和燃料添加剂。其高沸点(118℃)和低蒸汽压有助于汽车的冷启动;由于丁醇的疏水性比乙醇更强,因此更易于与汽、柴油烃类燃料相混溶;而丁醇的完全燃烧性,可大大降低尾气的CO2排放,且不发生残留烃污染,对净化空气十分有利。上述优点可使丁醇成为未来发动机新型绿色燃料,替代矿化燃料的新型液体燃料之一[1]。2007年上半年,杜邦公司和BP公司宣布联手开发新一代生物燃料——丁醇,这预示着丁醇在未来的运输燃料结构中将会占有重要的比重。
在二战时期,丙酮-丁醇-乙醇(acetone-butanol-ethanol,以下简称ABE)主要是利用粮食发酵生产,所用原料主要是玉米、糖蜜以及玉米和高粱、红薯等的混合物。所用菌种主要是产溶剂梭菌,按ABE产品比例不同分为3∶6∶1传统梭菌和2∶7∶1高丁醇比梭菌,所得溶剂总量约20 g/L[2]。发酵法生产丁醇一直持续到20世纪80年代末90年代初,此后因受到石油制品的竞争挤压和发酵原料农副产品价格上升因素的影响,发酵法制造丁醇技术逐步退出商业性生产。但石油毕竟是一种矿化原料,不可再生且矿藏量有限,后石油时代迟早会到来。21世纪全球面临的难题之一,是如何解决石油的短缺,据2003年预测,按照目前已探明的世界石油储量和开采速度,全球石油的平稳供应只能维持40年左右。尽管各界对石油枯竭的预测数字一直存有争议,全球石油资源正在日趋减少则是不争的事实。随着石油价格的不断上涨及其对经济发展的冲击,加快生物质能源和不依赖石油基化学品生产方法的研究开发已成为日益紧迫的课题。因此,发酵法生产丁醇技术作为一种重要的技术储备重新引起了广泛的关注[3]。
以粮食为底物的丁醇发酵面临的最大问题是较高的粮食价格致使原料成本占ABE生产总成本的比例偏高(约60%),这不仅限制了丁醇产品的市场竞争力,也有悖于我国的粮食安全战略。因此国家发改委已于2007年底暂停了利用粮食生产生物能源项目的备案及核准,鼓励发展非粮生物质能源。因此,以廉价的生物质资源作为发酵原料生产丁醇是今后发展的必然趋势[4]。
玉米皮是玉米淀粉加工的副产物,产量一般占玉米总量的14%~20%。含有10%~20%的淀粉、30%~50%的半纤维素、10%~20%的纤维素以及少量的蛋白质,几乎不含木质素[5]。目前我国玉米皮利用率较低,只有部分应用于饲料行业,附加值比较低,造成了资源的极度浪费。从组分含量可以看出玉米皮是一种优质的可用于生产丁醇的廉价生物质资源[6]。
本文研究了以玉米皮为原料,经过稀酸预处理、酶解和发酵等步骤,充分利用其中的淀粉和半纤维素水解生成的葡萄糖、木糖和阿拉伯糖的混合糖作为碳源,厌氧发酵生产丁醇,有效减少了丁醇发酵对淀粉类粮食原料的依赖,同时也降低了原料成本[7]。剩余的纤维素还可用来制备附加值更高的膳食纤维产品,这样既充分利用了玉米皮原料组分,又降低了丁醇生产的原料成本,为丁醇的发酵生产提供一个新的途径。
1 材料与方法
1.1菌种
本实验所用的拜氏梭菌ClostridiumbeijerinckiiNCIMB8052,购于美国菌种保藏中心。
1.2实验原料
玉米皮购于河南天冠企业集团有限公司;淀粉酶和半纤维素酶购于白银赛诺生物科技有限公司;其他化学试剂购于国药集团化学试剂有限公司。
1.3培养基
TYA种子培养基:葡萄糖40 g/L,酵母粉2 g/L,蛋白胨6 g/L,牛肉粉2 g/L,NH4AC 3 g/L,MgSO4·7H2O 2 g/L,K2HPO40.5 g/L,FeSO4·7H2O 0.01 g/L,115℃灭菌15 min[15]。
水解液发酵培养基:脱毒后的水解液调节pH 6.8,115℃灭菌15 min。
1.4实验方法
1.4.1玉米皮预处理 将玉米皮与不同浓度的稀硫酸溶液按照固液比1∶8均匀混合,放入不锈钢预处理管式反应器中,密封。将反应器放入设定好温度的油浴锅中,控制油浴温度为120~160℃,反应时间为20 min。反应结束后,立刻从油浴中取出反应器置于冷水中冷却以终止反应[13]。
1.4.2酶解 将预处理料液转入三角瓶中,调节pH 5.0,加入一定量的糖化酶和木聚糖酶,50℃摇床150 r/min酶解48 h,固液分离,滤液用于水解液脱毒[14]。同时取滤液过0.22 μm膜,HPLC检测液体中水解产生的可发酵糖的浓度。
1.4.3水解液脱毒 酶解液固液分离后的滤液加一定量的活性炭,50℃摇床150 r/min脱毒2 h。固液分离,液体用于配制丁醇发酵培养基。
1.4.4丁醇发酵 将0.5 mL冷冻保藏的菌种接种于含有10 mL TYA种子培养基的试管中,沸水浴中热激1 min,迅速放入冷水中使之冷却,37℃恒温培养箱中静置培养24 h,得到一级种子。然后按10%的接种量将一级种子转入含有40 mL种子培养基的100 mL三角瓶中,37℃恒温培养箱中静置培养24 h用于发酵接种[15]。将活化好的菌种按体积比5%的接种量接种于250 mL发酵培养基中,于37℃静置培养,自然pH[15]。
1.5分析方法
1.5.1玉米皮组分测定 玉米皮中葡聚糖、木聚糖、阿拉伯聚糖和木质素的测定方法参考NREL LAP[8];淀粉的测定采用酸水解法[9];蛋白质的测定采用凯氏定氮法[10];灰分的测定参考NREL LAP[11];脂肪的测定采用索氏提取法[12]。
1.5.2发酵液溶剂的测定 取不同时间的发酵液1 mL,10 000 r/min离心5 min,上清液用气相色谱仪(Shimadzu,GC-2010 Plus)测定发酵溶剂丙酮、丁醇和乙醇的含量。色谱条件为:毛细管色谱柱InertCap Pure Wax(30 m×0.25 mm×0.25 μm);程序升温:50℃保持3.8 min,以20℃/min升至220℃,保持3 min;进样口温度200℃,FID检测器温度230℃;载气N2流量1 mL/min,H2流量40 mL/min;空气流量400 mL/min;进样量0.5 μL,分流比50∶1。采用内标法定量,内标为异丁醇[16]。
1.5.3发酵液残糖的测定 取不同时间的发酵液1 mL,10 000 r/min离心5 min,上清液用0.22 μm的膜过滤,液相色谱仪(Shimadzu,LC-20A)测定发酵液中残留的葡萄糖、木糖、阿拉伯糖和纤维二糖含量。色谱条件为:色谱柱Bio-Rad Aminex HPX-87H(300 mm×7.8 mm),柱温65℃,流动相0.005 mol/L H2SO4,流速0.8 mL/min,检测器为RID,进样量20 μL。采用外标法定量[17]。
2 结果与分析
2.1玉米皮组分分析
玉米皮原料的全组分分析结果见表1,从数据中可以看出,玉米加工副产物玉米皮中可用于丁醇发酵碳源的组分有四类,按照可利用程度由易到难排序为:淀粉<木聚糖=阿拉伯聚糖<纤维素。以玉米皮为原料发酵丁醇有三种方案:①利用淀粉酶分泌能力较强的丙酮丁醇梭菌(Clostridiumacetobutylicum)以淀粉为碳源,直接发酵生产丁醇。但由于玉米皮中淀粉含量仅为15.8%,直接发酵时终产物产量低,后期溶剂提取蒸馏成本太高;②对玉米皮进行部分水解预处理,使其中较容易降解的淀粉和半纤维素(即木聚糖和阿拉伯聚糖)转化成单糖,利用拜氏梭菌(Clostridiumbeijerinckii)以水解产生的单糖为碳源发酵丁醇,初始单糖浓度约45~55 g/L,正好与拜氏梭菌最适初糖浓度50 g/L相一致;③对玉米皮进行完全水解预处理,使其中的淀粉、纤维素和半纤维素全部水解转化成单糖,利用拜氏梭菌以水解产生的单糖为碳源发酵丁醇,该方案一方面由于预处理强度大,会产生更多的发酵抑制物,导致菌株不能正常发酵,另一方面水解产生的单糖浓度约60~90 g/L,底物浓度过高不仅造成糖资源浪费,而且还存在底物抑制。因此,本文采用方案②对玉米皮进行发酵研究,值得一提的是,玉米皮组分中还含有11.5%的蛋白质,其在预处理阶段可部分降解提供菌体发酵所需氮源。经过预处理和酶解两步操作之后原料中的淀粉、木聚糖、阿拉伯聚糖和蛋白质基本已被除去,剩余的玉米皮残渣主要是纤维素,由于原料中木质素(3.1%)和灰分(1.0%)含量极低,因此剩余残渣是较好的膳食纤维来源。

表1 玉米皮组分分析
2.2稀酸预处理对总糖得率的影响
由于玉米皮具有复杂的超分子结构和抗降解屏障特性,必须经过预处理才能够使其中的半纤维素和淀粉降解为可发酵糖。本研究采用预处理的目的是使淀粉液化,半纤维素部分降解,玉米皮原料结构变疏松,使得后续木聚糖酶与底物能够充分接触。影响预处理效果的因素有温度、酸浓度、时间和固液比等,通常温度和酸浓度是较为重要的两个因素,因此本实验在固液比1∶8,处理时间20 min条件下,分别考查了温度120℃~160℃和稀硫酸浓度0.1%~0.9%预处理对酶解所得总糖的影响。本研究固定酶解条件为:糖化酶1.0 IU/g底物,木聚糖酶200 IU/g底物。
随着预处理温度从120℃升高至160℃,酶解后的总糖得率呈现先升高后降低的趋势,结果见图1。当温度为140℃时,总糖浓度达到最大值50.46 g/L。低于140℃时由于预处理强度较低,总糖得率不能达到丁醇发酵初糖的要求。而当温度高于140℃时,部分已降解的单糖在高温条件下会进一步发生脱水反应生成糠醛和羟甲基糠醛等发酵抑制物,影响后续发酵的正常进行,因此,预处理不宜选择较高的温度,140℃为最优条件。
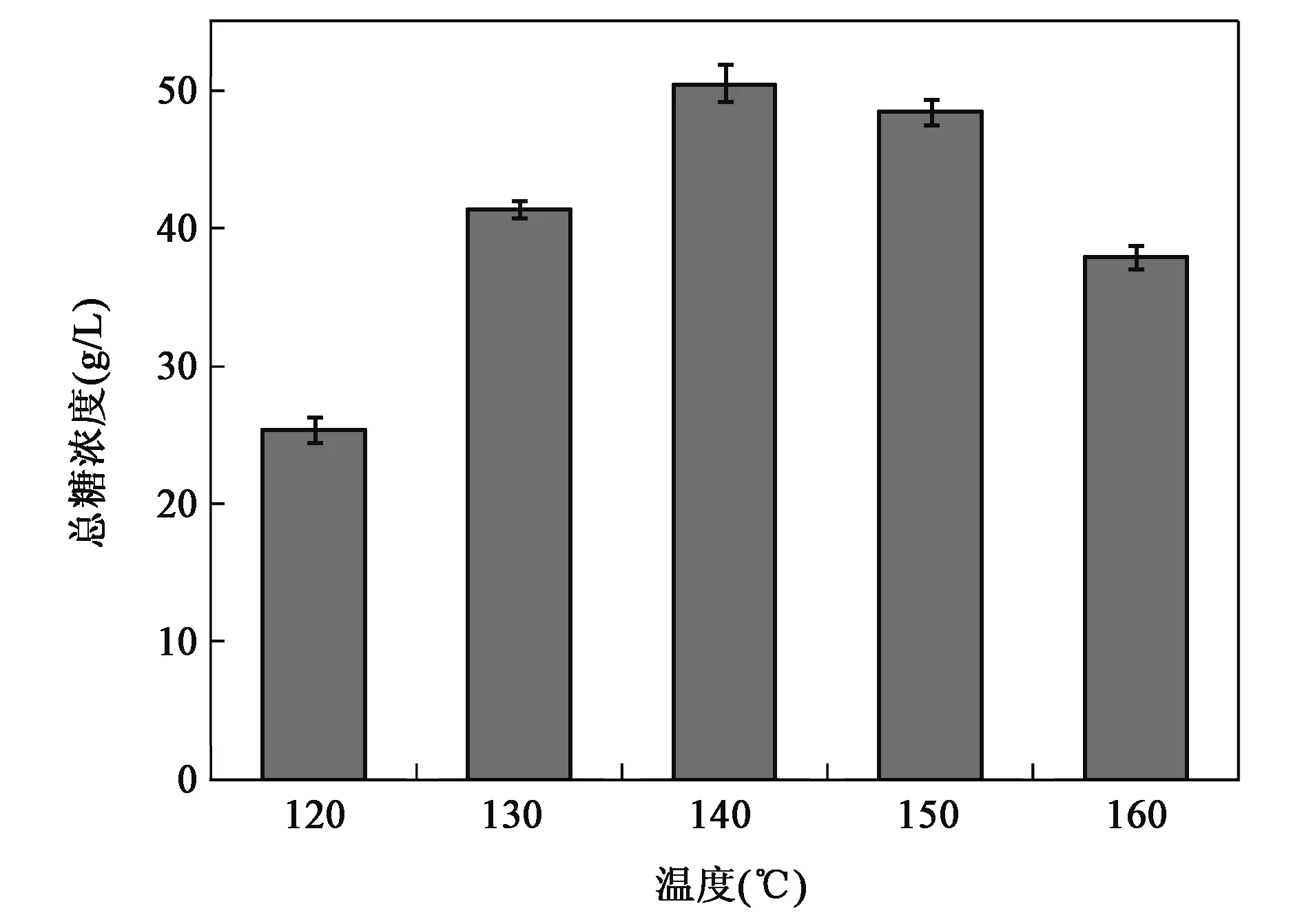
图1 预处理温度对总糖得率的影响
预处理过程中稀硫酸浓度对酶解后总糖得率的影响见图2。当稀硫酸浓度从0.1%升高至0.5%时,总糖浓度不断上升。当硫酸浓度为0.5%时,总糖浓度为50.46 g/L。随着硫酸浓度继续升高至0.7%,总糖浓度基本保持不变,为50.65 g/L。0.9%的硫酸浓度则会导致单糖的进一步降解。因此最佳的预处理硫酸浓度为0.5%。
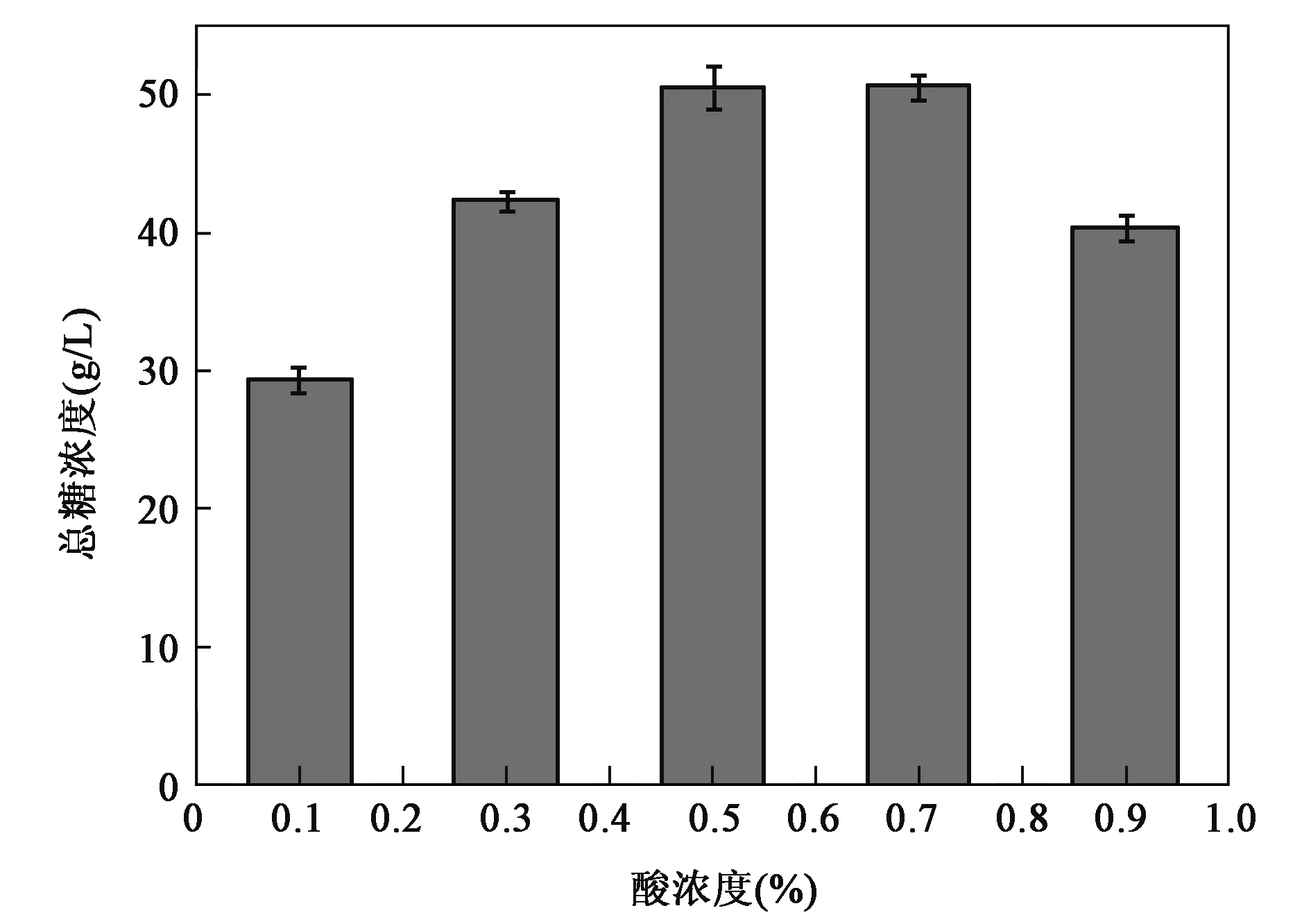
图2 预处理硫酸浓度对总糖得率的影响
2.3酶解对总糖得率的影响
预处理过程中淀粉已被液化,但未全部糖化为葡萄糖;半纤维素也发生部分降解,水解生成木糖、阿拉伯糖等单糖。为了使淀粉和半纤维素组分充分降解为单糖,需要在预处理后加入糖化酶和木聚糖酶进行酶解,以得到更多的单糖。木聚糖酶的底物专一性并不强,除了能水解木糖残基外,还能水解阿拉伯糖残基,从而生成木糖和阿拉伯糖这两种五碳糖。
糖化酶的用量对淀粉水解的影响见图3。当糖化酶用量从100 IU/g底物升高至300 IU/g底物时,淀粉水解生成的葡萄糖量逐渐增大,200 IU/g底物的酶用量对应葡萄糖浓度为16.33 g/L,随后糖化酶用量继续增加至250 IU/g底物和300 IU/g底物时,葡萄糖浓度基本保持不变。从酶的成本和经济性角度考虑,200 IU/g底物的糖化酶用量为最佳值。
木聚糖酶的用量对半纤维素水解生成木糖和阿拉伯糖的影响见图4。当木聚糖酶用量从0.6 IU/g底物升高至1.4 IU/g底物时,所得的木糖和阿拉伯糖总和逐渐升高,但当酶用量大于1.0 IU/g底物时,木糖和阿拉伯糖的增加并不明显,因此1.0 IU/g底物是最优的木聚糖酶添加量,此时酶解液中木糖含量为13.45 g/L,阿拉伯糖含量为13.3 g/L。
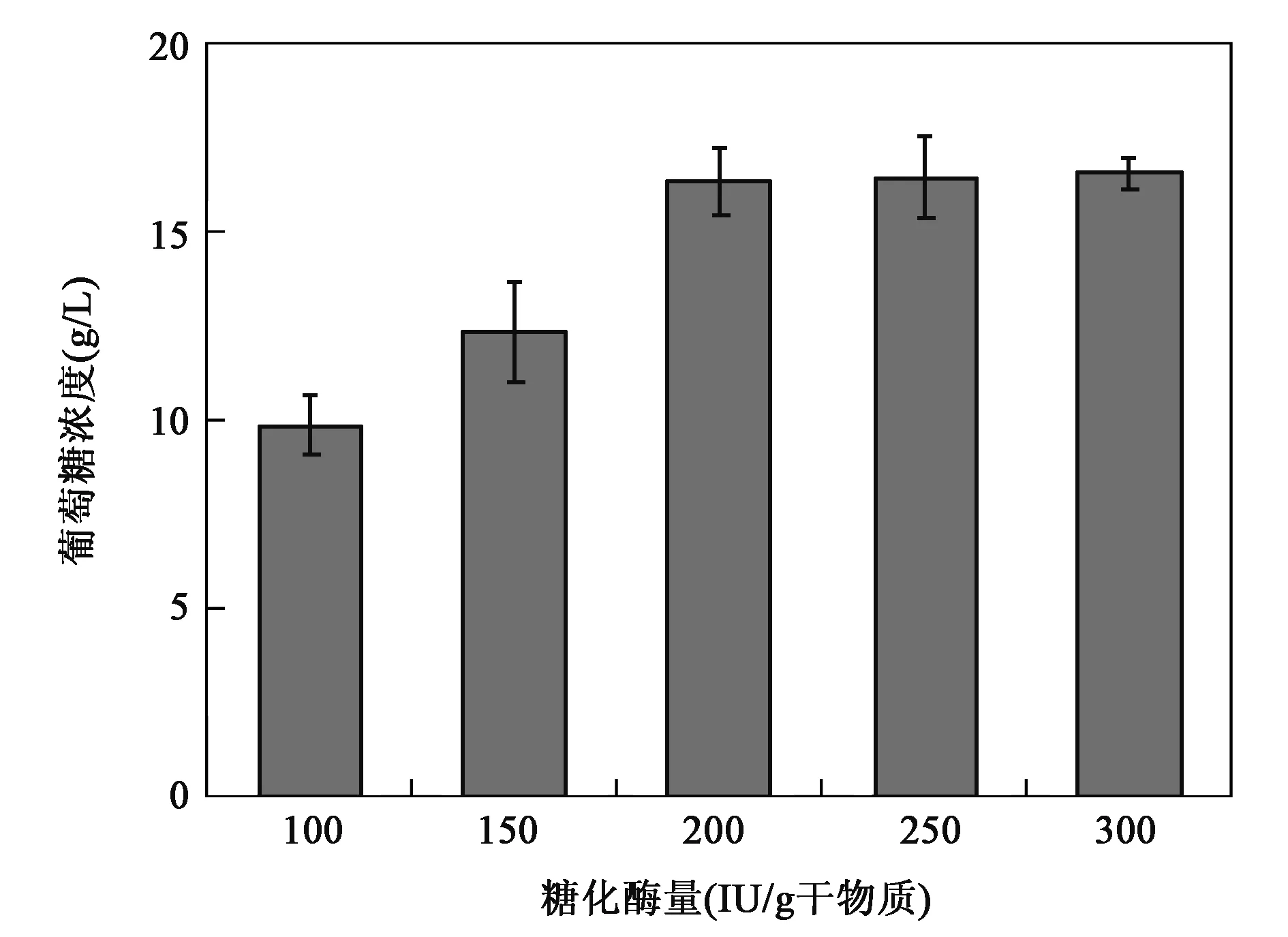
图3 糖化酶用量对淀粉水解的影响
在最优的酶解条件(糖化酶200 IU/g底物,木聚糖酶1.0 IU/g底物)下,玉米皮酶解液中可发酵糖的组成见表2。除了来自淀粉水解产生的葡萄糖、半纤维素水解产生的木糖和阿拉伯糖之外,还存在一定量的纤维二糖(4.76 g/L),来自于少量易降解的无定形纤维素的水解。玉米皮酶解液中总糖含量达到50.46 g/L,达到丁醇发酵所需的初始糖浓度。
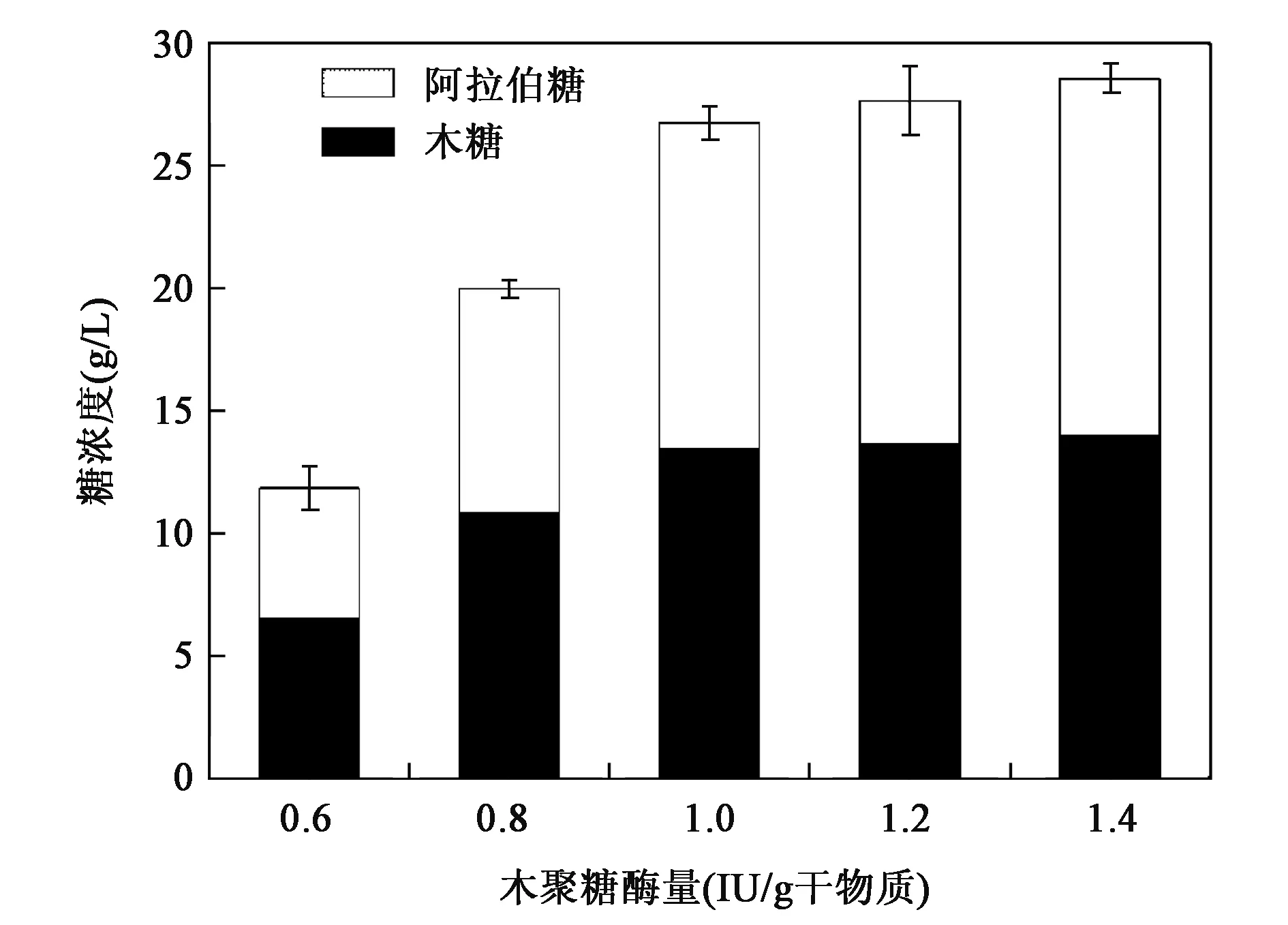
图4 木聚糖酶用量对半纤维素水解的影响

表2 玉米皮酶解液中可发酵糖组成
2.4水解液脱毒对丁醇发酵的影响
玉米皮在高温酸性预处理过程中,会产生三大类发酵抑制物,包括有机酸(乙酸、甲酸)、呋喃类物质(糠醛、羟甲基糠醛)和木质素单体,这些物质的存在会影响微生物的生长及其代谢产生丁醇。发酵抑制物的含量与预处理强度参数有关,本实验中玉米皮的预处理采用的温度和酸浓度都较低,因此发酵抑制物种类和含量并不多,只需要经过简单的活性炭脱毒就可以实现丁醇发酵,图5显示了经不同程度的活性炭脱毒后丁醇发酵产总溶剂的情况,TYA对照培养基的发酵总溶剂产量可达13.85 g/L,而未经脱毒的水解液直接用于丁醇发酵,总溶剂产量仅为6.99 g/L。当用0.5%~2.0%活性炭脱毒后,总溶剂产量都有显著提高,其中1.0%活性炭脱毒后,总溶剂产量为14.09 g/L,此时丁醇产量为9.72 g/L,继续增加活性炭的用量,溶剂产量无明显提高,因此最佳的活性炭脱毒用量为1.0%。
表3列出了最佳发酵条件下总溶剂得率和底物利用的情况,水解液发酵培养基中共存在4种可发酵糖作为碳源:纤维二糖、葡萄糖、木糖和阿拉伯糖。其中葡萄糖基本上可以被完全利用,利用率高达99.89%;而木糖、阿拉伯糖这两种五碳糖的利用率明显较低,只有71.38%和67.89%;纤维二糖是最难被利用的,其利用率仅为55.25%。发酵总溶剂产量为14.09 g/L,计算得到的糖醇转化率为35.1%(W/W)。
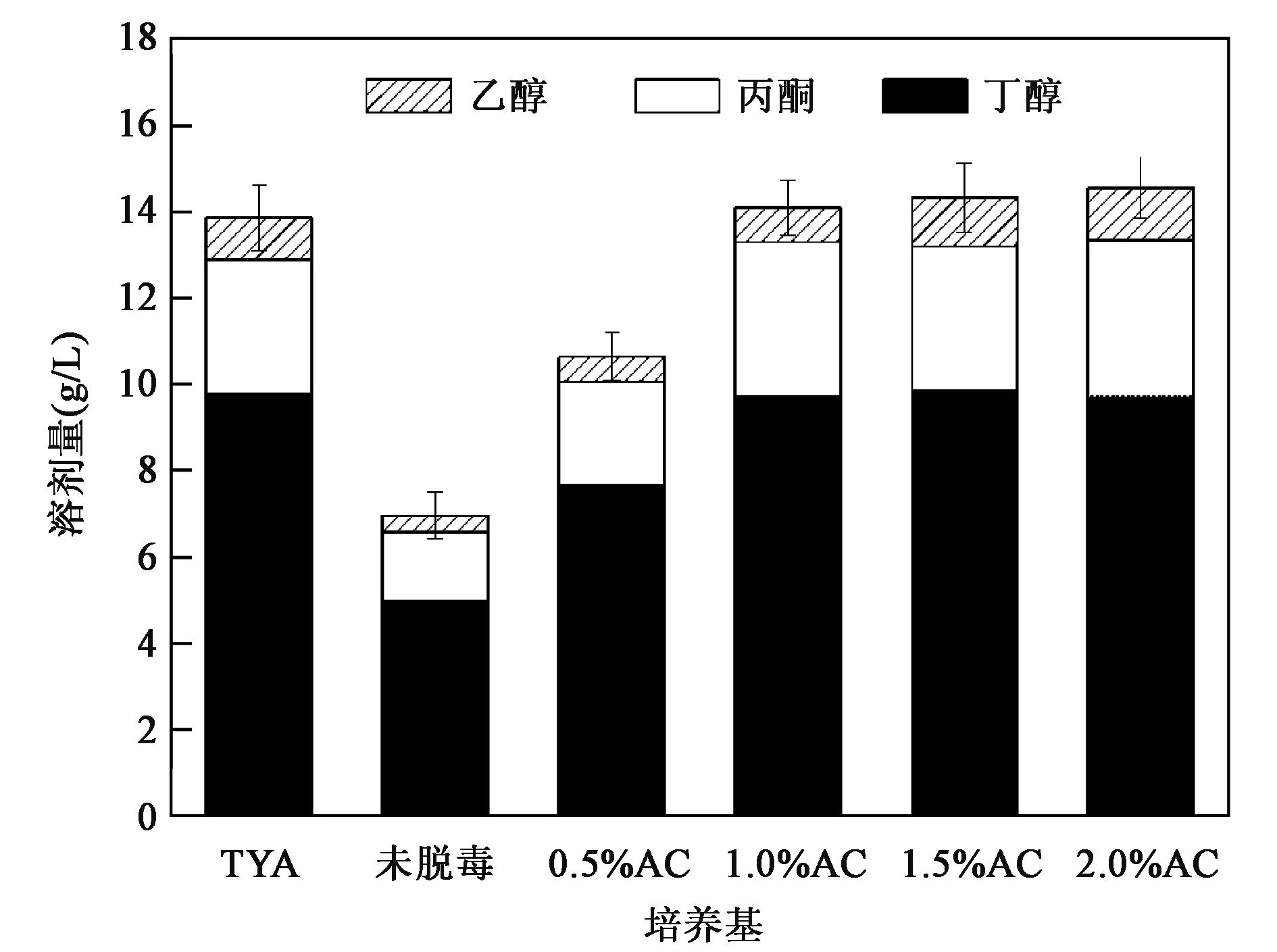
图5 活性炭脱毒对玉米皮水解液发酵产丁醇的影响
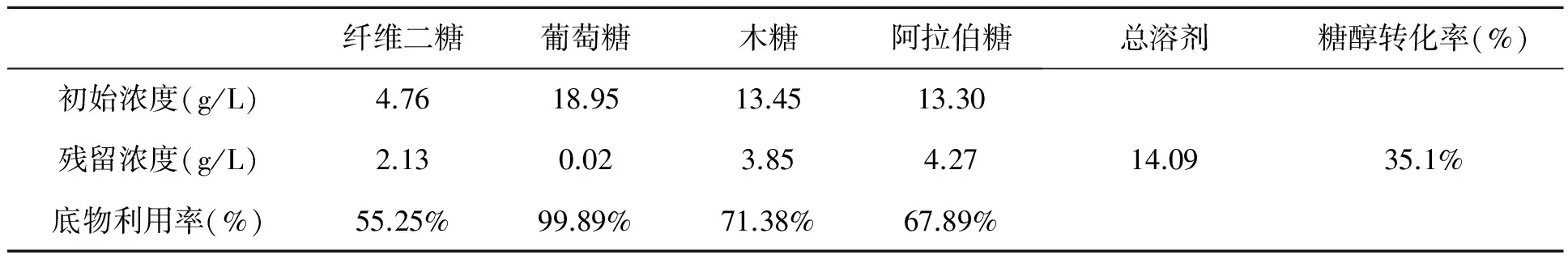
表3 脱毒水解液丁醇发酵结果
3 讨论
玉米皮作为玉米淀粉加工副产物,含有丰富的淀粉、半纤维素和纤维素等组分,是一种潜在的优质生物质资源。但目前对玉米皮的利用仅限于加工饲料,且用量有限,造成了资源的极大浪费。本研究从玉米皮全组分分析入手,以组分最大化、高值化利用为目标,考察了利用淀粉和半纤维素水解液发酵生产液体燃料丁醇的工艺技术。由于玉米皮的抗降解屏障结构,首先必须经过预处理才能够使其中的淀粉和半纤维素降解为可发酵糖,本研究采用稀硫酸预处理,主要作用有三方面:①保证淀粉充分液化;②半纤维素部分降解;③玉米皮原料结构疏松,利于后续酶与底物充分接触。以酶解后产生的总糖得率为指标,确定了稀硫酸预处理在固定的反应时间20 min和固液比1∶8的条件下,最佳温度为140℃,酸浓度为0.5%。玉米皮经过最优条件下的稀硫酸预处理后,分别加入200 IU/g底物糖化酶、1.0 IU/g底物木聚糖酶对预处理料液进行深度水解,此时已液化的淀粉在糖化酶的作用下可全部水解为葡萄糖,绝大部分半纤维素在木聚糖酶的作用下水解产生木糖和阿拉伯糖,由于预处理强度较低,且酶解过程中没有添加纤维素酶,大部分纤维素并未水解成葡萄糖,只有少量易降解的无定形结构纤维素发生水解,因此酶解液中会出现少量纤维二糖,经酶解得到包括葡萄糖、木糖、阿拉伯糖和纤维二糖在内的总糖浓度为50.46 g/L的水解液。由于高温酸性预处理会导致单糖和木质素的降解,生成糠醛、木质素单体等发酵抑制物,经过1.0%的活性炭脱毒处理可有效去除这些发酵抑制物,丁醇发酵总溶剂产量为14.09 g/L,丁醇产量为9.72 g/L,糖醇转化率为35.1%(W/W)。本研究证实利用玉米皮发酵丁醇在技术上是可行的,研究成果既为玉米皮的综合利用提供一条新的途径,同时也为丁醇发酵生产寻找到一种新的原料来源。
[1]华连滩, 王义强, 彭牡丹, 等. 生物发酵产丁醇研究进展[J]. 微生物学通报, 2014, 41(1):146-155.
[2]顾 阳, 蒋 宇, 吴 辉, 等. 生物丁醇制造技术现状和展望[J]. 生物工程学报, 2010, 26(7):914-923.
[3]Qureshi N, Ezeji T C, Ebener J,etal.. Butanol production byClostridiumbeijerinckii, Part I:Use of acid and enzyme hydrolyzed corn fiber[J]. Bioresour. Technol., 2008, 99:5915-5922.
[4]Du T F, He A Y, Wu H,etal.. Butanol production from acid hydrolyzed corn fiber withClostridiumbeijerinckiimutant[J]. Bioresour. Technol., 2013, 135:254-261.
[5]Javed M M, Zahoor S, Shafaat S,etal.. Wheat bran as a brown gold:Nutritious value and its biotechnological applications[J]. Afr. J. Microbiol. Res., 2012, 6:724-733.
[6]Guo T, He A Y, Du T F,etal.. Butanol production from hemicellulosic hydrolysate of corn fiber by aClostridiumbeijerinckiimutant with high inhibitor-tolerance[J]. Bioresour. Technol., 2013, 135:379-385.
[7]Qureshi N, Li X L, Hughes S,etal.. Butanol production from corn fiber xylan usingClostridiumacetobutylicum[J]. Biotechnol. Progr., 2006, 22:673-680.
[8]Sluiter A, Hames B, Ruiz R,etal.. Determination of Structural Carbohydrates and Lignin in Biomass: Laboratory Analytical Procedure (LAP)[EB/OL]. http://www.nrel.gov/docs/gen/fy13/42618.pdf, 2012-08-03.
[9]刘 莉, 史吉平, 孙俊松, 等. 丙酮丁醇梭菌发酵小麦麸皮生产丁醇[J]. 中国酿造, 2012, 31(8):32-35.
[10]Hames B, Scarlata C, Sluiter A. Determination of Protein Content in Biomass:Laboratory Analytical Procedure (LAP).[EB/OL].http://www.nrel.gov/docs/gen/fy08/42625.pdf, 2008-05-23.
[11]Sluiter A, Hames B, Ruiz R,etal.. Determination of Ash in Biomass: Laboratory Analytical Procedure (LAP).[EB/OL].http://www.nrel.gov/docs/gen/fy08/42622.pdf, 2005-07-17.
[12]Sluiter A, Ruiz R, Scarlata C,etal.. Determination of Extractives in Biomass: Laboratory Analytical Procedure (LAP). [EB/OL].http://www.nrel.gov/docs/gen/fy08/42619.pdf, 2005-07-17.
[13]Liu L, Sun J, Cai C,etal.. Corn stover pretreatment by inorganic salts and its effects on hemicellulose and cellulose degradation[J]. Bioresour. Technol., 2009, 100:5865-5871.
[14]王战勇, 苏婷婷, 胡珍珠. 双酶法制备玉米皮膳食纤维的研究[J]. 氨基酸和生物资源, 2009, 31(1):37-39.
[15]张丽丽, 沈兆兵, 史吉平, 等. 紫外诱变和丁醇驯化复合选育高产丁醇菌株[J]. 中国酿造, 2013,32(5):129-133.
[16]Wang L, Chen H. Acetone-butanol-ethanol fermentation and isoflavone extraction using kudzu roots[J]. Biotechnol. Bioprocess Eng., 2011, 16:739-745.
[17]Cho D H, Shin S J, Sang B I,etal.. ABE production from yellow poplar through alkaline pre-hydrolysis, enzymatic saccharification, and fermentation[J]. Biotechnol. Bioprocess Eng., 2013, 18:965-971.
