游离脂肪酶催化蓖麻油制备蓖麻油酸
2014-11-05刘德华
杨 威, 杜 伟, 刘德华
清华大学化学工程系应用化学实验室,北京 100084
高级脂肪酸是油脂化工产品中最重要的基础化学品之一[1],其中的蓖麻油酸是工业应用中唯一的羟基脂肪酸。蓖麻油酸是蓖麻油的水解产物,在蓖麻油中占脂肪酸组成的90%左右,远高于其他油脂中最高的脂肪酸含量比例[2]。蓖麻油酸也称为12-羟油酸,可直接作为添加剂应用于纺织、制皂和树脂等行业[3]。因蓖麻油酸具有特殊的羟基和不饱和双键,它最重要的应用是作为中间体生成众多衍生物,在增塑剂、两性表面活性剂产业中具有不可替代的地位[4]。此外,产蓖麻油植物蓖麻出油率高、耐干旱且耐盐碱,因此易于种植和相关产业链的开发[5]。
利用蓖麻油独特羟基基团的众多反应虽然能够制备许多重要衍生物,但羟基的存在也对蓖麻油的加工工艺造成了不利的影响,如体系粘度大,易发生副反应等[6]。目前大规模工业化生产中最常用的油脂水解方法为高温高压法[7],这种方法生产效率高,但应用于催化蓖麻油水解易形成聚酯且产物颜色深,导致后续纯化代价高。传统的先皂化后酸化的油脂水解方法相对于高温高压法要温和的多,蓖麻油在该方法处理下水解效率高,但生成的脂肪酸带有特殊的气味和颜色,且该过程会产生大量难以处理的废水和盐[8]。选用生物酶法水解油脂可以克服以上两种应用最为普遍的油脂水解方法的缺点,在温和条件下获得高质量的产物,且具有环境友好特性[8]。其中固定化脂肪酶水解法以其易分离、稳定性高等优点,广泛应用于天然油脂水解的研究中,其在蓖麻油水解中已取得一定进展,但普遍存在水解效率低的问题。以水解效果较好的褶皱假丝酵母脂肪酶和KKA-5 脂肪酶为例。Goswami等[10,11]对固定化的褶皱假丝酵母脂肪酶催化蓖麻油水解进行响应面优化,在最优条件下6 h蓖麻油酸得率为63%。Sharon 等[12,13]研究了不同金属离子对 KKA-5 脂肪酶催化蓖麻油水解的影响,结果发现加入Mg2+效果最佳,192 h水解率为87%。同时由于固定化脂肪酶成本相对较高,其推广应用仍存在一定限制。
与固定化脂肪酶相比,游离脂肪酶具有生产成本较低、油水界面活性高等优点,且通过离心分离可重复使用,是生物酶在油脂化学中新的研究方向。本课题组前期研究工作表明,游离脂肪酶NS81006在催化大豆油及其多种低品质的含酸废弃油脂甲酯化制备生物柴油中表现出良好的催化效果。由此,进一步考察NS81006催化油脂水解,对游离脂肪酶在油脂工业应用的拓展具有重要意义。
本文系统研究了不同因素对游离脂肪酶NS81006催化蓖麻油水解过程的影响,并通过离心回收乳化层的方式重复使用游离脂肪酶,考察其回用稳定性。将该游离脂肪酶水解蓖麻油与工业生产中常用的高温高压法水解蓖麻油的效果进行了比较,为其工业应用提供了依据。
1 材料与方法
1.1 主要试剂与仪器
游离脂肪酶NS81006,来源于黑曲霉(Aspergillus niger),诺维信公司产品;固定化脂肪酶Novozym435,来源于南极假丝酵母(Candida antarctica),诺维信公司产品;化学纯蓖麻油,购自西陇化工股份有限公司;蓖麻油毛油,购自国华油脂有限公司;95%乙醇、无水乙醇、NaOH、KOH,均为分析纯,购自北京化工厂。三丁酸甘油酯,分析纯,ACROS ORGANICS公司产品。
XS105 Dualrange分析天平(瑞士METTLER TOLEDO公司);HQ45A恒温空气摇床(中国科学院武汉科学仪器厂);CR22F高速离心机(日本HITACHI公司);TFCF5-15型高温高压釜(天舟海泰科技公司);CA-05卡尔菲休水分测定仪(日本三菱化学工业公司)。
1.2 蓖麻油理化性质测定
采用GB/T 2559-2005方法测定蓖麻油的皂化值,GB/T 5009.37-2003方法测定蓖麻油的酸价,GB/T 2559-2003方法测定蓖麻油的碘值,GB/T 18619.1-2002方法测定蓖麻油含水量。
1.3 脂肪酶水解活力的测定
酶活力单位(U)定义:每分钟催化三丁酸甘油脂水解产生1 μmoL/L丁酸所需的酶量为一个酶活单位。将1.0 mL三丁酸甘油酯与3.0 mL Gly-NaOH缓冲液(pH 9.4)加入50 mL具塞三角瓶中,在140 r/min、40℃恒温空气摇床中振荡乳化15 min后,取出并加入脂肪酶,再置回恒温空气摇床中,10 min后取出立即加入10 mL 95%乙醇和3滴酚酞指示剂,并用0.1 mol/L NaOH溶液滴定。重复上述步骤但不加酶制剂即为空白实验。
脂肪酶酶活力的计算公式为:
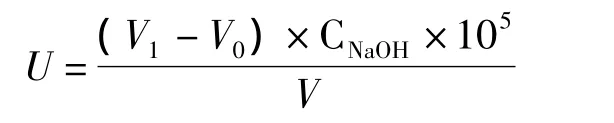
其中,V1为滴定样品所消耗的NaOH标准溶液体积(mL);V0为滴定空白所消耗的NaOH标准溶液体积(mL);V为加入的游离脂肪酶酶液的体积(mL)。
1.4 蓖麻油酸的制备
游离脂肪酶催化蓖麻油水解步骤为:在500 mL三口瓶中加入一定比例的蓖麻油、去离子水和游离脂肪酶,控制反应温度和搅拌速度进行水解反应(见图1),定时观察反应现象并取样,经高速离心后取上层油相,测定其酸价。
高温高压法水解步骤为:在高压釜中加入一定比例的蓖麻油和去离子水,在高温高压条件下进行水解反应,定时取样,经高速离心后取上层油相,测定其酸价。

图1 蓖麻油水解实验装置示意图 Fig.1 Schematic diagram of castor oil hydrolysis experimental installation.
根据测定的酸价可计算出蓖麻油水解率,即:

1.5 游离脂肪酶NS81006催化蓖麻油水解回用稳定性研究
单批次反应24 h后,隔夜静置,反应体系达分层稳定,回收水层和油层之间的乳化层并应用到下一个批次反应。通过测量蓖麻油水解率随反应批次的变化情况判断游离脂肪酶的回用稳定性。
2 结果与分析
2.1 反应温度的影响
反应温度对于油脂水解反应的平衡具有显著的影响。水解反应宏观上为吸热反应,高温有利于油脂反应的进行,但是过高的温度会导致游离脂肪酶丧失催化活性。对不同反应温度下蓖麻油水解度随时间变化的实验结果如图2所示。从结果看出,在所选不同温度下,NS81006催化蓖麻油水解反应曲线形状相似。在开始2 h内反应迅速,水解率可达50%,后期水解率呈逐步上升,24 h后达到较为稳定的状态。当温度为45℃时,蓖麻油水解效果最佳。温度提高到50℃或降低到40℃,水解率在相同反应时间都有不同程度的下降。
2.2 酶添加量的影响

图2 不同温度下蓖麻油水解率 Fig.2 Hydrolysis rates of castor oil at different temperatures.
酶的添加量的多少不仅影响油脂水解反应速率,也在很大程度上决定了该工艺流程的成本。根据测定,NS81006酶活为3 340 U/mL,在足够的水量和适宜温度下,选择了不同酶用量催化蓖麻油水解,结果如图3所示。结果显示水解率随酶用量增加而增加,但单位酶用量对水解率的贡献逐渐减小。以24 h的水解率为例,当酶用量达100 U/g油时,水解率为90.2%,继续增加酶用量至167 U/g油,水解率增加到 93.8%,提高了3.6%。而再增加酶用量分别至267 U/g油和333 U/g油时,水解率分别提高2.3%和1.7%。因此,在保证水解速率的同时使单位成本酶的效用最大化,应该选择酶用量在100~167 U/g油范围内。
2.3 水用量的影响
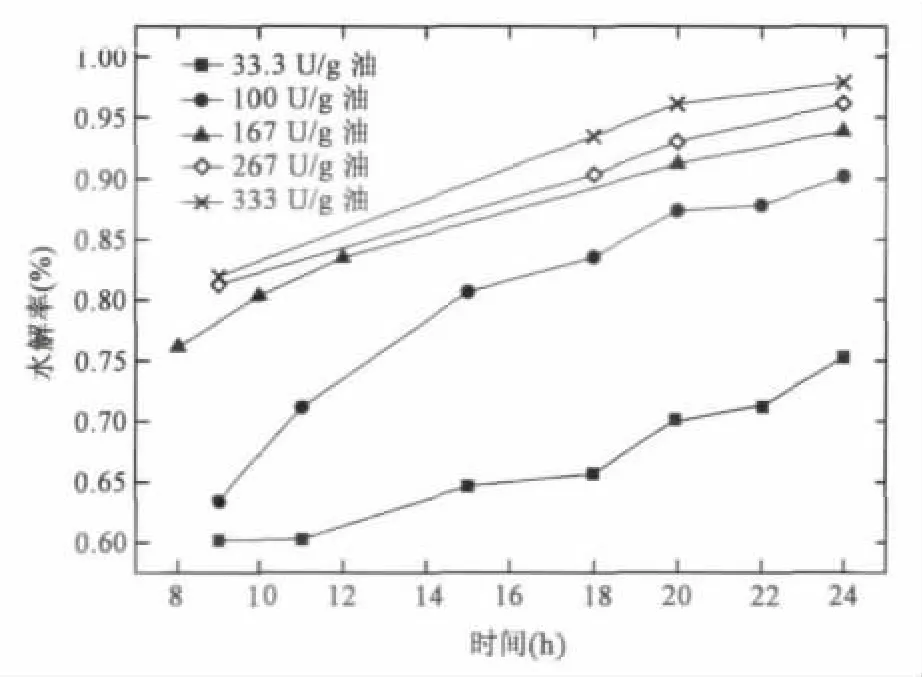
图3 不同酶添加量下蓖麻油水解率 Fig.3 Hydrolysis rates of castor oil under different enzyme dosage.
蓖麻油水解反应是可逆反应,随着反应进行,水相中甘油浓度会增加,逆向反应随之加强,因此增加水在反应体系中的含量可以推动反应平衡右移,同时促进反应体系的乳化,为游离脂肪酶提供了更多的活化界面。兼顾反应器设计加工和后期水相处理等,水用量也不宜过多,因此实验选择了油水质量比1∶0.5~1∶4的一系列条件进行研究,结果如图4。
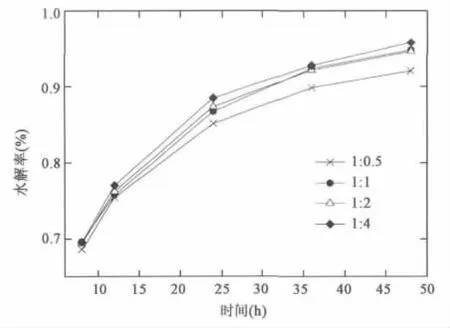
图4 不同水用量下蓖麻油水解率 Fig.4 Hydrolysis rates of castor oil under different water usage.
从实验结果可以看出,整体上水解率随着水用量的增加而增加。在油水质量比高于1∶1时,在所选条件下48 h水解率相当,均超过94%。因此选择油水质量比1∶1能够保证较快的蓖麻油水解反应速度和较高的最终水解率。
2.4 酶用量和水用量的组合优化
在所研究的脂肪酶催化蓖麻油水解的影响因素中,酶用量和水用量作为水解反应的催化剂和反应物影响极为关键,且两者的比例变化会导致体系乳化程度出现差异。根据前述对NS81006催化蓖麻油水解影响因素的研究,选择酶用量100 U/g油、167 U/g油与不同油水质量比进行组合实验,以期获得更高水解效率的优化条件。从实验结果可以看出(见图5),与酶用量100 U/g油,油水质量比1∶0.5的条件比较,提高酶用量至167 U/g油同时减小油水质量比到1∶0.25,反应48 h水解率从92.1%降到88.8%。这说明了水用量偏低会造成水解率降低,且不能通过酶用量的增加来弥补。对于48 h水解率最高且相当的两组,酶用量167 U/g油、油水质量比1∶0.5的水解率为95.2%;酶用量100 U/g油、油水质量比1∶1的水解率为94.8%。考虑到游离脂肪酶成本远高于水,因此选择酶用量100 U/g油,油水质量比1∶1。
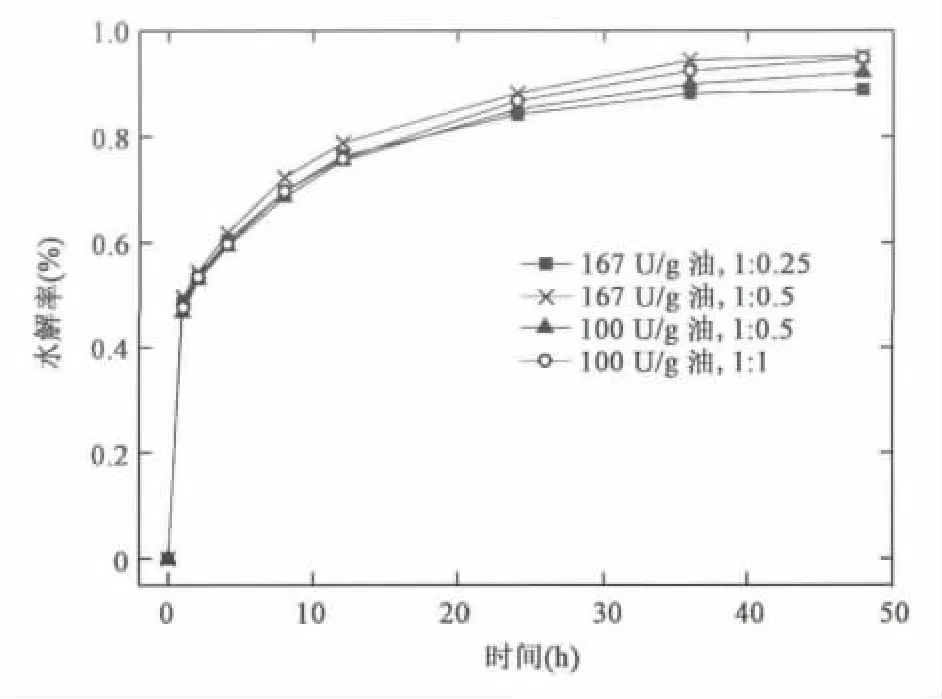
图5 不同酶用量和水用量组合条件下蓖麻油水解率 Fig.5 Hydrolysis rates of castor oil under different combinations of enzyme dosage and water usage.
2.5 搅拌速度的影响
游离脂肪酶在水解反应体系中会集中在油水界面上,具有乳化作用。搅拌能够增加体系混合程度,增大油水表面积,使酶和底物更好地接触。实验选择了150~1 000 r/min的一系列搅拌速度进行研究,结果如图6。

图6 不同搅拌速度下蓖麻油水解率 Fig.6 Hydrolysis rates of castor oil at different stirring speeds.
可以看出,水解率随着搅拌速度增加而增加,即反应体系混合越充分,水解反应速率越快。当在500 mL三口瓶中搅拌速度达800 r/min以上时,24 h水解率可达90%以上,而提高搅拌速度至1 000 r/min后,相同时间下水解率没有明显变化,因此选择800 r/min为最适搅拌速度。
2.6 酶的重复使用
在生物酶的应用过程中,酶的循环利用可有效降低酶的使用成本。因此,在游离脂肪酶NS81006催化蓖麻油水解的过程中,考察游离脂肪酶NS81006的回用稳定性尤为重要。前期研究表明,反应结束后,体系自上而下分为油层、乳化层和水层,游离脂肪酶主要集中在乳化层,少部分存在于水层。若回收水相则其中的甘油会抑制水解反应进行,因此仅将乳化层直接回复使用,考察其催化蓖麻油水解的效果,结果如图7所示。
研究结果表明,在游离脂肪酶NS81006催化蓖麻油水解的过程中,NS81006连续回用5个批次,蓖麻油水解率仍保持75%以上。回用过程中,水解率随着批次增加不断下降,主要原因是部分酶存在于水层,回收酶过程中还不可避免会造成脂肪酶的损失。

图7 各回用批次下蓖麻油水解率 Fig.7 Hydrolysis rates of castor oil in different recovery batches.
2.7 高温高压法水解蓖麻油
油脂高温高压水解法具有水解率高、处理量大等优点,是目前世界普遍采用的先进工艺,但其操作温度高,不适合用于含羟基的蓖麻油水解。实验分析了高温高压法水解蓖麻油反应速率提高幅度和副反应发生的程度,同时比较了搅拌与否带来的差异,结果如图8。从图中可以看出,高温高压法水解蓖麻油速率明显高于酶法。在搅拌操作下,水解率2 h接近70%,酶法达到相同水平需要约8 h,但高温高压法最高水解率仅为75%,远低于酶法可以达到的95%左右的水解率。另外,在未搅拌情况下,蓖麻油水解在开始后1 h内存在较大传质阻力,而1 h后反应速率加快,与搅拌时前2 h反应速率相当。该现象表明在高温高压条件下,当反应体系进入平衡状态后,搅拌的存在对水解反应促进作用很小。同时可以看出不论在是否有搅拌的情况下,高温高压条件下蓖麻油水解率均会出现下降的情况,这说明水解后期副反应成为主导,很可能是产物蓖麻油酸与带有羟基的甘油三酯及其本身发生酯化反应,形成聚酯,从而导致酸价下降,水解率也因此下降。当然,高温下高级脂肪酸的热敏性共轭双键也可能发生断裂,但这不会直接引起水解率的变化。
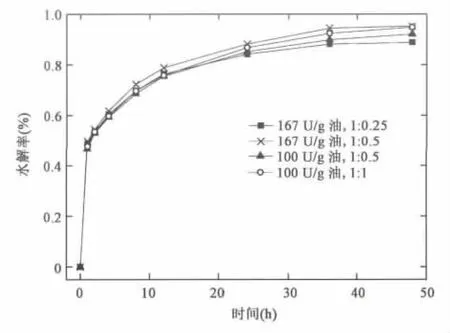
图8 高温高压条件下蓖麻油水解率 Fig.8 Hydrolysis rates of castor oil under conditions of high temperature and pressure.
3 讨论
通过对酶法催化油脂水解影响较大的几个因素分别进行研究,得到游离脂肪酶NS81006催化蓖麻油水解的最佳反应条件为:温度45℃,酶添加100 U/g油,油水质量比 1∶1,搅拌速度800 r/min。该条件下反应48 h水解率可达94.8%,相比目前文献报道结果优势明显。对脂肪酶回用的实验发现重复使用脂肪酶至第5批次,仍能有效催化蓖麻油水解,水解率76.8%。同时对高温高压条件下的蓖麻油水解的研究发现,采用该方法,蓖麻油水解率难以达到较高水平,最高在75%左右,且反应后期由于副反应的发生出现水解率下降的现象,说明该方法不适宜用于蓖麻油的水解。游离脂肪酶NS81006催化蓖麻油进行水解虽然成本相对较高,但其集反应条件温和、环境友好、原料适应性强和水解率高等优点于一体,具有较好的应用前景。
[1]张华涛.中国油脂化工行业现状与展望[J].中国油脂,2010,(9):9 -12.
[2]刘润哲,王云昆,张华,等.蓖麻油的理化性质及脂肪酸组成分析[J].粮食与食品工业,2011,(6):14-16.
[3] 汪多仁.蓖麻油的应用开发[J].印染助剂,2001,(1):4-8.
[4]Ozcan H M,Sagiroglu A.Production of ricinoleic acid from castor oil by immobilised lipases.[J].Prep.Biochem.Biotechnol.,2009,39(2):170 -182.
[5]林岩,陆建飞,周桂生.基于产业链视角的中国蓖麻产业发展的分析[J].中国农学通报,2011,27(29):124-127.
[6]Rathod V K,Pandit A B.Effect of various additives on enzymatic hydrolysis of castor oil[J].Biochem.Eng.J.,2009,47(1 -3):93 -99.
[7]王辉.油脂高温高压连续水解机理及工业因素讨论[J].粮食与油脂,2000,(4):35 -36.
[8]朱培基.国外油脂水解工艺发展概况及趋势[J].上海化工,1993,18(4):24 -26.
[9]Yamamoto K,Fujiwara N.The hydrolysis of castor oil using a lipase from Pseudomonas sp.F-B-24:positional and substratespecificity of the enzyme and optimum reaction conditions[J].Biosci.Biotechnol.Biochem.,1995,59(7):1262 -1266.
[10] Goswami D,Basu J K,De S.Optimization of process variables in castor oil hydrolysis by Candida rugosa lipase with buffer as dispersion medium[J].Biotechnol.Bioprocess Eng.,2009,14(2):220-224.
[11] Goswami D,Sen R,Basu J K, et al..Maximization of bioconversion of castor oil into ricinoleic acid by response surface methodology[J].Bioresour.Technol.,2009,100(18):4067-4073.
[12] Sharon C,Ogawa H I.Lipase-induced hydrolysis of castor oil:Effect of various metals[J].J.Ind.Microbiol.,1998,21(6):292-295.
[13] Sharon C,Yamakido T,Kato Y.Purification and characterization of a lipase from Pseudomonas aeruginosa KKA-5 and its role in castor oil hydrolysis[J].J.Ind.Microbiol.,1998,20(5):304-307.
