六氯苯与雌二醇共存时内分泌干扰活性拮抗效应及其机制研究
2014-09-15张盼月张光明
张盼月,张光明,郎 朗
(1. 湖南大学 环境生物与控制教育部重点实验室,湖南 长沙 410082;2. 中国人民大学 环境学院,北京 100872;3. 哈尔滨商业大学 生命与环境科学研究中心,黑龙江 哈尔滨 150028)
内分泌干扰物(EDCs)具有生物内分泌干扰活性、可破坏免疫系统、引起多种器官和神经损伤,是目前国际研究热点[1].我国多地检出多种EDCs,其典型代表是六氯苯(HCB)[2].环境中的六氯苯进入生物体后,必然与天然雌激素共同发挥作用.而这方面的研究未见报导.
研究发现,有的物质混合时出现明显的协同作用,如Dieldrin,Toxaphene,Endosulfan和Chlordane任何两种混合,雌激素反应强度可增加160~1 600倍[3].双酚A、异黄酮、壬基酚在低浓度下也出现明显协同[4-5].与此同时,也有报道发现狄氏剂和毒杀酚混合后雌激素效应无协同作用[6];而镉与E2之间甚至出现了拮抗作用[7].上述现象表明不同EDC的混合效应不同、作用机制不同,需要逐一研究.本文选择天然雌激的代表雌二醇(E2),研究它与六氯苯共同作用时的内分泌干扰活性及其作用机制.
1 材料与方法
人体乳腺癌细胞MCF-7来自哈尔滨工业大学生物系,属ATCC细胞系.酶与蛋白标样购自美国Sigma公司.化学试剂购自美国Ameresco公司.根据六氯苯的毒性检测结果和生物体内E2浓度,单独投加六氯苯浓度为10-8mol/L,单独投加E2的浓度为10-12mol/L,混合物的浓度为二者各取一半.所用主要设备包括GeneAmp® PCR System 9700(Applied Biosystems公司),DYY-6B电泳仪(北京市六一仪器厂),蛋白质电泳及Western杂交转膜系统(Bio-Rad),LSM Meta510 激光共聚焦仪(Zeiss公司)和IGO 150二氧化碳培养箱(Thermo公司).
雌激素活性检测采用经典E-Screen法,细胞增殖效应(PE)为实验组的吸光度平均值与溶剂对照组吸光度平均值的比值[2].
采用WESTERN BLOT法测定乳腺癌MCF-7细胞内雌激素受体α蛋白,以及丝裂原活化蛋白激酶(MAPK)信号转导通路相关蛋白.该方法可检测到低至10pg的EDC干扰效应[8].以β-Tublin蛋白作为内参照,对目的蛋白表达量进行校正[9].采用RT-PCR法测定EDCs干扰效应相关的转录因子,具体步骤为:细胞培养、RNA抽提、分离、沉淀、洗脱、再溶解、定量、逆转录、聚合酶链式反应、电泳鉴定[2].
每次试验均进行三组平行试验,每组平行实验设定6个平行样,共18个样品,最终实验数据经SPSS13.0方差分析进行处理.
2 结果与讨论
2.1 六氯苯与雌二醇混合后内分泌干扰活性研究
首先考察E2与六氯苯的混合对其内分泌干扰活性的影响,结果见图1.图1表明六氯苯明显促进MCF-7细胞增殖效应,E2在48 h时的细胞增殖效应最强,96 h时二者均失去增殖效应.二者混合后产生明显的拮抗效应,在24 h时甚至比溶剂对照组弱.这一现象十分重要,意味着天然雌激素对六氯苯的内分泌干扰活性存在强烈的抑制,可以有效消除其内分泌干扰活性,对于保护生物体内分泌系统稳定具有重要作用.本文的结果来源于单一浓度实验,这一拮抗现象并非决定性的结论,不同实验条件下二者的混合效应需要进一步的实验验证.
2.2 内分泌干扰活性路径分析
接下来研究E2,六氯苯、两者混合物的内分泌干扰活性路径.EDCs干扰内分泌系统活动的路径有多种.其中最常见的是与生物体内的雌激素受体(ER)结合,阻止天然雌激素作用,被称为经典路径;此外,EDCs还可以通过非经典路径如MAPK通路发挥作用.本文同时考察了二者.
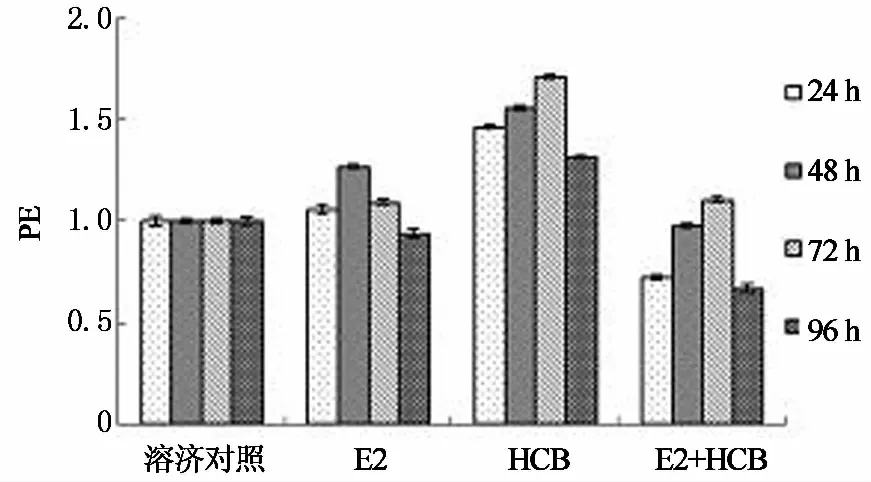
图1 E2与六氯苯混合后对MCF-7增殖效应的影响Fig.1 Effect of E2, HCB, and mixture on proliferation of MCF-7 cells
2.2.1 经典路径分析
首先研究了经典的ER通路,MCF-7细胞中最重要的雌激素受体是ERα蛋白.由图2可知,E2,六氯苯及混合物均可使ERα蛋白的表达量降低,诱导细胞增殖.E2与六氯苯混合物对ERα蛋白表达量的影响介于两者之间,未发现拮抗现象,说明ER通路不是E2抑制六氯苯内分泌干扰活性的原因.

**表示p<0.01图2 E2与六氯苯混合对ERα蛋白表达的影响Fig.2 Expression of ERα protein induced by E2, HCB, and mixture
2.2.2 非经典路径分析
图2表明经典路径不是E2抑制六氯苯的路径,拮抗效应可能通过MAPK信号通路起作用.MAPK信号通路中最重要的一条是外界因子激活细胞外信号调节蛋白激酶(ERK)[10],活化的ERK磷酸化多种核转录因子,进而参与调控雌激素活性,调节增殖相关蛋白的合成与表达.ERK的激活情况如图3所示,E2使ERK蛋白表达量升高,六氯苯使ERK蛋白的表达量降低,混合物作用时效果与六氯苯单独作用时接近,远低于E2的单独作用.
被激活的ERK蛋白转变成p-ERK蛋白,如图4所示.六氯苯能够强烈地诱导p-ERK蛋白的表达,混合物对p-ERK蛋白表达的诱导能力与雌二醇单独作用时强度相当、远低于六氯苯的单独作用.因此,推测雌二醇弱化六氯苯内分泌干扰活性的途径主要是通过干扰ERK的活化,降低了p-ERK蛋白的表达.

*表示p<0.05,**表示p<0.01图3 E2与六氯苯混合对ERK蛋白表达的影响Fig.3 Fig. 3 Expression of ERK protein in MCF-7 with E2, HCB, and mixture
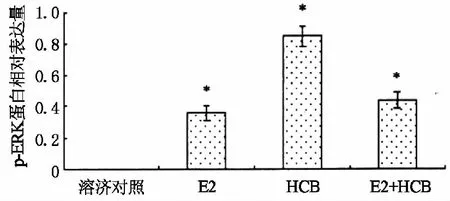
*表示p<0.05
2.3 转录因子的激活
上述研究表明,E2抑制了六氯苯对ERK蛋白的活化,使p-ERK蛋白表达量下降.为了进一步证实这一观点,研究了它们对转录因子的影响.活化后的p-ERK蛋白可磷酸化多种转录因子,其中最关键的几个为c-Myc蛋白、c-Fos基因、c-Jun基因[11].
2.3.1 c-Myc蛋白
c-Myc蛋白通过转录调节靶基因发挥生物学效应[12],其过度表达能部分逆转抗激素ICI182,780的生长抑制作用[13].六氯苯诱导c-Myc蛋白表达的能力很强,与E2混合后明显减弱(图5).c-Myc蛋白表达的降低,可能是E2弱化六氯苯效应的主要原因.

*表示p<0.05
2.3.2 c-Fos基因
如图6所示,两种物质均能使c-Fos基因的表达增高,但混合物的效应远低于两者的单独作用.此机制也能够说明E2对六氯苯的弱化作用.

*表示p<0.05,**表示p<0.01
2.3.3 c-Jun基因
试验发现,E2,六氯苯,混合物均能使c-Jun基因表达量下降8%~13%,差异缺乏显著性.说明E2与六氯苯的拮抗作用与c-Jun基因表达无密切关系.
3 结 论
本文研究了典型环境内分泌干扰物六氯苯与天然雌激素雌二醇共存时对人体乳腺癌细胞MCF-7的增殖效应.结果发现,六氯苯与雌二醇均有较强的内分泌干扰活性、可诱导MCF-7细胞增殖;二者共存时呈现明显的拮抗作用,这对减轻六氯苯的内分泌干扰活性具有重要意义.由于本文是单一浓度实验,该结论尚需进一步梯度实验确认.机理研究表明,雌二醇可通过雌激素受体通路及MAPK通路发挥作用、增加DNA分裂期细胞比例.六氯苯也可以通过上述路径发挥作用、同时增加DNA分裂期及间歇期的细胞比例、促进细胞增殖.二者混合后,拮抗效应主要是通过MAPK信号通路实现,降低p-ERK蛋白的表达、进而减弱c-Fos基因表达.
[1] WITORSCH R J. Endocrine disruptors: can biological effects and environmental risks be predicted? [J]. Regul Toxicol Pharmacol, 2002, 36(1): 118-130.
[2] 郎朗. E2与饮用水中典型环境雌激素共存时内分泌干扰活性研究[D]. 哈尔滨:哈尔滨工业大学市政环境工程学院,2011.
LANG Lang. Stduy of endocrine disrupting activity for E2 coexisiting with typical environmental estrogens in drinking water [D]. Harbin: Harbin Institute of Technology , 2011. (In Chinese)
[3] YI J, KWON H, CHO J,etal. Estrogen and hypoxia regulate estrogen receptor alpha in a synergistic manner[J]. Biochem Biophys Res Commun,2009, 378(4): 842-846.
[4] RAJAPAKSE J, SILVA E, KORTENKAMP A. Combining xenoestrogens at levels below individual no-observed-effect concentration dramatically enhances steroid hormone action[J]. Environmental Health Perspective,2002, 110(9): 917-921.
[5] RAMAMOORTHY A, VYHLIDAL C, WANG F,etal. Estrogenic activity of a dieldrin/ toxaphene mixture in the mouse uterus, MCF-7 human breast cancer cells,and yeast-based estrogen receptor assays: no apparent synergism[J]. Endocrinol,1997, 138: 1520-1527.
[6] 张盼月,张光明,朗朗.雌二醇强化壬基酚雄性毒性机理研究[J].湖南大学学报:自然科学版,2012,39(11):78-81.
ZHANG Pan-yue, ZHANG Guang-ming, LANG Lang. Mechanisms of enhancing male toxicity of nonylphenol by 17-Estradiol[J]. Journal of Hunan University: Natural Sciences, 2012,39(11):78-81.(In Chinese)
[7] 张光明,张盼月,朗朗.雌二醇与镉雌激素活性拮抗效应及其机制研究[J].湖南大学学报:自然科学版,2013,40(3):83-86.
ZHANG Guang-ming, ZHANG Pan-yue, LANG Lang. Rivalry effect of E2 and Cd on estrogenicity and potential mechanisms [J]. Journal of Hunan University:Natural Sciences, 2013,40(3):83-86.(In Chinese)
[8] RADICE S, CHIESARA E, FUCILE S. Different effects of PCB101, PCB118, PCB138 and PCB153 alone or mixed in MCF-7 breast cancer cells [J]. Food Chem Toxicol, 2008, 46: 2561-2567.
[9] 刘志恒.现代微生物学[M].北京:科学出版社,2002:487-509.
LIU Zhi-heng. Modern microbiology [M]. Beijing: Science Publisher, 2002: 487-509. (In Chinese)
[10] SADLER J, PUGAZHENDHI D, DARBRE P. Use of global gene expression patterns in mechanistic studies of oestrogen action in MCF7 human breast cancer cells [J]. J Steroid Biochem Mol Biol, 2009, 114(1/2): 21-32.
[11] SHIH Y W, SHIEH J M, WU P F. α-Tomatine inactivates PI3K/Akt and ERK signaling pathways in human lung adenocarcinoma A549 cells: Effect on metastasis [J]. Food Chem Toxicol, 2009, 47: 1985-1995.
[12] ANDREI L, GARTEL D, KSENYA S. Mechanisms of c-myc-mediated transcriptional repression of growth arrest genes[J]. Exp Cell Res, 2003, 283: 17-21.
[13] ALISON J B, CATRIONA M M, ELIZABETH M. A comparison of fecal occult-blood tests for colorectal-cancer screening[J]. Endocr Relat Cancer, 2005, 12: 47-53.
